新型IKKβ激酶抑制剂的体外抗胃癌活性
2019-06-03鲍苗黄崇贤胡俊朱露卫涛陈肖鸣
鲍苗,黄崇贤,胡俊,朱露,卫涛,陈肖鸣
(1.温州医科大学附属第一医院 小儿外科,浙江 温州 325015;2.温州医科大学 药学院,浙江 温州325035)
我国是胃癌发病大国[1]。目前胃癌的主要治疗手段为手术切除及化学药物治疗,常用的化疗药物为5-氟尿嘧啶、顺铂、多西紫杉醇等细胞毒类药 物[2-4]。这类药物最大的缺陷是不良反应严重,且易耐药。靶向药物因其高效低毒的特点,成为近年抗肿瘤药物的研究热点。然而胃癌的靶向药物研究相对滞后,仅有针对HER2和VEGFR的药物被批准用于临床治疗。
IκB激酶β(inhibitor of nuclear factor kappa-B kinase β,IKKβ)是细胞中核转录因子NFκB重要的调节酶,参与多种细胞生物途径。研究表明,其高表达与胃癌等多种肿瘤的发生密切相关,抑制肿瘤细胞内的IKKβ可达到抗肿瘤效果[5-8]。小分子IKKβ激酶抑制剂是目前研究热点,然而由于活性不强等原因,其抑制剂研究进展缓慢[8]。因此研发高效的IKKβ抑制剂具有非常重要的意义。
EF24为一种对多种肿瘤具有良好抗肿瘤活性的IKKβ抑制剂(IC50=72 μmol/L)[9],但其激酶抑制活性有待提高。我们对本实验室设计合成的EF24类似物进行了筛选,获得了一个激酶抑制活性更好的类似物H18(见图1),并研究了其体外抗胃癌活性。
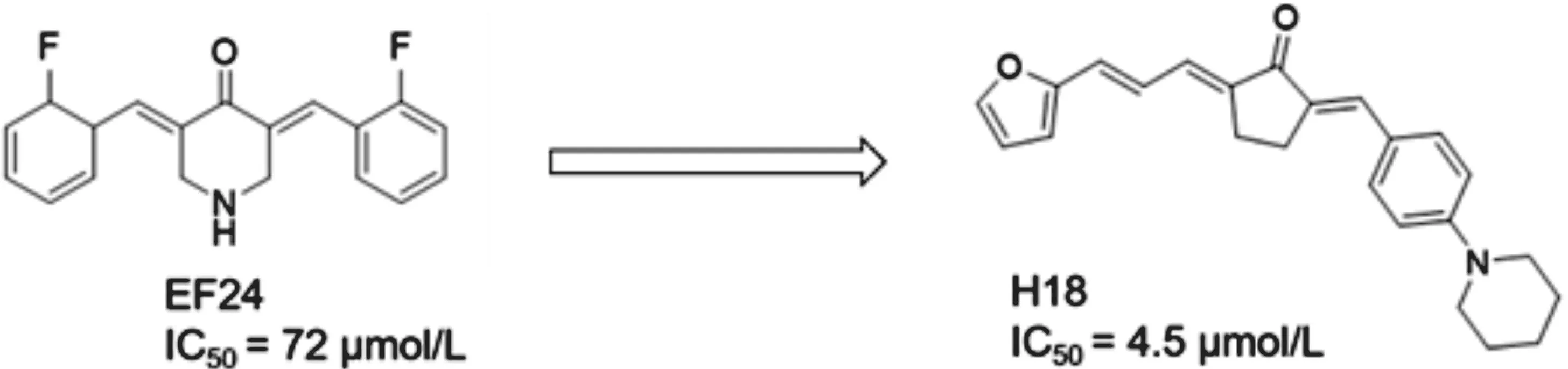
图1 H18的结构及发现
1 材料和方法
1.1 材料 人胃癌细胞BGC-823购于中国科学院上海细胞典藏库,RMPI-1640培养基、胎牛血清(fetal bovine serum,FBS)、0.25%含EDTA胰酶购于美国Gibco公司,PBS缓冲液、双抗购于美国Hyclone公司,MTT粉末购于北京索莱宝生物科技有限公司,抗人p-IKKα/β、IKKβ、IκBα、β-Actin抗体、抗兔二抗购于美国CST公司,TNF-α(T0157)和BMS345541(B9935)购于美国Sigma-Aldrich公司,CO2培养箱购于美国Thermo公司,DAPI染色液和结晶紫染色液购于上海碧云天生物技术公司。
1.2 方法
1.2.1 蛋白分子对接:下载人IKKβ蛋白晶体结构(PDB code:4KIK),与H18进行对接模拟。通过AutoDock模拟蛋白与分子对接形式,并进行可视化。
1.2.2 MTT实验:取对数生长期细胞,以3 000个每孔的密度铺在96孔板中,置于培养箱中过夜贴壁。第2天取出加药。H18用DMSO溶解配成0.39、0.78、1.56、3.12、6.25、12.5、25、50 μmol/L共8个浓 度,每个浓度设置3个复孔,每孔加药1 μL。同时设 置空白孔和DMSO孔。药物孵育72 h后,每孔加入MTT 孵育4 h,弃去培养液,用150 μL DMSO溶解紫色晶体,摇床上振荡10 min充分溶解,在酶标仪490 nm处测量吸光度。重复3次获得数据,计算IC50。
1.2.3 集落克隆实验:细胞每孔1 000个铺6孔板,过夜贴壁后换液加药。H18分别为5、10、20 μmol/L, 并用BMS345541作阳性对照。药物孵育7 h后换成完全培养基继续培养1周。用4%多聚甲醛固定15 min 后进行结晶紫染色,然后拍照。
1.2.4 DAPI染色:细胞每孔20万铺板,过夜贴壁后换液加药。H18分别为5、10、20 μmol/L,并用BMS345541作阳性对照。药物孵育时间48 h,然后用4%多聚甲醛固定后,避光加入DAPI染色液染色,在荧光拍照显微镜紫外光下拍照。
1.2.5 Western blot实验:细胞30 万每孔铺板,先加H18分别为5、10、20 μmol/L,并用BMS345541作阳性对照,孵育2 h后,然后除空白孔以外,每孔加TNF-α,终浓度为1.5 ng/mL。TNF-α刺激10 min后,马上冰上收蛋白。用考马斯亮蓝法定量配平后,加入loading buffer将蛋白样品煮沸变性。取等量蛋白样品进行SDS-PAGE凝胶电泳,再进行湿法转膜。 4 ℃过夜孵育一抗后,室温孵育二抗1 h,然后曝光。
1.3 统计学处理方法 采用GraphPad Prism 7.0软件进行统计学分析。计量资料以±s表示,运用独立样本t检验进行2组比较,多组比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 H18与IKKβ的分子对接 通过分子对接初步探讨化合物H18与IKKβ激酶的相互作用模式,对接结果见图2,H18环戊酮上的羰基氧原子与残基Leu307形成氢键相互作用;同时,H18能与IKKβ变构位点中的Leu123、Leu307、Leu311、Ile371和Leu376等氨基酸残基形成疏水作用。氢键作用与疏水作用的叠加效果使得化合物与激酶紧密结合。
2.2 H18抑制BGC-823生长 利用MTT法对H18的抗胃癌活性进行检测,结果发现H18以剂量依赖的方式抑制BGC-823细胞的生长,半数抑制浓度为(1.7± 0.3)μmol/L(见图3)。
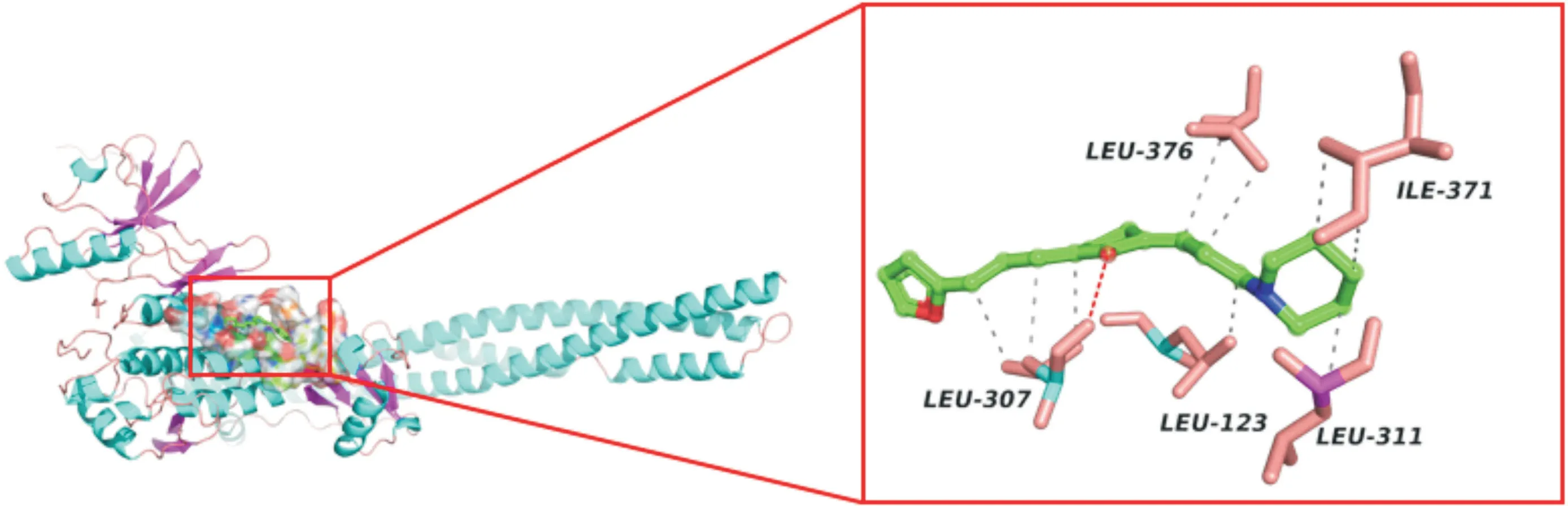
图2 H18与IKKβ的分子对接
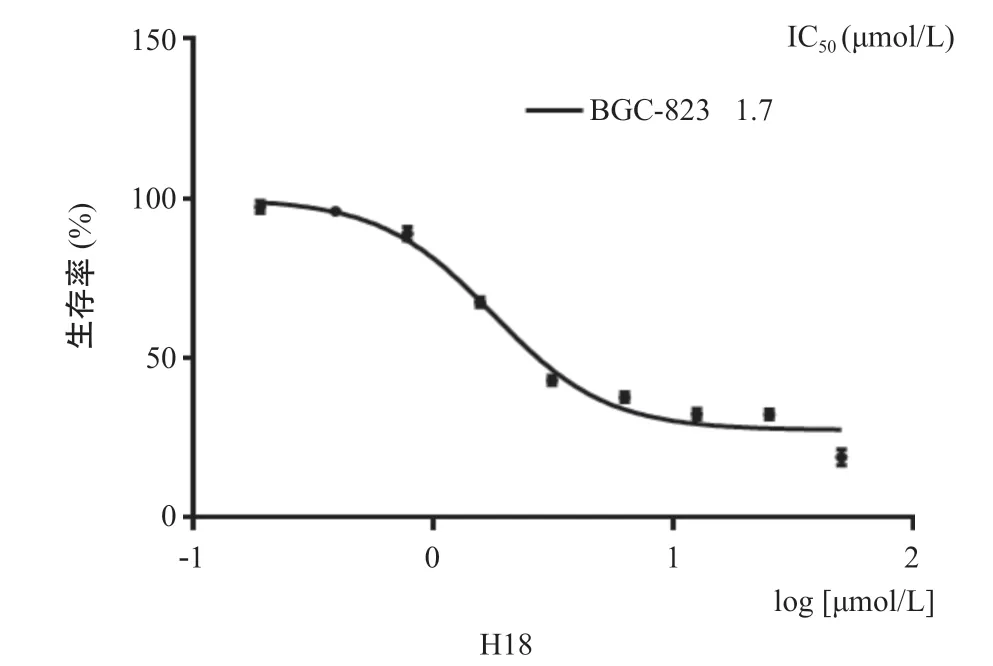
图3 H18作用72 h的浓度-生存曲线
2.3 H18对BGC-823增殖和凋亡的影响 集落克隆实验结果显示,H18孵育7 h能明显抑制BGC-823的克隆形成能力(见图4A)。DAPI染色结果显示,H18处理48 h,BGC-823细胞无明显凋亡改变,而相同条件下阳性对照BMS345541的刺激已造成部分细胞发生凋亡(图4B白色箭头所示)。以上结果说明,H18主要通过抑制细胞增殖分裂从而产生抗胃癌细胞的作用。
2.4 H18对IKK-NF-κB信号通路的影响 Western blot实验结果显示,对比空白组,TNF-α 10 min刺激后成功诱导了IKK-NF-κB信号通路的激活;与TNF-α组相比,提前2 h预孵的药物显著抑制了TNF-α诱导的IKKβ的激活。尽管H18的抑制活性不如同等条件下的BMS345541,但也表现出了显著的抑制活性(P<0.05);同时,H18可以剂量依赖性地抑制下游IκBα的降解,与BMS345541保持一致的效果(见图5)。从另一方面也提示NF-κB复合物另一亚单位,P65解离后调节生物学进程可能受到了部分抑制。这说明,IKKβ抑制剂H18对IKK-NF-κB的抑制可能促成了其体外抗胃癌活性。

图4 H18对BGC-823的增殖和凋亡的影响
3 讨论
目前胃癌的靶向治疗研究虽然很多[10],但是临床上已批准使用的仅有HER2抑制剂曲妥珠单抗、VEGFR抑制剂雷莫芦单抗和阿帕替尼[11]。此外,报道的胃癌潜在靶点也很多,常见的如:PTEN[12]、mTOR[13]以及其他多种非编码RNA[14-16]。
已有多项研究发现,抑制IKK可起到多种抗肿瘤作用:经典的IKK抑制剂BMS345541可在前列腺癌中抑制上皮间质转化,并促进肿瘤细胞凋亡,从而抑制前列腺癌转移[17]。ANTONIA等[18]发现,在LKB1缺陷的肿瘤患者中,IKK抑制剂与苯乙双胍可产生联合抗肿瘤的作用。VREKA等[19]研究发现,高表达的IKKα可与KRAS共同诱导肺癌的发生,抑制IKKα可起到良好的抗肺癌活性。本研究发现,在胃癌细胞中抑制IKKβ的磷酸化激活,可起到体外抗胃癌的活性,这与先前的研究结果一致。
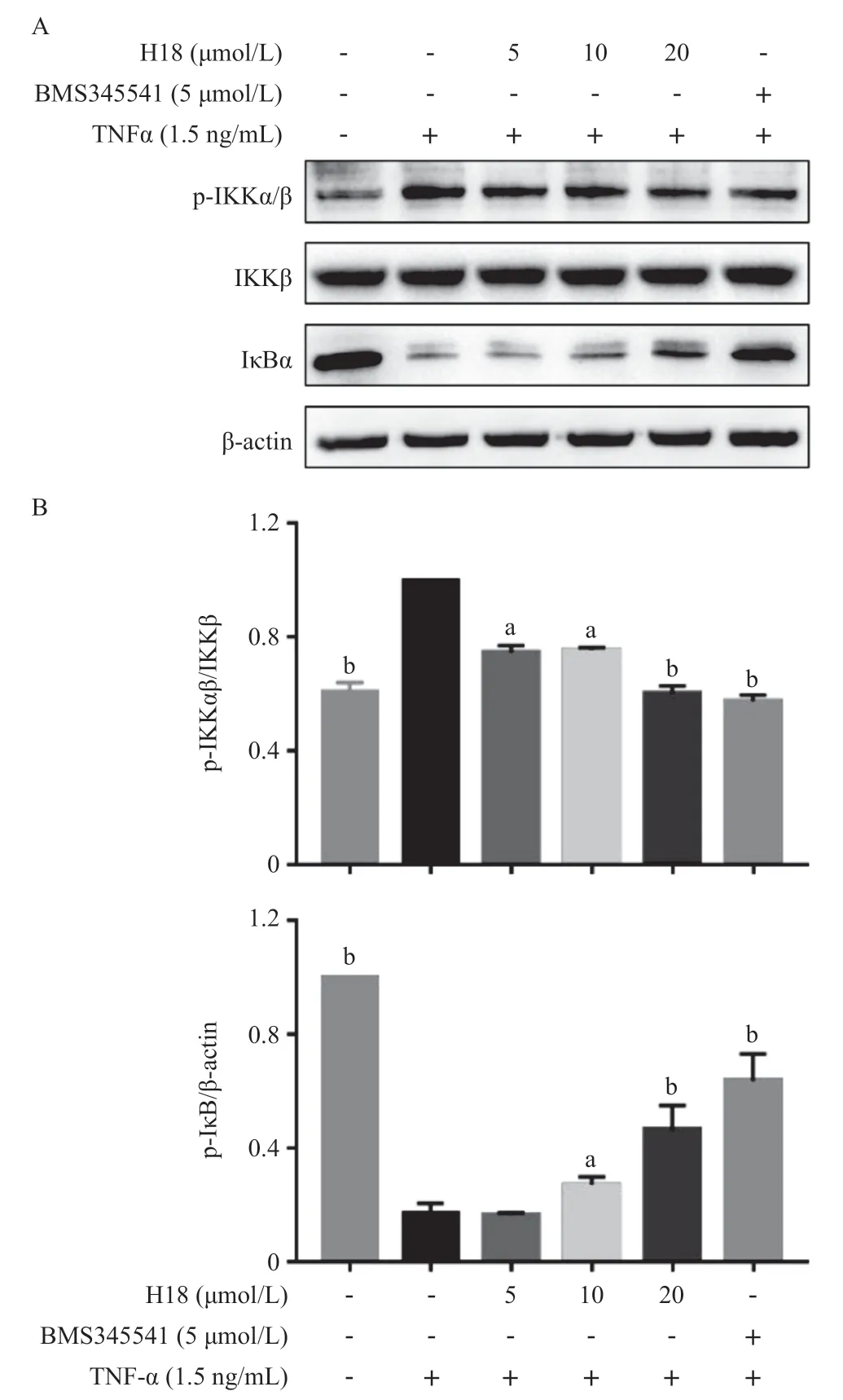
图5 IKKβ抑制剂H18对IKK-NF-κB的抑制作用
EF24作为一个经典的姜黄素类似物,研究认为其具有抑制NF-κB信号通路的作用[20]。以EF24为先导化合物,设计合成EF24类似物可提高其对NF-κB的抑制活性:通过优化N取代获得的化合物13 d,与EF24相比毒性下降,且对NF-κB的抑制活性得到提升[21];以EF24和F35为共同先导化合物设计合成的5B,可通过激活JUK及抑制NF-κB信号通路产生抗肺癌作用,并在体外增敏顺铂及5-氟尿嘧啶的化疗效果[22];不对称EF24类似物化合物81,通过抑制NF-κB信号通路产生抗肺癌作用[23]。本课题以EF24为先导化合物,将其结构进行改造,得到了新型化合物H18,使其对IKKβ的IC50从72 μmol/L降至 4.5 μmol/L,大大提高了其抑制活性,同时证明,新获得的化合物H18通过抑制IKK-NF-κB信号通路产生体外抗胃癌效果。
综上所述,我们的研究初步证明了IKKβ抑制剂H18的体外抗胃癌活性及机制,为IKKβ抑制剂的开发提供了新结构,为胃癌靶向治疗提供了新的策略。
