热应激对猪睾丸死亡受体Fas及其配体FasL表达与定位的影响
2019-06-01范小瑞岳美杉刘怡慧贺俊平
冀 睿,范小瑞,申 慧,岳美杉,刘怡慧,贺俊平
(山西农业大学动物科技学院,山西 太谷 030801)
体温下2~8 ℃为睾丸环境中精子发生的理想温度[1]。哺乳动物睾丸长时间暴露于高温环境,生精上皮中各级生精细胞受损,严重影响精子发生,导致生殖能力下降[1-4]。有研究报道,公猪在夏季精液品质下降,导致产仔数降低、生育能力下降[5],TUNEL 法检测到大量生殖细胞凋亡[6]。阴囊局部热刺激可导致细胞凋亡信号上调[6],成年食蟹猕猴睾丸43 ℃处理30 min 后,生精细胞的调亡比例升高[7];43 ℃热处理牛睾丸支持细胞1 h 后,细胞凋亡比例降低[8];43 ℃恒温水浴处理小鼠睾丸15 min 后,睾丸组织质量明显减少、生殖细胞凋亡率升高[9]。
死亡受体 Fas(Factor associated suicide)及其配体FasL 是细胞凋亡外源性通路的重要基因[10]。细胞膜表面的FasL 可与Fas 蛋白结合,通过死亡结构域聚合为三聚体复合物FADD(Fas-associated death domain),该复合物的N 末端与凋亡执行蛋白procaspase-8 进而诱导procaspase-3 活化,最终引发生精细胞凋亡[11-12]。Fas/FasL 系统是一种免疫应答的调控机制,该机制可以抑制由Fas 引起的活化淋巴细胞的凋亡[13-14]。Fas 配体(FasL,CD-95)是一种Ⅱ型膜结合蛋白,属于肿瘤坏死因子(TNF)家族,能以死亡受体Fas 为诱导而引发细胞凋亡[15]。
研究报道,Fas,FasL 在人[16]、猴[7]、牛支持细胞[6]、大鼠[17]、小鼠[12,15]睾丸组织中均有表达,揭示 Fas,FasL 与哺乳动物精子发生有着密切关系。而在细胞凋亡的调控信号通路中,死亡受体Fas 及其配体FasL在热应激猪睾丸的表达是否受影响还未见报道。
本研究以猪为试验对象,建立猪睾丸热应激模型,探索细胞凋亡基因Fas,FasL 在热应激猪睾丸组织中的表达情况,以阐明Fas,FasL 在热应激猪睾丸生殖细胞中的影响,旨在为研究Fas,FasL 在猪睾丸中精子发生的分子机制提供理论依据。
1 材料和方法
1.1 试验材料
供试材料为9 头14月龄性成熟长白公猪。
1.2 试验方法
试验随机建立3 组热应激模型,每组3 头,分别为对照组、环境热应激组(EHS)、局部热应激组(LHS)。其中,对照组不作任何处理,室温(20~25 ℃)圈养在猪舍中,每天正常给水、喂食;环境热应激组每日将猪饲养在37~40 ℃猪舍中3 h,结束后赶回室温猪舍,连续处理7 d;局部热应激组的猪用自制的可控温加热垫覆盖在左侧睾丸阴囊表面(42 ℃加热1 h)。各组猪睾丸处理结束后迅速将猪睾丸组织摘取,其中一部分组织切成1.5 cm3小块置于Bouin 液固定,用于石蜡组织切片的制作;剩余部分冻存于液氮,用于总RNA、总蛋白的提取。采用qRTPCR 与 Western Blotting 检测 Fas,FasL 的 mRNA 与蛋白的相对表达量,通过免疫组织化学染色观察生殖细胞的定位。
1.2.1 总 RNA 提取、cDNA 合成以及 qRT-PCR 检测 各试验组猪睾丸总RNA 由Trizo(lInvitrogen,USA)法提取,1%琼脂糖凝胶电泳法检测其在睾丸组织是否表达完整,采用ND-1000 浓度仪测定总RNA 浓度。cDNA 由反转录试剂盒(TAKARA,中国)合成,按照产品说明书标注的反应体系进行基因组DNA 去除,在200 μL 的EP 小管中加入并混匀 2 μL DNA Wipeout Buffer(7×) 以及 1 μg 总RNA,反应体系为14 μL,将EP 管常规放入PCR仪,并设定42 ℃恒温条件反应2 min;反应结束后,cDNA 合成,反应体系为:继续在小管中加入并混匀4 μL Quantiscript RT Buffer(5×),1 μL RT Primer Mix,1 μL Reverse-transcription master mix 以及 14 μL TotalRNA,将EP 管常规放入PCR 仪,设定加热反应条件:42 ℃,30 min;95 ℃,3 min;4 ℃冷却。cDNA模板于 -80 ℃保存。Fas,FasL 基因的 CDS 序列以NCBI 提供的Sus scrofa mRNA 全序列为标准,使用Primer 5.0 软件设计并通过华大基因公司合成qPT-RCR 扩增引物(表1)。
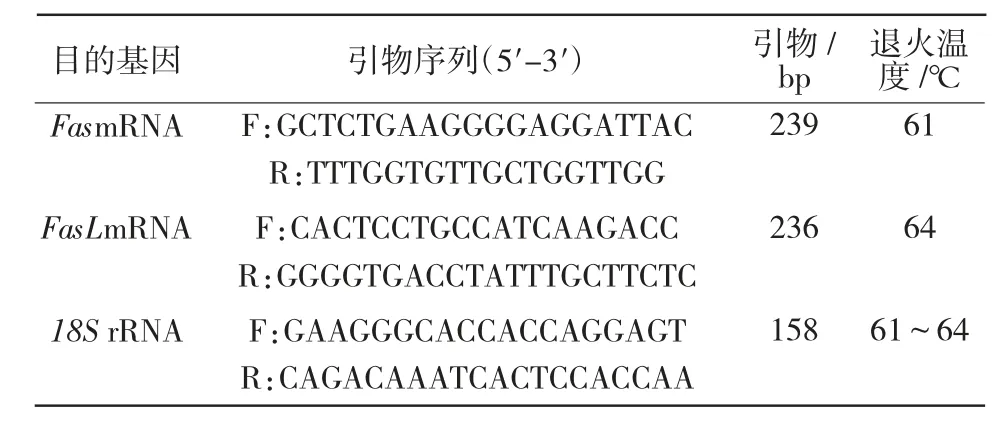
表1 qRT-PCR 引物序列及片段大小与其扩增条件
qRT-PCR 所需相关试剂由TAKARA 试剂盒提供,18S rRNA 作内参基因,基因在样品的扩增过程中,Fas,FasL 与内参均3 次重复;在八连管中加样结束后,将管放入实时荧光定量PCR 仪(Strata gene Agilent,USA),根据退火温度设置仪器。FasmRNA,FasLmRNA 在对照组和试验组猪睾丸中相对表达量由仪器给出的扩增曲线CT 值,结合18S rRNA对样品的标准化,通过2-ΔΔCT计算得出。
1.2.2 Western Blotting 检测 各组猪睾丸组织总蛋白通过蛋白裂解液(上海碧云天生物技术有限公司,中国)与现配的PMSF 提取,浓度由ND-1000浓度仪测定。SDS-PAGE 凝胶(武汉博士德生物工程有限公司,中国)配制的成型胶板中,蛋白样品在每格的上样量为200 μg,加样结束后在80 V 稳定电压电泳1.5 h,电泳结束后将有目的条带的胶条转移至NC 膜,转膜1 h,在5%脱脂奶粉室温封闭1 h,TBST 浸洗,分别加入第1 抗体:Fas(400 倍稀释,多克隆兔抗,北京博奥森生物技术有限公司,中国)、FasL(300 倍稀释,多克隆兔抗,北京博奥森生物技术有限公司,中国)、GAPDH(2 500 倍稀释,多克隆兔抗,北京博奥森生物技术有限公司,中国),密封,4 ℃层析柜摇床14~16 h;一抗孵育结束,摇床复温 30 min,TBST 浸洗 3 次,每次 10 min,加入第2 抗体:山羊抗兔IgG(6 000 倍稀释,北京康为世纪生物科技有限公司,中国),37 ℃孵育 1 h,TBST 浸洗 6 次,每次5 min;通过高灵敏度发光试剂(北京康为世纪生物科技有限公司,中国)曝光NC 膜,暗室压胶片曝光蛋白条带。Fas 蛋白、FasL 蛋白及内参GAPDH蛋白的试验结果由Image J 与相对表达量分析。
1.2.3 免疫组织化学 二甲苯与梯度酒精对石蜡切片进行透明、脱水,内源性过氧化物酶、羊血清封闭液、生物标记素、链霉菌抗生素以及DAB 显色液由迈新试剂盒(北京康为世纪生物科技有限公司,中国)提供。每片滴加 50 μL 3%H2O2,37 ℃恒温孵育10 min,PBS 缓冲液(pH=7.4)浸洗 3 次,每次 3 min;每片滴加50 μL 羊血清封闭液,37 ℃恒温孵育10 min,甩净,在阳性组各滴加 50 μL 第1 抗体:Fas(200 倍稀释,多克隆兔抗,北京博奥森生物技术有限公司,中国)、FasL(150 倍稀释,多克隆兔抗,北京博奥森生物技术有限公司,中国),阴性对照组滴加50 μL 正常非免疫兔血清;室温摇床30 min 充分混匀,4 ℃孵育 12~14 h;摇床复温 30 min,PBS 浸洗3 次,每次 3 min,每片滴加 50 μL 第2 抗体:多聚化山羊抗兔IgG(北京康为世纪生物科技有限公司,中国),37 ℃孵育 30 min,PBS 浸洗 3 次,每次 3 min;DBA 现配,暗光下在各阳性组显色30 s~120 min,苏木精复染6 min,蒸馏水浸洗2 次,每次2 min;梯度乙醇与纯二甲苯分别进行脱水、透明,封片,光学显微镜获取抗体在切片中细胞定位的试验结果。棕色表示抗体在细胞免疫阳性,阳性颜色的深浅与范围表示抗体的表达水平。
1.3 数据分析
所有与相对表达量相关的试验数据均由SPSS 16.0 进行单因素方差分析(One-way ANOVA)与显著性检验,P<0.05 表示差异显著,P<0.01 表示差异极显著。试验数据均以“平均值±标准误”表示。
2 结果与分析
2.1 FasmRNA与FasLmRNA相对表达量
qRT-PCR 结果显示,FasmRNA 在对照组中相对表达量为1.029±0.251,与对照组相比,环境热应激组相对表达量为1.293±0.192,是对照组1.256 倍,但差异不显著(P=0.304>0.05);局部热应激组相对表达量为4.123±0.566,是对照组的4.007 倍,且差异极显著(P<0.01)(图1-A);FasLmRNA 在对照组中的相对表达量为1.001±0.040,与对照组相比,环境热应激组相对表达量为0.570±0.062,是对照组的0.569 倍,且差异极显著(P<0.01),局部热应激组相对表达量为1.509±0.108,是对照组1.508 倍,且差异极显著(P<0.01)(图1-B)。

2.2 Fas与FasL蛋白在猪睾丸中的相对表达量
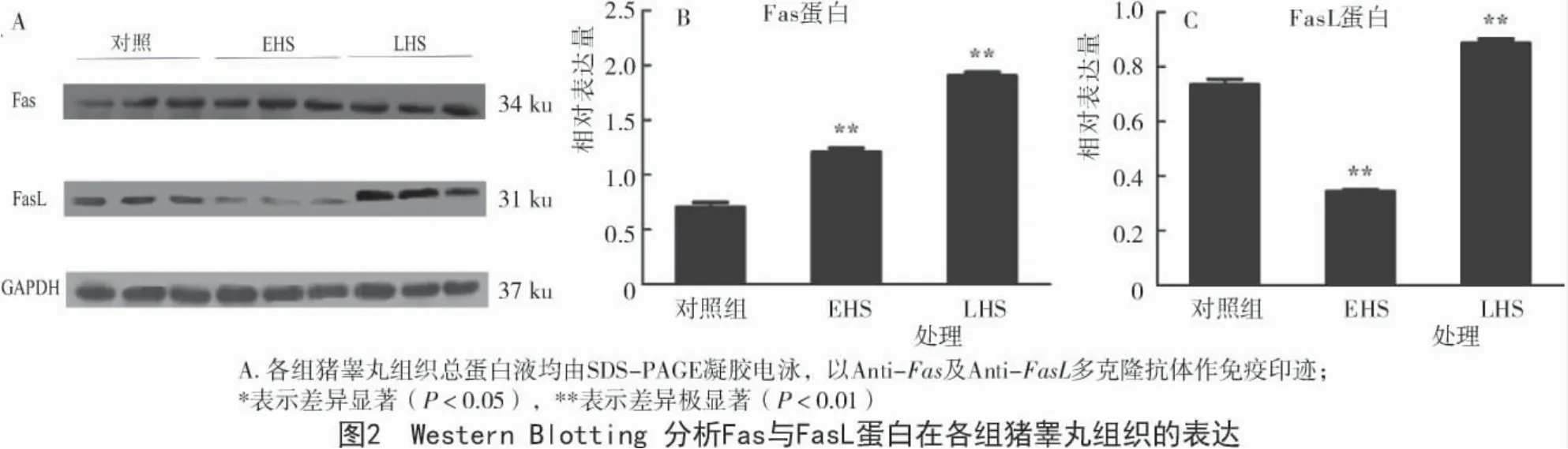
Western Blotting 检测结果显示,多克隆兔抗Fas(34 ku)与 FasL(31 ku)在各组猪睾丸蛋白提取物中均有阳性免疫反应条带(图2-A)。Fas 在对照组中的蛋白相对表达量为0.708±0.0738,在环境热应激组与局部热应激组中的蛋白相对表达量较对照有所升高,分别为 1.208±0.064,1.904±0.053,分别为对照组的1.706 倍和2.692 倍,且差异达极显著水平(P<0.01)(图2-B);FasL 在对照组中的蛋白相对表达量为0.735±0.035,在环境热应激组的蛋白相对表达量为0.344±0.011,低于对照组,是对照组的0.468 倍,且差异达极显著水平(P<0.01),在局部热应激组的蛋白表达量为0.887±0.026,高于对照组,为对照组的1.208 倍,且差异达极显著水平(P<0.01)(图2-C)。
2.3 免疫组织化学试验
2.3.1 Fas 在猪睾丸中免疫组织化学染色 Fas 在对照组猪睾丸中免疫组织化学反应阳性物(棕色)着色于精母细胞细胞膜,在精原细胞细胞质呈弱阳性表达(图3-A);与对照组相比,Fas 在环境热应激组中于精原细胞细胞质与精母细胞细胞膜呈阳性反应(图3-B),在局部热应激组中于精母细胞细胞膜与圆形精子细胞的细胞核、细胞膜与细胞质呈阳性反应(图3-C)。阴性对照切片以动物非免疫血清(羊)替作一抗,未发现特异性染色(图3-D)。

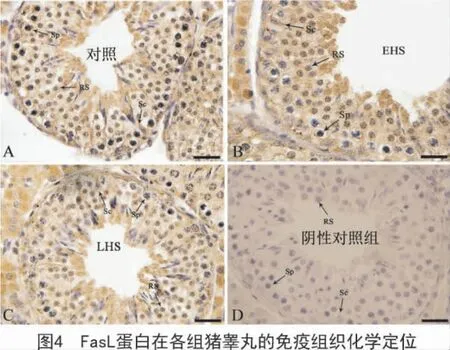
2.3.2 FasL 在猪睾丸中免疫组织化学染色 FasL在对照组猪睾丸中主要定位于支持细胞的胞质、圆形精子细胞的胞质与胞核、精母细胞的胞核与细胞膜(图4-A)。与对照组相比,FasL 在环境热应激组中在圆形精子细胞强阳性表达,支持细胞弱阳性表达(图4-B),在局部热应激组中的支持细胞、圆形精子细胞以及精母细胞均为强阳性表达(图4-C)。阴性对照切片以动物非免疫血清(羊)替作一抗,未发现特异性染色(图4-D)。
3 结论与讨论
Fas 及FasL 在各类组织和细胞中有凋亡调控的作用[18],有研究表明,Fas 抗体表达在生精细胞、FasL 抗体表达在支持细胞[16-17],揭示 Fas 及 FasL 与精子发生密切相关。
本试验结果显示,FasLmRNA 与蛋白的表达量在环境热应激组中低于对照组,在局部热应激组高于对照组,结果与43 ℃恒温水浴加热小鼠睾丸[9]、热处理牛支持细胞[8]结果相近,揭示FasL 在睾丸局部高温条件下参与调节生殖细胞的凋亡,环境高温中FasL 可能以自分泌或旁分泌的形式作用于细胞凋亡的调控。本研究中,免疫组织化学染色结果显示,Fas 抗体主要免疫阳性着色(棕色)于生精细胞及精子细胞中,已有大量文献报道并证实[19-20]。与对照组相比,Fas 在环境加热组中,精原细胞的细胞质的免疫阳性反应物着色度深于对照组,揭示精原细胞是热应激敏感的细胞类型;在局部热应激组中,Fas 抗体阳性表达于圆形精子细胞,揭示圆形精子细胞对瞬时热应激敏感。
对照组中,FasL 抗体在支持细胞、圆形精子细胞以及精母细胞都有表达,支持细胞上表达FasL 已有文献证实[21-23],研究表明,FasL 表达于生殖细胞[10],后经证实,FasL 也表达在精子细胞[24]与精母细胞[25]。在局部热应激组中,FasL 抗体强阳性表达,推测睾丸表面温度高,睾丸组织内生殖细胞细胞膜上的蛋白活性升高,死亡受体FasL 大量表达。
对照组中FasL 免疫阳性反应物着色深于环境热应激组,推测环境热刺激处理后,Fas,FasL 抗体的表达可能不依赖于外源性通路或者由于死亡受体Fas 敏感性太高,少量配体FasL 足够与其结合,揭示了生物体自我保护的一种凋亡方式。
本研究中发现,FasmRNA 和Fas蛋白在环境热应激组与局部热应激组中的表达均升高,揭示Fas对死亡受体FasL 的敏感性升高。生殖细胞与支持细胞表达的FasL 都以旁分泌或自分泌形式作用于邻近的生殖细胞,促使生殖细胞凋亡。热应激引起凋亡基因Fas,FasL 在猪睾丸组织中蛋白与mRNA相对表达量的变化,以及Fas 与FasL 抗体在睾丸生殖细胞中定位的改变,揭示Fas,FasL 可能与热诱导的猪繁殖率下降有关。
