黄芪多糖免疫调节作用及其机制研究进展
2019-06-01李树颖秦雪梅
李树颖,秦雪梅,李 科*
(1山西大学中医药现代研究中心,太原 030006;2山西大学化学化工学院;3地产中药功效物质研发与利用山西省重点实验室;*通讯作者,E-mail:like@sxu.edu.cn)
黄芪为豆科黄芪属植物蒙古黄芪Astragalusmembranaceus(Fisch.)Bge. var. mongholicus(Bge.)及膜荚黄芪Astragalusmembranaceus(Fisch.)Bge.的干燥根,性味甘微温,具有益卫固表,脱毒生肌,升阳举陷,健脾补中,利尿的功效,古有“补药之长之说”[1]。含有黄酮类、皂苷类、多糖、微量元素及氨基酸等多种成分[2],其中多糖类成分是其主要化学成分之一。研究表明,黄芪多糖(astragalus polysaccharides,APS)在抗肿瘤和抗感染方面具有显著的免疫调节作用。但是也存在一定问题:首先,APS以何种方式影响机体的免疫状态进而间接影响肿瘤的发生发展,或者APS是如何直接对肿瘤产生杀伤作用的,它们之间存在一种什么样的关系。其次,APS如何影响机体识别、应答和清除病原体的过程来调节免疫作用,从而治疗感染性疾病。本研究对近10年APS在免疫方面的文献进行分析,针对APS的抗肿瘤免疫和抗感染免疫作用及机制进行综述,为深入了解APS的作用机理及为APS的广泛合理应用提供参考。
1 APS的抗肿瘤免疫作用
APS的抗肿瘤免疫作用,各免疫细胞与细胞因子所起的免疫效应见图1。
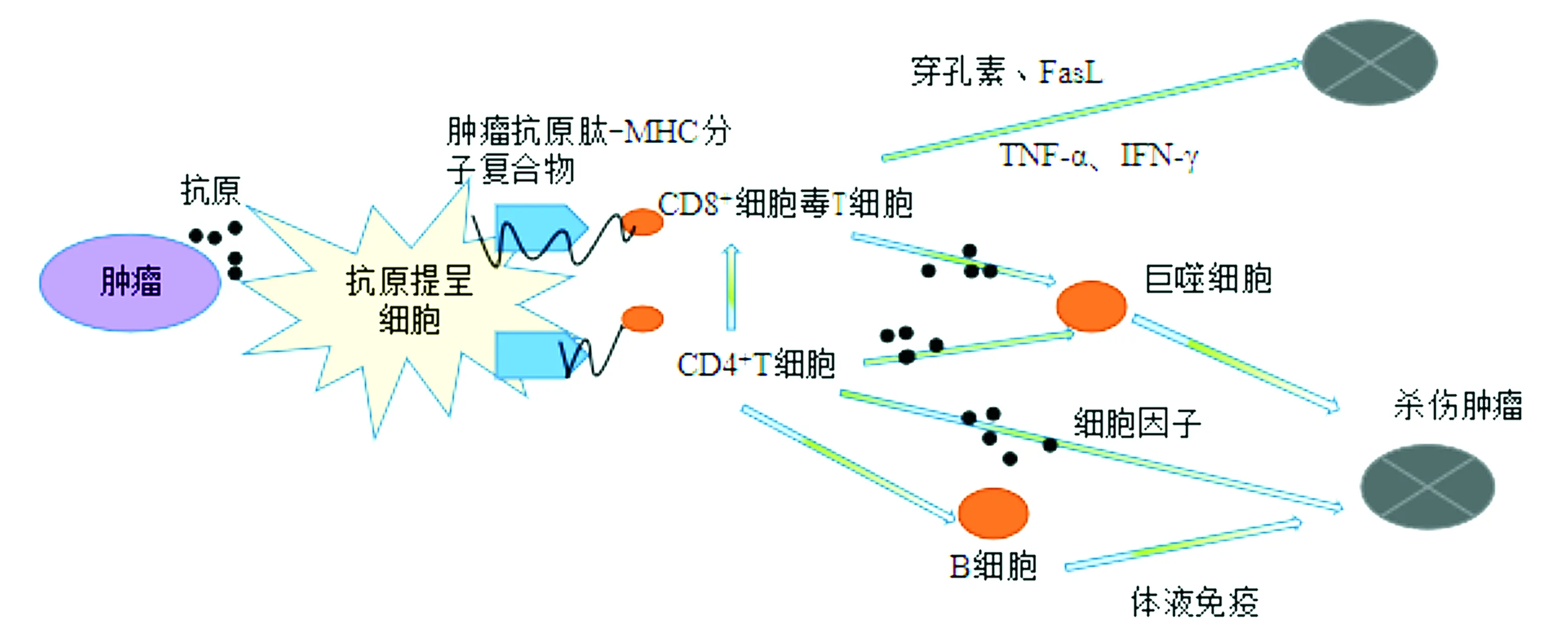
图1 各细胞及细胞因子参与机体抗肿瘤免疫调节Figure 1 Each cell and cytokine participates in the body’s anti-tumor immune regulation
1.1 在免疫细胞水平的调节
免疫细胞主要有两大类:①固有免疫细胞:单核/巨噬细胞、树突状细胞、NK细胞等;②参与适应性免疫的关键细胞:T细胞和B细胞。两种细胞彼此调控,促进机体免疫功能。
如图1所示,提高免疫细胞的活性,使其释放更多的细胞因子,介导肿瘤细胞溶解或凋亡,是抗肿瘤的一个至关重要的策略。孙芳等[3]提出APS联合125I通过提高NK、CD3+、CD4+、CD8+及CD4+/CD8+治疗中晚期非小细胞肺癌。Zhou等[4]研究表明APS联合云芝糖肽PSP草药配方能够上调外周血白细胞和胸腺指数,增强肺癌小鼠的免疫力,极大抑制肺癌细胞的生长,提高肺癌患者的生活质量和生存时间。苏鹏等[5]发现奈达铂联合黄芪多糖序贯性胸腔内给药可以升高患者外周血T淋巴亚群水平,对肺癌恶性胸水具有治疗效果。吴成军等[6]发现APS通过抗氧自由基作用,提高晚期胃癌患者的T淋巴亚群与NK细胞的活性,升高白细胞。因此,APS可通过增强机体固有免疫与适应性免疫细胞水平,提高抗肿瘤作用。
调节性T细胞Treg是具有负调节作用的免疫细胞[7],介导了免疫逃逸。因此通过抑制或清除调节性T细胞可以增强CD4+和CD8+参与的细胞免疫过程。Li等[8]提出APS在肿瘤微环境中抑制了调节性T细胞Treg的迁移,从而增强了APS对肝癌细胞的抑制作用。
综上所述,抗原提呈细胞APC通过识别肿瘤表面的抗原,将其分解为小分子肽段,与APC表面的肽结合槽结合,形成了肿瘤抗原肽-MHC分子复合物后,CD4+与CD8+结合该复合物,从而被激活,CD8+CTL通过释放细胞因子或穿孔素等诱导细胞凋亡,CD4+Th一方面释放细胞因子直接抗肿瘤,另一方面,参与B细胞的体液免疫以及巨噬细胞的抗肿瘤作用[9]。APS肿瘤免疫治疗通过提高APC、CTL水平,抑制Treg水平,增强机体固有免疫与适应性免疫,这也恰好验证了肿瘤免疫的治疗原理:增强效应细胞的杀伤能力,同时抑制或清除调节性免疫细胞对肿瘤的庇护。
1.2 在细胞因子水平的免疫调节
如图1所示,适应性免疫过程的正性细胞因子水平提高,可以促使巨噬细胞和自然杀伤细胞等发挥杀瘤效应,此为抗肿瘤的另一策略。白细胞介素IL-1~IL-38,干扰素IFN-α、IFN-β、IFN-ε、IFN-ω、IFN-κ、IFN-γ,肿瘤坏死因子TNF-α等细胞因子由活化的免疫细胞或者非免疫细胞分泌,参与免疫细胞的分化和发育,如IFN-γ可以促进Th0细胞分化为Th1细胞,参与免疫应答和免疫调节,IL-1、IL-2、IL-4、IL-5、IL-6等可分别促进T/B细胞的活化增殖,参与固有免疫,IL-2、IL-12等可促进NK细胞对病毒细胞的杀伤作用。
田庆锷[10]提出APS通过增加IL-1a、TNF-α等因子表达以及淋巴因子IL-2、IL-6的表达,减少负性调节因子IL-10产生,从而杀死细胞,具有辅助ADM抗肝癌作用。周丽菁[11]研究发现APS能够促进外周血中细胞因子TNF-α、IL-1β和IL-6的分泌,提高脏器指数,促进肿瘤细胞凋亡。从黄芪的水提物中纯化出的一种平均分子量为1 334 kD的水溶性多糖(RAP),能显著升高RAW264.7细胞上清液中NO、TNF-α和IL-6的产生[12]。IL-6作为B细胞的分化因子和T细胞的活化因子起作用。TNF-α和NO在体内某些肿瘤中的巨噬细胞细胞毒性功能中起重要作用。
APS提高细胞因子水平在治疗肿瘤中的作用可以给我们研发新型抗肿瘤药物提供启示,通过瘤内直接注射免疫细胞因子,诱导更多的NK细胞和T细胞浸润到肿瘤中,具有更强的抗肿瘤作用[13],也有报道用细胞因子抗体融合蛋白以及免疫细胞因子的组合来调节疾病部位免疫系统活性[14]。未来用于新辅助目的的瘤内给药免疫细胞因子药物将成为最直接最快捷的抗肿瘤药物。
1.3 对相关基因表达的影响
Bcl-2蛋白是一种关键的凋亡抑制因子,其表达减少必然会促进细胞凋亡。线粒体在细胞凋亡中发挥着关键作用,是细胞凋亡的控制中心。线粒体内凋亡分子Caspases受凋亡相关基因Bcl-2的调控后,直接破坏细胞结构,引发线粒体凋亡途径[15]。APS能降低人肺癌细胞A549的Bcl-2的表达,升高Bax水平,从而抑制A549细胞的增殖[16]。明海霞等[17]发现APS可能通过下调肿瘤组织中NF-κB、P53基因和蛋白的表达,下调Bcl-2、Fas L等抗凋亡基因的表达,上调Bax等促凋亡基因的表达,使Bcl-2/Bax比例降低,诱导肿瘤细胞凋亡。吴朝妍等[18]也证明NF-κB在APS抗肿瘤效应中的作用,得出APS抑制人肺癌细胞增殖,发挥抗肿瘤作用,可能与抑制NF-κB的信号通路有关。
T细胞在多种信号作用下,诱导了转录因子的活化,促进了T细胞的活化,活化的效应T细胞通过高表达死亡受体Fas,与肿瘤细胞的死亡配体FasL结合,启动了Caspase死亡途径,降低了凋亡相关基因Bcl-2的表达,介导肿瘤细胞凋亡。APS可以通过影响肿瘤细胞相关基因对其进行直接杀伤作用。
1.4 对胞内信使物质的影响
腺苷酸活化蛋白激酶(AMPK-activated protein kinase,AMPK)是真核细胞生长、代谢、自噬的一种十分必要的调节因子[19]。mTOR是许多信号通路的交集点,是整合多种信号的关键,主要体现在能量方面。宋杰等[20]设置APS治疗组和APS加AMPK阻断剂的处理组,分别作用于肝癌HepG2细胞。与对照组相比,各实验组的总AMPK表达无明显变化,p-AMPK在APS各浓度组显著升高,加入阻断剂的各组无变化,p-mTOR在APS各浓度组显著降低,加入阻断剂的各组无变化。因此推测APS通过AMPK-mTOR信号通路发挥抗肿瘤作用。研究表明,AMPK被激活会使细胞增殖和生长停滞,因此推断肿瘤细胞周期阻滞,细胞凋亡可能的原因是AMPK信号被激活。张虹等[21]提出APS能浓度依赖和时间依赖性抑制人乳腺癌细胞的生长,使细胞周期始终处于S期,阻止其进入G0-G1期。吴小进等[22]提出APS能够调节细胞周期,抑制人乳腺癌细胞MCF-7增殖诱导其凋亡,使乳腺癌细胞生长停滞。
Toll样受体(Toll like receptors,TLRs)是先天性免疫的病原识别受体,是连接非特异性免疫与特异性免疫的桥梁,主要介导炎症与免疫反应,TLR4是黄芪多糖(RAP)的受体并介导其免疫调节活性,Wei等[12]研究表明RAP能够快速激活TLR4相关的MAPKs,包括磷酸化的ERK,磷酸化的JNK和磷酸化的p38,诱导NF-κB的转位以及IκB-α的降解,因此,RAP通过MAPKs和NF-κB信号通路表现出强大的免疫增强活性。MyD88是TLR4主要的下游蛋白,TLR4在接受肿瘤抗原信息后,通过MyD88通路活化MyD88蛋白,使其下游与其相关蛋白发生磷酸化,促使静息状态的核转录因子NF-κB进入细胞核,激活相关基因发生转录,进而促进树突状细胞(DCs)的成熟,成熟后的DC分泌多种细胞因子,继而活化T细胞,增强抗肿瘤的细胞免疫[23]。周丽菁[11]研究发现APS显著刺激了TLR4、MyD88、TRAF-6、NF-κB的表达。TLR4信号通路在APS治疗乳腺癌方面的作用,通过检测TLR4信号通路关键节点表达的情况,利用特异性分子阻断剂反向验证了TLR4信号通路在APS治疗乳腺癌方面的作用,并且验证了TLR4-MyD88依赖途径是其信号通路。
综上所述,APS通过与细胞表面的模式识别受体如TLR4结合,激活细胞内多种信号通路,最终激活NF-κB,促进免疫细胞的活化和增殖,提高了细胞因子水平,NF-κB调节下游靶基因,如细胞周期蛋白D1和p53[24],促进细胞的凋亡和周期阻滞。“糖受体学说理论”研究成果表明[25,26],多糖中存在一个或几个由单糖组成的寡糖片段活性中心,多糖在发挥免疫调节作用时,仅是多糖中的活性寡糖片段起作用,这些寡糖与免疫细胞表面的识别受体结合,而且疗效比多糖还高,副作用较少。该理论为多糖的构效关系研究提供了研究基础。
2 APS的抗感染免疫调节
感染是免疫缺陷最主要、最严重的临床表现,易发生化脓菌、无包膜病毒感染以及真菌、结核菌、疱疹类病毒感染。感染性疾病是人类常见病和致死的主要病种之一。抗感染免疫中固有免疫参与抵抗病原体的第一道防线,皮肤黏膜屏障可直接抵御侵袭,巨噬细胞通过模式识别受体(PRR)识别病原体PAMP而分泌多种促炎因子促进炎症反应,同时为诱导适应性免疫奠定基础。适应性免疫应答中体液免疫与细胞免疫相互配合共同抵御病原体。促炎细胞因子在炎症反应中发挥重要作用,例如TNF-α可以活化炎症细胞,增强其吞噬、杀伤功能,释放炎症介质,直接杀死微生物并参与炎症损伤。但是,抗感染免疫会使体液中出现多种炎性细胞因子,引起全身炎症反应综合征,甚至导致多器官功能障碍。因此,该方面的免疫调节作用分增强机体免疫力与降低炎症两方面。
2.1 抗病毒感染免疫
大量研究表明,天然多糖和化学修饰的天然多糖对人免疫缺陷病毒,单纯疱疹病毒,柯萨奇病毒B3,巨细胞病毒,流感病毒和肝炎病毒具有显著的抑制作用[27]。巨噬细胞通过识别病毒表面的病原体相关模式分子(PAMP),分泌TNF-α/β,使固有免疫发挥作用。适应性免疫中,一方面抗体中和病毒,另一方面也会促进巨噬细胞吞噬病毒,CTL特异性杀伤感染病毒的靶细胞。Chen等[27]研究表明TNF-α/β是宿主抗病毒感染的第一道防线。此外,宿主NK细胞和巨噬细胞也起着重要作用。多糖可以增强宿主的免疫力,增加NK细胞的活力,或促进干扰素和抗病毒免疫因子的产生,它还可以间接抑制病毒复制并加速病毒清除过程。此外,APS可以抑制禽传染性支气管炎病毒复制来抑制禽传染性支气管炎病毒感染[28]。
2.2 抗真菌感染免疫
少量致病菌可被中性粒细胞、巨噬细胞吞噬清除,抗体对真菌感染的保护作用,主要是细胞免疫,Th1和Th2导致细胞损伤。费霖莉等[29]发现APS通过增强血液中特异性IgG和黏膜sIgA抗体水平即通过增强体液免疫与黏膜免疫,治疗小鼠生殖道感染沙眼衣原体。Yin等[30]研究表明APS是TLR4的配体,在早期阶段促进TLR4的表达,能够激活小鼠巨噬细胞和T细胞,促进炎症因子IL-6、TNF-α的表达,从而增强抗菌活性。Hou等[31]研究表明APS可以通过增加血液中Th17细胞百分比,降低Treg的百分比,并抑制了血液CD4+T细胞向Th2的极化,增加肠道IgA浓度,增强了免疫功能,使APS在败血症期间控制了免疫稳态。王晓曼等[32]发现APS能通过增强巨噬细胞的活性,提高TNF-α、IL-12和IFN-γ水平,提高猪布鲁菌S2株感染小鼠的免疫功能。
综上所述,APS通过增加B细胞分泌的抗体,增强免疫细胞活性,以及促进炎性因子的产生提高机体免疫,另一方面,通过降低调节性T细胞的表达发挥作用。
2.3 减少炎症发生
TNF-α主要是由单核细胞、巨噬细胞、T细胞等产生,具有强促炎作用,可以调节细胞的增殖和分化,它能激活多种免疫细胞,引起“细胞因子风暴”。患者的严重并发症主要是由促炎细胞因子过量产生的细胞因子风暴引起的[33],因此,必须减少TNF-α,缓解炎症反应。臧凯宏等[34]发现APS可以减少三硝基苯磺酸诱导的溃疡性结肠炎模型小鼠结肠组织中髓过氧化物酶、IL-1β、TFN-α水平,从而降低炎症反应,改善黏膜屏障功能。
探究促炎因子的作用机制,Yuan等[35]研究表明TNF-α和IL-8的过量产生诱导炎症性肠病,APS通过抑制p38的活化从而降低了TNF-α和IL-8水平,降低了肠道炎症。NF-κB是免疫功能相关的许多基因表达的关键调节因子,影响细胞因子如IL-2、IL-6等表达的活化,NF-κB通路可以作为慢性炎症疾病(如动脉粥样硬化、风湿性关节炎等)及癌症的治疗靶点[36]。Lv等[37]提出APS治疗硫酸葡聚糖钠DSS诱导的结肠炎是通过抑制NF-κB的表达,使TNF-α,IL-1β和IL-6的分泌减少。Toll样受体是机体识别病原体的主要固有免疫受体,它通过作用于下游My D88信号分子,激化核转录因子NF-κB,调控细胞黏附分子、细胞因子等发挥免疫学效应。卢春化等[38]研究表明APS通过抑制Toll样受体信号转导通路TLR4/7-My D88-NF-κB从而降低炎性细胞因子TNF-α,IL-1β及IL-6的表达,缓解流感病毒所致的肺损伤。因此,APS是通过抑制p38活化和抑制NF-κB的表达,从而使TNF-α,IL-1β和IL-6等炎性因子减少,减轻了炎症反应。
综上所述,APS可以通过多种信号通路降低炎症因子的表达,从而减轻了机体的炎症反应,同时NF-κB通路作为许多慢性炎症疾病治疗靶点,为我们开发新型靶向药物提供了理论基础。
3 总结与展望
目前,多糖在免疫调节中的作用广受关注,在抗肿瘤方面,多糖对于肿瘤有直接杀伤与间接杀伤作用,一方面通过影响肿瘤细胞周期、线粒体损伤、细胞凋亡等发挥直接抗肿瘤作用;另一方面,通过调节免疫细胞活性与免疫因子的分泌提高了机体的免疫力,从而间接发挥杀伤肿瘤作用,并且可能存在一种多糖给药剂量的关系,剂量低对肿瘤细胞主要发挥间接杀伤作用,剂量高对肿瘤细胞发挥直接杀伤作用[24]。在抗感染方面,在病原体早期侵入时可以通过提高机体的固有免疫,增强机体皮肤黏膜的屏障作用,同时通过固有免疫模式识别激活免疫细胞,产生炎性细胞因子,也提高了适应性免疫对病原体的彻底清除能力,后期由于炎性细胞因子产生过多,引起持续炎症反应,损害机体的器官,APS可以减少炎症因子的产生,从而降低炎症反应。
APS作为中药黄芪的活性成分,具有中药毒性小的特点,同时它具有中药独特的调节功能,既可以在免疫低下时提高机体免疫力,又可以在炎症持续时,降低促炎因子的产生发挥免疫抑制作用,体现了中药的双向调节作用[39]。已渐渐发展成为新型的免疫调节剂,在调节机体免疫力方面发挥重要作用。
存在的问题:多糖结构复杂,成分繁多。多糖的分离纯化和结构解析是分析多糖的一大难题,因而使得多糖在免疫调节方面的构效关系和分子机制的研究受到一定的限制。突破由于多糖纯度不高及结构难于精准测定的技术瓶颈,虽然任务艰巨,但是一些新的策略已经逐渐被报道,例如“多糖受体学说”研究成果表明,多糖与受体结合时仅是多糖中的寡糖片段与受体结合,继而激活细胞内信号通路,发挥免疫调节作用[26,40,41]。多糖中的这些活性寡糖的免疫调节活性将比多糖更高,而且这些活性寡糖片段的结构相比于多糖更容易鉴别,使得多糖的构效关系变得明晰。相信在未来几年,多糖在免疫调节方面的构效关系以及更深层次的作用机制会更加明晰。
