少弱精子症患者精子候选差异蛋白Cu-Zn SOD和GSS的验证及其表达研究
2019-05-31蒋丹丹斯依提阿木提张盼盼努尔比亚阿力甫白生宾阿地力江伊明
蒋丹丹, 斯依提·阿木提, 张盼盼, 努尔比亚·阿力甫, 白生宾, 阿地力江·伊明
(新疆医科大学基础医学院, 乌鲁木齐 830011)
精子的质量、数量及形态学改变是影响受精的重要因素,而其中精子蛋白质功能改变是影响上述因素的关键点[1]。但由于精子的成熟、获能及受精等过程中涉及的蛋白质非常复杂,且种类繁多,给研究带来一定困难。故本研究收集临床少弱精子症患者精液并分离精子后,采用串联质谱标签(TMT)技术对少弱精子症差异蛋白进行筛查,并在生物信息学分析的基础上,选取铜锌超氧化物歧化酶(Cu-Zn SOD)和谷胱甘肽合成酶(GSS),在少弱精子症患者精子中进行了验证,同时检测其在少精子症、弱精子症患者中的表达,探讨Cu-Zn SOD和GSS在少精、弱精及少弱精子症中的生殖生物学意义,现报道如下。
1 材料与方法
1.1 研究对象选择2017年7月-2018年4月在新疆医科大学第一附属医院生殖医学中心就诊的男性,受试者采用手淫法将精液收集到无菌容器中,立即送检,置于37℃恒温水浴箱中,液化后按《WHO人类精液检查与处理实验室手册》(第五版)[2]的标准进行检测,排除患有生殖道感染、性传播疾病、输精管堵塞、肿瘤、外伤手术及糖尿病等疾病的男性精液,收集符合少精子症(O组)、弱精子症(A组)、少弱精子症(OA组)和正常组(N组)诊断标准的精液标本,患者数量依次为105例、150例、50例和106例,经过离心后得到精子,制备精子涂片、提取精子蛋白备用。
1.2 主要仪器与试剂WLJY-9000型彩色精子质量检测系统(北京伟力公司),DYY-8C电泳仪(方正公司),FE 0723凝胶成像仪(Santa Clara 公司),Nikon ECLIPSE 80i显微镜(尼康公司),兔抗人抗体Cu-Zn SOD、GSS(Proteintech公司),细胞裂解液(碧云天生物技术公司),BCA蛋白定量试剂盒(聚合美生物科技有限公司),超敏ECL化学发光试剂盒(新赛美生物科技公司),Cy3标记山羊抗兔IgG(H+L)(碧云天生物技术公司),DAPI染色液(碧云天生物技术公司)。
1.3 实验方法
1.3.1 TMT技术筛选少弱精子症差异表达蛋白 人精子样品加入RIPA裂解液后,通过bradford法定量蛋白,并取每个样品100 μg蛋白体积,加入胰蛋白酶,37℃水浴24 h后使用TMT标记试剂盒对酶解得到的肽段进行同位素标记。使用强阳离子交换色谱柱对样品进行HPLC预分离。使用Q-Exactive质谱仪检测16个预分离的组分,并用PD(Proteome Discoverer 1.4,thermo)软件定量分析,选取P<0.05,差异倍数≥1.2或≤0.833的蛋白为差异蛋白。
1.3.2 免疫荧光 精子涂片经甲醇固定10 min,自然风干后PBS洗3次→5% BSA封闭30 min→兔抗人Cu-Zn SOD(1∶50)、GSS(1∶50)抗体湿盒内4℃孵育过夜→PBS洗6次→Cy3标记山羊抗兔IgG(H+L)37℃孵育2.5 h→PBS洗6次→DAPI染核10 min→PBS洗3次→封片后荧光显微镜下2 h内观察并采集图像。
1.3.3 免疫印迹实验(Western-blot) 4组精子经裂解液提取蛋白,测定浓度,后与5×上样缓冲液混合沸水煮10 min。根据目的蛋白的分子量,配置分离胶及浓缩胶,并且上样开始电泳,80 V,30 min后,将电压改为120 V,持续90 min。用甲醇激活的PVDF膜进行转膜2 h,5 %脱脂牛奶封闭2 h,根据目的蛋白条带大小切膜后用兔抗人Cu-Zn SOD(1∶300)、GSS(1∶300)将抗体在4℃孵育过夜,第二天取出膜后TBST洗3次,二抗(1∶6 000)在室温下孵育2 h,TBST洗3次,ECL检测试剂盒A液和B液按1∶1混匀后滴入PVDF膜,并用凝胶成像仪观察。
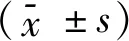
2 结果
2.1 TMT技术筛选少弱精子症差异蛋白Cu-Zn SOD和GSS结果以差异倍数≥1.2或≤0.833为标准,差异蛋白Cu-Zn SOD和GSS均为下调蛋白。在少弱精子症差异蛋白结果中,Cu-Zn SOD为下调差异蛋白(为N组的0.77倍),GSS为下调差异蛋白(为N组的0.82倍),见表1。

表1 Cu-Zn SOD和GSS在少弱精子症差异蛋白的结果
2.2 精子中Cu-Zn SOD表达的验证荧光显微镜下,免疫荧光结果显示,Cu-Zn SOD(红色荧光)定位在人精子尾部中段和主段。与N组比较,Cu-Zn SOD蛋白在O组、A组和OA组精子的尾部中段和主段荧光强度明显减低,差异有统计学意义(P<0.05)。Western-bolt实验结果显示,O组、A组和OA组精子Cu-Zn SOD蛋白的表达明显低于N组,差异有统计学意义(P<0.05),见图1和表2。



N



O



A



OA
Cu-Zn SOD DAPI Merge


2.3 精子中GSS表达的验证荧光显微镜下,免疫荧光结果显示,GSS(红色荧光)定位在人精子尾部中段和主段。与N组比较,GSS蛋白在OA组精子的尾部中段和主段荧光强度明显减弱或缺失,差异有统计学意义(P<0.05)。Western-bolt结果显示,OA组精子GSS蛋白表达明显低于N组,差异有统计学意义(P<0.05),见图2和表2。

表2 免疫荧光检测4组人精子中Cu-Zn SOD和GSS蛋白的表达
注:与N组比较,*P<0.05。



N



O



A



OA
GSS DAPI Merge


3 讨论
根据WHO资料显示,育龄夫妇中受到不育不孕困扰的约占20%,其中男性因素占40%~60%[3]。而少弱精子症是男性不育的主要原因之一,少弱精子症占男性不育的46%[4]。由于少弱精子症的病因和发病机制复杂多样,虽治疗方法包括西医和中医,但总体治疗效果差,逐渐成为影响男性生殖健康的重要因素[5]。
氧化应激发生在活性氧(ROS)显著升高并超过人体正常的抗氧化防御时。生理水平的ROS在精子获能中必不可少,并可影响精子运动、DNA完整性及精卵结合能力[6]。但ROS的升高可致精子质量下降,包括精子数量的减少及活力的减低[7]。研究表明,在不育男性中ROS可以升高40%~80%[8]。精子易受ROS的损伤,故抗氧化剂的存在可以保护精子免受损伤。精子和精浆中均含有丰富的抗氧化剂,如SOD、谷胱甘肽(GSH)、硫氧还蛋白/硫氧还蛋白还原酶(Trx/TrxR)系统等。

GSH具有多种重要的生理功能,特别是对维持体内的氧化还原环境。在人精子中,GSH还与Trx/TrxR系统共同调节抗氧化蛋白,而抗氧化蛋白可以将超氧化物、过氧化氢等转变为H2O,从而清除ROS,避免精子损伤[13]。并且研究表明,GSH对精子症发生的早期及精卵结合的早期反应都起着关键的作用[14]。GSH是在GSS的催化下生成的,并且GSS的表达水平可直接影响GSH的含量[15],GSS含量的减少可干扰GSH生成,但目前的研究尚未阐明GSS在精子内的影响。在本次研究中,GSS在少弱精子症中含量减少,这与TMT筛查的结果一致,在少精子症和弱精子症中虽下调表达,但不显著,对于其在这两种疾病精子中的影响有待进一步研究。在少弱精子症的精子中,由于GSS含量的减低,GSH合成减少,抗氧化作用减弱,此时精子处于氧化应激状态。
蛋白质组学可从整体的角度分析少弱精子症精子的差异蛋白,而本研究根据差异蛋白的结果,又考虑到氧化应激是少弱精子症的重要发病机制之一,故选取Cu-Zn SOD和GSS进行验证。结果证实Cu-Zn SOD、GSS可做为少弱精子症的潜在候选标志物,并可为临床上少弱精子症的筛查和治疗提供可能靶点。
