高良姜多糖对荷瘤小鼠MFC胃癌移植瘤的抑制作用
2019-05-31帕丽达阿不力孜热娜古丽海里吾丛媛媛胡君萍米仁沙牙库甫
帕丽达·阿不力孜, 热娜古丽·海里吾, 丛媛媛, 胡君萍, 米仁沙·牙库甫
(新疆医科大学药学院, 乌鲁木齐 830011)
复方小艾飞蜜膏是由金钱白花蛇、高良姜、胡椒、荜拨、干姜5味药材组成的抗癌制剂,高良姜为该抗癌制剂的主药,临床上常用于胃癌、食道癌、消化道和生殖系统炎症等的治疗,课题组前期研究已证实该复方对胃癌具有良好的治疗作用[1]。高良姜为姜科山姜属植物高良姜(AlpiniaofficinarumHance)的干燥根茎,具有祛风、温胃、行气、散寒、止痛等功效[2],主要含黄酮类、挥发油类、二芳基庚烷类及多糖类成分,具有抗肿瘤、抗氧化、降血糖、免疫促进、抗菌等药理活性[3]。目前国内外研究主要集中于高良姜中黄酮类、二芳基庚烷类成分的抗肿瘤、降血糖和降血脂等活性[4-7],对高良姜多糖的研究仅限于其最佳提取工艺[8]及降胆固醇、抗氧化活性[9-10],未见高良姜多糖抗肿瘤活性的相关报道。本研究通过建立小鼠MFC移植瘤模型,拟探究高良姜多糖的抗肿瘤活性及其作用机制,现报道如下。
1 仪器与试药
1.1 仪器Smart Cell HF-90型CO2细胞培养箱(上海力康仪器有限公司),HF1200LC型生物安全柜上(海力康仪器有限公司),Neofuge 15R型台式高速冷冻离心机(上海力康仪器有限公司),TGL-16GB型台式低速离心机(上海飞鸽仪器有限公司),DK-80型恒温水浴锅(上海精宏仪器厂),YDS-50-125型液氮罐(成都金凤仪器厂),DW-HL388型-20℃低温冰箱(合肥美菱公司),DW-HL290型-80℃低温冰箱(合肥中科美菱低温科技有限责任公司),AB304-S型电子分析天平(德国梅特勒),Research plus型手动单道移液器(德国Eppendorf公司),xMarkTM型酶标仪(美国Bio-Rad公司),TP1020型脱水机(德国Leica公司),EG1150型全自动石蜡包埋机(德国Leica公司),RM2235型全自动石蜡切片机(德国Leica公司),H500S型光学显微镜(日本Nikon公司),倒置显微成像系统(日本Nikon公司)。
1.2 试药胎牛血清(美国Life technologies公司,批号:16000044),RPMI1640培养基(美国Life technologies公司,批号:11875-093),VEGF试剂盒(美国andygene公司,批号:AD2719MO),PCNA试剂盒(美国andygene公司,批号:AD2574MO),IL-2试剂盒(美国andygene公司,批号:AD2442MO),IL-6试剂盒(美国andygene公司,批号:AD0169MO),IFN-γ试剂盒(美国andygene公司,批号:AD2418MO),5-氟尿嘧啶(天津金耀药业有限公司,批号:20160926)。
1.3 药材高良姜2016年7月购自新疆本草堂药业(批号:16071335),经新疆医科大学药学院帕丽达·阿不力孜教授鉴定为姜科山姜属植物高良姜(AlpiniaofficinarumHance)的干燥根茎。
1.4 动物ICR小鼠60只,雌性,体质量(20±2)g,购自上海斯莱克实验动物有限责任公司,动物生产许可证号:SCXK(沪)2012-0002,动物批号:20161227,饲养于上海中医药大学中药研究所SPF级动物房,恒温恒湿,正常饮食饮水。
1.5 细胞株小鼠胃癌MFC细胞购自中国科学院典型培养物保藏委员会细胞库-中国科学院上海生命科学研究院细胞资源中心。
2 方法
2.1 高良姜多糖的制备将高良姜用清水洗净、去蒂、切片、干燥并粉碎,过60目筛后可得高良姜粉末。取适量的高良姜粉末,乙醚脱脂,80%乙醇除去杂质,于95℃用水浸提3 h,抽滤后可得高良姜多糖提取液。将提取液浓缩,醇沉,离心,并用无水乙醇、丙酮、乙醚等多次洗涤沉淀,沉淀经干燥后即得高良姜多糖。
2.2 胃癌MFC荷瘤小鼠模型的建立及给药方法无菌条件下取对数生长期小鼠胃癌MFC细胞,制备成浓度为1.2×107个/mL的细胞悬液。随机取50只小鼠右腋窝皮下接种细胞悬液(0.15 mL/只),建立荷瘤小鼠模型,建模24 h后,将接种小鼠胃癌MFC细胞悬液的50只小鼠随机分为5组,每组10只,模型组(生理盐水,20 mL/kg体质量)、阳性对照组(5-氟尿嘧啶,剂量25 mg/kg体质量,每两天腹腔注射1次)、高良姜多糖低(15 mg/kg体质量)、中(30 mg/kg体质量)、高(60 mg/kg体质量)剂量组。另取10只正常小鼠作为正常组(生理盐水,20 mL/kg体质量),每组小鼠每天灌胃1次,连续给药14 d。
2.3 指标的测定方法各组小鼠于末次给药24 h后,称取体质量,处死小鼠,剥离肿瘤、胸腺、脾脏并称重,按公式:抑瘤率%=(模型组瘤重-给药组瘤重)/模型组瘤重×100%,胸腺指数=(10×重量)/体质量,脾脏指数=(10×重量)/体质量,分别计算抑瘤率,胸腺指数和脾脏指数。
2.4 观察小鼠心、肝、脾、肺、肾组织的病理学变化将分离出来的小鼠心、肝、脾、肺、肾组织用4%多聚甲醛固定,经石蜡包埋、切片、HE染色后,置于光学显微镜下观察各脏器形态结构的变化。
2.5 ELISA法检测血清中细胞因子的含量小鼠处死前,摘眼球取血,分离血清,按试剂盒操作流程,检测小鼠血清中VEGF、PCNA、IL-2、IL-6和IFN-γ的含量。
2.6 统计学处理采用SPSS 19.0统计软件进行分析,多组间比较应用单因素方差分析,组间多重比较采用LSD法,检验水准α = 0.05。
3 结果
3.1 高良姜多糖对胃癌MFC荷瘤小鼠移植瘤瘤重的影响给药14 d后,阳性对照组、高良姜多糖低、中、高剂量组小鼠瘤重分别为(0.34±0.16)g、(0.74±0.28)g、(0.59±0.24)g、(0.46±0.26)g,各组小鼠平均抑瘤率分别为61.36%、15.91%、32.95%、47.73%。与模型组比较,阳性对照组、高良姜多糖中、高剂量组小鼠瘤重较低,差异有统计学意义(P<0.05)。与阳性对照组比较,高良姜多糖低、中剂量组小鼠瘤重较高,差异有统计学意义(P<0.05),高良姜多糖高剂量组小鼠瘤重无变化,差异无统计学意义(P>0.05),见表1、图1。
3.2 高良姜多糖对胃癌MFC荷瘤小鼠胸腺指数和脾脏指数的影响与模型组比较,阳性对照组小鼠胸腺指数降低,差异有统计学意义(P<0.05);高良姜多糖低、中、高剂量组间胸腺指数无变化,差异无统计学意义(P>0.05);高良姜多糖高剂量组小鼠脾脏指数升高,差异有统计学意义(P<0.05);阳性对照组、高良姜多糖低、中剂量组小鼠脾脏指数无变化,差异无统计学意义(P>0.05)。与阳性对照组比较,高良姜多糖低、中、高剂量组小鼠胸腺指数升高,差异有统计学意义(P<0.05);高良姜多糖高剂量组小鼠脾脏指数升高,差异有统计学意义(P<0.05);高良姜多糖低、中剂量组小鼠脾脏指数无变化,差异无统计学意义(P>0.05),见表2。
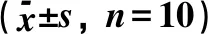
表1 高良姜多糖对胃癌MFC荷瘤小鼠移植瘤的影响
注:与模型组比较,*P<0.05; 与阳性对照组比较,#P<0.05。

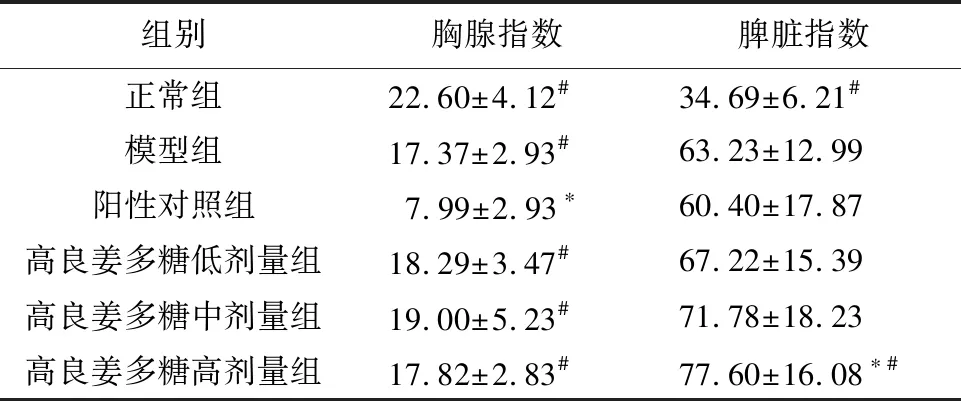
组别胸腺指数脾脏指数正常组22.60±4.12#34.69±6.21#模型组17.37±2.93#63.23±12.99阳性对照组7.99±2.93∗60.40±17.87高良姜多糖低剂量组18.29±3.47#67.22±15.39高良姜多糖中剂量组19.00±5.23#71.78±18.23高良姜多糖高剂量组17.82±2.83#77.60±16.08∗#
注:与模型组比较,*P<0.05; 与阳性对照组比较,#P<0.05。
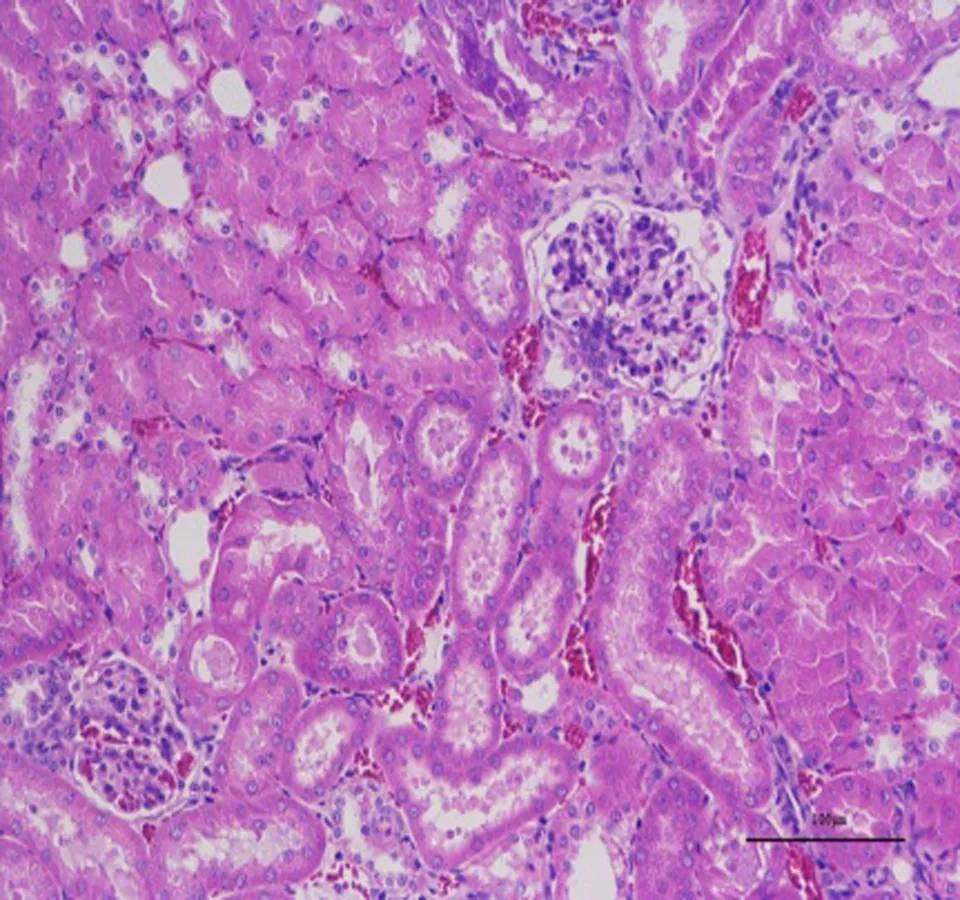
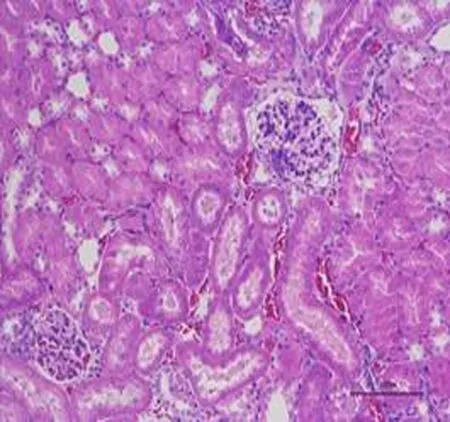
3.3 高良姜多糖对胃癌MFC荷瘤小鼠各器官的影响与正常组比较,高良姜多糖高剂量组小鼠心、肝、肾、肺各器官的病理学切片均未见差异,未出现炎性细胞浸润等现象,提示高良姜多糖对小鼠心、肝、脾、肺、肾等脏器无损伤作用,见图2、3。

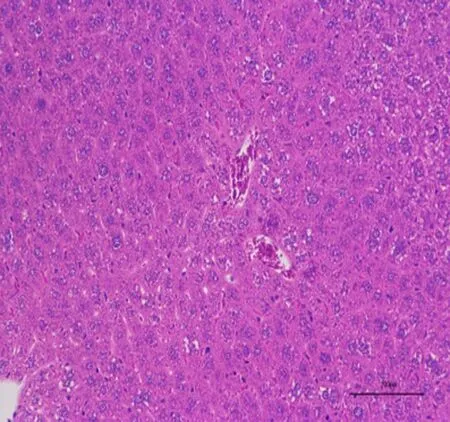


A:心B:肝C:肾D:肺E:脾
图2 正常组小鼠脏器组织切片图(HE 200×)



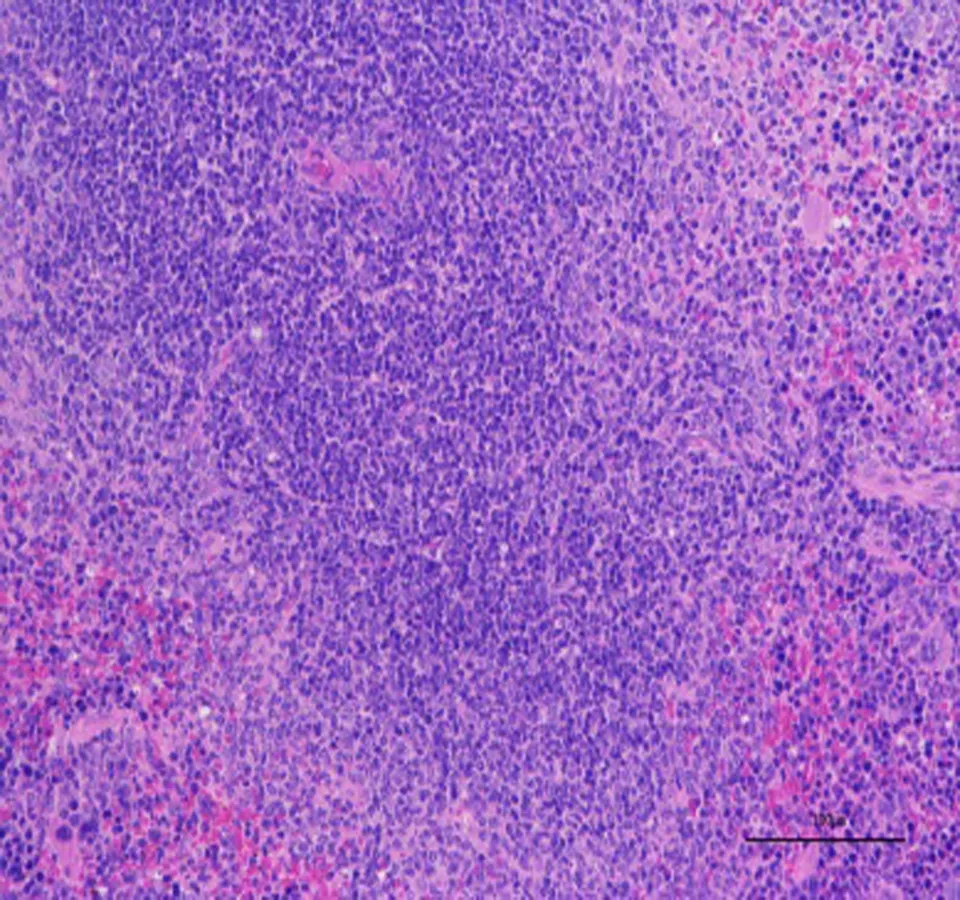
A:心B:肝C:肾D:肺E:脾
图3 高良姜多糖高剂量组小鼠脏器组织切片图(HE 200×)
3.4 高良姜多糖对胃癌MFC荷瘤小鼠血清中IL-2、IFN-γ和IL-6含量的影响与模型组比较,高良姜多糖高剂量组、阳性对照组小鼠血清IL-2、IFN-γ水平升高,差异有统计学意义(P<0.05);高良姜多糖低、中剂量组间小鼠血清IL-2、IFN-γ水平无变化,差异无统计学意义(P>0.05);高良姜多糖低、中、高剂量组、阳性对照组小鼠血清IL-6水平降低,差异有统计学意义(P<0.05)。与阳性对照组比较,高良姜多糖低、中剂量组小鼠血清IL-2、IFN-γ水平降低,差异有统计学意义(P<0.05);高良姜多糖高剂量组小鼠血清IL-2、IFN-γ水平无变化,差异无统计学意义(P>0.05);高良姜多糖低、中、高剂量组小鼠血清IL-6水平降低,差异有统计学意义(P<0.05),见表3。
表3 高良姜多糖对胃癌MFC荷瘤小鼠血清中IL-2、IFN-γ和IL-6含量的影响
注:与模型组比较,*P<0.05; 与阳性对照组比较,#P<0.05。
3.5 高良姜多糖对胃癌MFC荷瘤小鼠血清中VEGF和PCNA含量的影响与模型组比较,高良姜多糖低、中、高剂量组、阳性对照组小鼠血清VEGF水平、PCNA水平均降低,差异有统计学意义(P<0.05)。与阳性对照组比较,高良姜多糖低、中、高剂量组小鼠血清VEGF水平升高,差异有统计学意义(P<0.05);高良姜多糖低剂量组小鼠血清PCNA水平升高,差异有统计学意义(P<0.05);高良姜多糖中、高剂量组小鼠血清PCNA水平无变化,差异无统计学意义(P>0.05),见表4。
表4 高良姜多糖对胃癌MFC荷瘤小鼠血清中VEGF和PCNA含量的影响
注:与模型组比较,*P<0.05; 与阳性对照组比较,#P<0.05。
4 讨论
5-氟尿嘧啶是临床上治疗消化道肿瘤最常用的化疗药物,它在体内转化为5-氟尿嘧啶脱氧核苷酸后可抑制脱氧胸苷酸合成酶,干扰DNA的合成,导致肿瘤细胞损伤和死亡。胸腺指数和脾脏指数是反映机体免疫功能的初步指标。本次研究结果显示,5-氟尿嘧啶可降低荷瘤小鼠胸腺指数,高良姜多糖可提高荷瘤小鼠脾脏指数,提示高良姜多糖在调节荷瘤机体免疫功能方面具有一定优势。辅助性T淋巴细胞(helper T cell,Th cell)是主要由Th1和Th2独立亚群构成的一类重要的抗肿瘤免疫活性细胞。Th1型细胞可通过分泌IL-2和IFN-γ等细胞因子,刺激CTL细胞的增殖和分化,进而特异性杀伤靶细胞,介导肿瘤细胞坏死或凋亡。IFN-γ还可增强NK细胞的杀伤能力,抑制肿瘤生长。IL-6等Th2型细胞因子可降低NK细胞活性和巨噬细胞的抗原提呈能力,造成机体免疫能力的减弱,导致肿瘤免疫逃逸。Th1、Th2型细胞因子可间接反映Th1/Th2平衡,在荷瘤机体中,该平衡会向Th2漂移,且可通过正反馈机制,进一步促进Th2型细胞的增殖分化,抑制Th1型细胞生长[11-12]。因此,维持Th1/Th2平衡在恶性肿瘤的免疫调节中具有至关重要的作用。高良姜多糖能够提高血清中Th1型细胞因子IL-2和IFN-γ含量,同时降低Th2型细胞因子IL-6的水平,提示高良姜多糖可通过纠正荷瘤机体Th1/Th2平衡向Th2漂移,进而调节MFC荷瘤小鼠的免疫功能。血管内皮生长因子(vascular endothelial growth factor,VEGF)可刺激肿瘤血管内皮细胞增生、迁移,诱导血管生成[13-14]。增殖细胞核抗原(Proliferating Cell Nuclear Antigen,PCNA)为DNA聚合酶的辅助蛋白,参与调节DNA的合成,与细胞增殖、周期密切相关,是评价癌细胞增殖状态的重要指标[15]。高良姜多糖降低了MFC荷瘤小鼠血清VEGF和PCNA水平,该结果提示高良姜多糖可抑制肿瘤血管新生和肿瘤细胞的增殖。
综上所述,高良姜多糖可有效抑制荷瘤小鼠MFC移植瘤生长,对小鼠各器官未产生明显的毒副作用,其抗肿瘤活性可能与调节Th1/Th2细胞平衡,增强机体免疫功能,抑制肿瘤血管的新生和肿瘤细胞的增殖有关。
