青藏高原金露梅灌丛草甸植物群落对退化演替的响应
2019-05-31戴黎聪郭小伟柯浔杜岩功张法伟李以康李茜林丽曹广民朋措吉舒锴
戴黎聪 ,郭小伟,柯浔 ,杜岩功,张法伟,李以康,李茜,林丽,曹广民,朋措吉 ,舒锴
1. 中国科学院西北高原生物研究所,青海 西宁 810001;2. 中国科学院大学,北京 100039
金露梅(Potentilla fruticosa)灌丛草甸是青藏高原高寒草地生态系统的重要组成之一,分布面积达102469 km2(盛海彦等,2009),仅次于高山嵩草(Kobresia pygmaea)草甸面积,其分布区域主要在3200-4500 m的山地阴坡、半阳坡及洪积扇上,金露梅灌丛草甸由于含有丰富的蛋白质和高热量,被广泛作为牲畜的主要饲料来源(盛海彦等,2009)。同时,金露梅灌丛草甸还具有一定的水源涵养功能(王启基等,1991),对青藏高原的水热平衡及生态屏障功能的维持发挥着重要的意义(苏爱玲等,2010)。
近年来,随着人口的剧增,为了满足人类的需求,畜牧业快速发展,导致金露梅灌丛草甸发生严重退化,主要表现为高度、盖度减小,分布面积逐渐萎缩,演替状态逐渐向杂类草地和黑土滩-次生裸地发展(盛海彦等,2009)。同时,植被的减少促进了鼠类活动的大量繁殖生长,形成恶性循环,致使群落生产力降低、生态系统功能和结构发生改变,最终导致生态系统稳定性下降、生态功能丧失殆尽(张法伟等,2014)。因此,相关研究学者对高寒草甸的退化做了大量研究,包括恢复治理及可持续发展等方面研究(武高林等,2007;戴黎聪等,2018),如林丽等(2016)通过研究不同演替状态下高寒嵩草演替特征发现,减牧措施可以促进豆科和禾本科植物的生长,而抑制莎草科和杂类草植物生长,并提出了高寒草甸退化状态判别的地方标准,根据不同植物功能群对牧压响应的不同,制定了不同放牧管理措施。还有研究表明,适度放牧可以促进群落物种多样,而过度放牧导致植物群落结构发生改变,物种多样性减小,导致杂类草群落成为优势种群,草地生产力降低(李永宏等,1999;董全民等,2004;张法伟等,2014)。因此,放牧强度和放牧时间对植物群落有显著影响(汪诗平等,1998)。尽管过去对退化草地进行了大量研究,并取得一定进展,但总体而言,以往研究多集中于高寒草甸退化研究,而对金露梅(Potentilla fruticosa)灌丛草甸植物群落退化研究较为匮乏,尤其关于放牧驱动下金露梅草甸退化的地下根系垂直分布更是鲜见报道。
基于此,本研究以空间代时间的方法,探究不同演替状态下(原生、中度退化、重度退化、极度退化)金露梅灌丛草甸群落演变特征,以期为青藏高原退化的金露梅灌丛草甸的恢复治理、可持续利用及生态保护提供理论依据。
1 试验区概况
研究区位于中国科学院海北高寒草甸生态系统定位站的干柴滩地区,其地理位置为 37°39′56″-37°40′26″N,101°20′39-101°21′27″E,地形为祁连山北支冷龙岭东段南麓的洪积扇。受高原大陆性气候影响,该区无明显四季之分,一年只有冷暖两季,冬季寒冷干燥,夏季湿润多雨。年均气温为-1.7 ℃,7月为最热月份,平均气温为 9.8 ℃,1月份为最冷月份,平均气温为-14.8 ℃;年降水为580 mm左右,且主要集中于生长季(5-9月),约占全年的 80%(曹广民等,2007)。根据其盖度大致可分为4种演替阶段,金露梅盖度>90%为原生灌丛(原生金露梅灌丛),金露梅盖度70%-90%为中度退化(丛间草地),20%-70%为重度退化(重度退化样地),<20%为极度退化(极度退化样地)(张法伟等,2014),具体样地情况见图1。为了排除空间差异引起的气候、植被和土壤背景值差异,样地之间的最大空间距离小于30 km。其中原生金露梅灌丛,以金露梅为优势种群,伴生种有垂穗披碱草(Elymus nutans)、草地早熟禾(Poaprsten)、矮篙草(Kobresia humilis)、雪白委陵菜(Potentilla nivea)、珠芽寥(Polygonum vivipsrum)和圆叶毛茛(Ranunculus indivisus)等,中度退化、重度退化和极度退化以草本植物为主。该区域土壤类型为高山灌丛草甸土,草皮层较为疏松,有较厚的腐殖质层,有机质质量分数为9%-13%(盛海彦等,2009;戴黎聪等,2018),具体土壤养分特征见表1。

图1 不同退化金露梅灌丛草甸样地Fig. 1 Different degradation stage of Potentilla fruticosa shrub meadow
2 数据来源与分析方法
2.1 采样方法
采用空间分布代替时间演替的方法研究金露梅灌丛草甸不同退化状态植被群落演替特征,在 4种金露梅灌丛草甸演替阶段测定其地上生物量、地下生物量和物种丰富度。其中,地上生物量采用标准收获法,样方面积为50 cm×50 cm,重复4次;地下生物量现存量测定采用根钻法(Ф为7 cm),按0-10、10-20、20-30、30-40、40-50和50-60 cm 分层采集,重复5次,随机采集于地上生物量调查样方中,然后将根系冲洗干净,于 65 ℃下烘干至恒重,称重。土壤有机质采用重铬酸盐容量法,土壤全碳和全氮采用元素分析仪(Perkin Elmer 2400II)测定。
2.2 分析方法
本研究根系垂直分布参照Gale et al.(1987)方法,其公式如下:

式中,Y是根系生物量累积比例;d是表示土层深度;β是模型评估参数,β值介于0-1之间,β越大表明根系分布越深,β越小表示根系分布越浅。本研究采用单因素方差分析方法比较不同退化状态地上和地下生物量的差异;运用Origin 9.0软件绘制统计图。
3 结果与分析
3.1 不同退化状态下地上和地下生物量现存量特征

图2 不同退化状态下金露梅灌丛草甸地上和地下生物量现存量演变特征Fig. 2 Change characteristics of aboveground biomass and belowground biomass under different degradation states of Potentilla fruticosa shrub meadow
随着金露梅灌丛退化程度的加剧,其地上生物量和地下生物量现存量均呈逐渐减小趋势(图2),且原生金露梅灌丛样地(387.73±25.53) g·m-2和中度退化样地(328.55±36.23) g·m-2地上生物量显著高于重度退化样地(210±35.04) g·m-2和极度退化样地(182.19±49.99) g·m-2(P<0.05);原生金露梅灌丛样地 (4846.01±747.10) g·m-2和 中 度 退 化 样 地(4723.99±505.64) g·m-2地下生物量现存量显著高于重度退化草地(2590.75±276.45) g·m-2和极度退化草地(1011.84±163.46) g·m-2(P<0.05)。此外,不同演替状态下,不同植物功能群地上生物量响应特征存在一定差异(图3),禾本科和豆科地上生物量随着退化程度的加剧表现为先增加后减小趋势;莎草科地上生物量呈逐渐下降趋势,而杂类草表现为先减小后增加趋势。

表1 不同退化梯度下金露梅灌丛草甸土壤性质比较Table 1 Comparisons of soil characteristics under different degradation states of Potentilla fruticosa shrub meadow
3.2 不同退化状态下根系生物量垂直分布特征
不同演替状态下根系生物量垂直分部存在一定的差异(图4),原生金露梅灌丛样地、中度退化样地、重度退化样地和极度退化样地0-10 cm根系生物量占总根系生物量比例分别为(0.57±0.07)、(0.60±0.03)、(0.68±0.03)和(0.68±0.03),表明随着金露梅退化程度的加剧,植被根系生物量趋于向表层土壤分布,且随着土层深度的增加,不同退化样地根系生物量均呈逐渐减小趋势,总体呈“T”型分布(图4)。此外,原生金露梅灌丛和中度退化样地的β值大于重度退化草地和极度退化草地(图5),进一步证实了退化导致根系生物量向浅层发展。
3.3 不同退化状态下群落物种丰富度及其与地上生物量关系
随着金露梅灌丛退化程度的加剧,群落物种丰富度呈逐渐下降趋势,且原生金露梅灌丛和中度退化样地物种丰富度显著高于重度退化和极度退化样地(P<0.05)(图 6)。同时,群落物种丰富度与群落地上生物量呈显著正相关关系(r2=0.22,P=0.04)(图 7)。
4 讨论
4.1 不同退化状态下地上生物量和地下生物量现存量分异特征

图3 不同退化状态下金露梅灌丛草甸不同植物功能群地上生物量变化特征Fig. 3 Change characteristics of aboveground biomass of different plant functional groups under different degradation states of Potentilla fruticosa shrub meadow

图4 不同退化状态下金露梅灌丛草甸不同土层深度根系生物量比例Fig. 4 Proportion of root biomass across different soil layers under different degradation states of Potentilla fruticosa shrub meadow
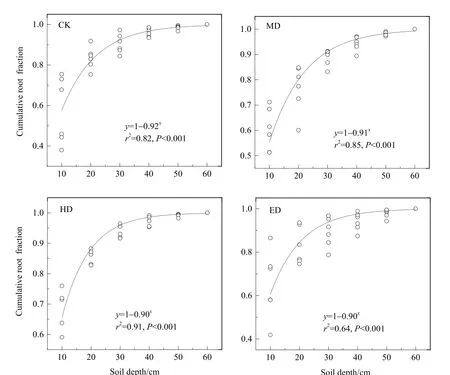
图5 不同退化状态下金露梅灌丛草甸地下根系生物量垂直分布特征Fig. 5 Vertical distribution characteristic of root biomass under different degradation states of Potentilla fruticosa shrub meadow

图6 不同退化状态下金露梅灌丛草甸物种丰富度演变特征Fig. 6 Change characteristics of species richness under different degradation states of Potentilla fruticosa shrub meadow

图7 不同退化状态下金露梅灌丛草甸物种丰富度与地上生物量关系Fig. 7 Relationship between species richness and aboveground biomass under different degradation states of Potentilla fruticosa shrub meadow
草地作为牲畜的主要食物来源,近年来,随着畜牧业的快速发展,过度放牧导致草地地表覆被、物种组成、群落结构和草地生产能力发生改变(张堰青,1990)。以往研究认为,在一般放牧强度下,草地植被只出现矮化、盖度下降现象,不会出现群落的分化,但随着放牧强度的进一步加大(即过度放牧),植被群落发生群落分化,群落生活型发生改变,致使金露梅灌丛退化为杂类草草地甚至黑土滩-次生裸地(盛海彦等,2009)。本研究表明,随着放牧强度的增加,植被群落形成了由原生金露梅灌丛向杂类草草地和黑土滩-次生裸地(即重度退化和极度退化样地)的分化。同时,随着放牧强度加剧,地上生物量呈逐渐下降趋势,且群落层次结构发生改变,逐渐由双层结构向单层结构演变。本研究中,金露梅灌丛草甸可分为两个垂直结构,上层以金露梅灌丛为优势种群,下层为草本植物,在原生金露梅灌丛草甸,金露梅盖度达90%以上。因此,牲畜主要取食上层结构,随着放牧强度的逐渐增大,上层金露梅灌丛盖度逐渐减小,从而为下层禾本科植物的生长提供良好的光照条件,致使禾本科地上生物量在中度退化样地快速提升,形成优势种群,而莎草科和杂类草在禾本科植物的遮蔽下,获得的光照较少,致使莎草科和杂类草地上生物量逐渐下降。随着金露梅灌丛盖度的快速下降,牲畜开始啃食下层草本植物,而禾本科和莎草科植物作为高寒草甸优良牧草,适口性好,且禾本科植物垂直高度高于莎草科植物,故牲畜优先啃食上层禾本科植物,而莎草科植物地上生物量无显著下降趋势。然而,随着放牧强度进一步增大(即中度退化向极度退化演替),莎草科和禾本科植物地上生物量均呈逐渐下降趋势,而杂类草植物适口性差,致使杂类草地上生物量逐渐增加,从而提高了杂类草在群落中的地位,这与林丽等(2016)研究一致,即随着放牧强度的增加,植被群落结构发生改变,优良牧草逐渐减少,毒杂草逐渐增加。同时,本研究还发现,随着退化程度的逐渐加剧,地下生物量现存量亦呈逐渐减小趋势,且原生灌丛样地和中度退化样地地下生物量现存量显著高于重度退化和极度退化样地(P<0.05),这主要是由于随着放牧的加剧,地表覆被逐渐稀少,为鼠类活动提供了良好的条件,致使大量根系被啃食,植被根系生物量快速下降,最终导致植物群落逐渐向黑土滩-次生裸地发展。
总体而言,高寒生态系统受气候和人为双重因素影响,尽管气候变化对生态系统的稳定性和物种组成具有一定影响(马丽等,2017;孟凡栋等,2017;戴黎聪等,2019),但相比于气候因素,人类活动对其影响更大,过度放牧不仅导致草地生产力、物种多样性下降,而且导致生态系统发生不可逆群落分化,致使生物多样性丧失,生态系统“崩溃”。因此,未来可以通过调节放牧强度和放牧时间来实现放牧生态系统的稳定,对于重度退化草地和极度退化草地应考虑采取人工恢复措施。
4.2 不同退化状态下根系生物量垂直分布特征
放牧不仅改变了地上/地下生物量,同时还改变了根系生物量的垂直分布,地下生物量约占草地总生物量的 80%以上,是高寒生态系统重要的碳库(戴黎聪等,2019)。因此,研究不同演替状态下根系生物量垂直分布特征对于未来碳评估具有重要意义。本研究发现,随着退化程度的加剧(即放牧强度的增加),根系生物量趋于浅层化,且主要集中在0-10 cm土层,约占总地下生物量的57%-68%,并随着土层深度的增加,根系生物量呈逐渐减小趋势,这与过去高寒草甸研究结果一致(周华坤等,2005)。高寒生态系统根系这种独特分布格局可能与土壤养分和群落物种组成有关(白永飞等,1994;Schenk et al.,2002)。由于牲畜的啃食,地上部分不能充分积累光合产物,进而影响光合产物向地下部分输送,致使植物地下部分生长受阻,加之牲畜的践踏,植被群落生活型发生改变,灌木群落逐渐向草本群落演替,致使根系随着放牧强度的增加逐渐趋于浅层化分布。另外一方面,还可能与牲畜在土壤表面留下的营养物质(如牛粪和尿液)有关,由于高寒生态系统长期处于低温,土壤有机质矿化缓慢,土壤养分匮乏,致使其对外界养分添加较为敏感,随着放牧强度的增加,牛粪和尿液也随着增加,根系生物量为了获取更多的营养物质,便将根系生物量向表层土壤集中分布(Stumpp et al.,2005),这在本研究中也得到证实,即在中度退化和极度退化样地中的0-10 cm土壤有机质和全碳及全氮显著高于原生金露梅灌丛样地和中度退化样地。因此,可进一步得出,养分垂直分布和物种组成的改变是植物根系趋于浅层化的重要因素。当然,植物根系垂直分布还受土壤含水量和孔隙度影响,未来将结合土壤理化性质进一步明晰在牧压驱动下植物根系趋于浅层化的机理。
4.3 群落物种丰富度及其与地上生物量关系
物种丰富度与生产力关系作为生态学研究的一个热点,以往研究者已进行了大量研究,但所结论存在一定的差异,有正相关(Tilman et al.,2001;Hooper et al.,2005)、负相关(Thompson et al.,2005),单峰曲线(Rapson et al.,1997)和无相关关系(Grace et al.,2007)。本研究表明,金露梅灌丛草甸地上生物量与物种丰富度表现为显著正相关关系,这与其他高寒草甸和温带草原研究结果一致(Wright,2006;Symstad et al.,2003),但与荒漠生态系统不一致(Wang et al.,1999),这主要归咎于样地丰富度、环境异质性和尺度不同。根据取样效应(Sampling effect)和生态位互补(Niche complementarity)效应,与简单系统相比,物种丰富度越高的生态系统包含高产物种的可能性越大,且这些高产物种往往是生态系统生产力的主要贡献者,如固氮的豆科植物,不仅自身能够获取额外的氮素,提高其生产力,同时还能为其他物种提高氮素,从而提高群落生产力(Facelli,2010),与荒漠生态系统相比,本研究生态系统物种丰富度较高,因此其包含高产物种的可能性越大。其次,在物种丰富度越高的生态系统中,生态位互补(Niche complementarity)效应能够通过生态位分离,从而减小种间竞争,为群落获取更多资源,致使生态系统功能优化(Hooper et al.,2005),生产力增加。此外,在物种丰富度较高的生态系统能够通过影响土壤微生物活性,从而提高生态系统氮循环和氮元素利用效率(Zak et al.,2003),尤其对于高寒生态系统这样一个氮限制的生态系统,提高氮元素的利用效率能够显著提高群落生产力。另一方面,空间尺度的不同也是本研究结果与过去研究结果不一致的重要因素之一,由于物种丰富度与生产力关系还依赖于空间尺度,不同尺度范围内同一现象其表现模式可能不同,当尺度较小时,物种丰富度与生产力关系多表现为单峰模式,随着尺度的增加,逐渐表现为正线性关系(Chase et al.,2002)。未来将进一步通过不同尺度范围进一步明晰尺度对物种丰富度与生产力的关系。
5 结论
随着金露梅灌丛草甸退化程度的加剧,其地上生物量、地下生物量现存量和物种丰富度均呈逐渐下降趋势,且原生灌丛和中度退化样地地上生物量、地下生物量现存量和物种丰富度显著高于重度退化和极度退化样地。另外,随着退化程度的加剧,地下根系生物量趋于向表层土壤集聚,从而获取更大的养分。同时,随着退化程度的加剧,植物群落结构发生改变,禾本科和莎草科地上生物量逐渐下降,而杂类草生物量逐渐上升。本研究表明,过度放牧不仅改变了物种丰富度、群落结构、草地生产能力和根系垂直分布特征,而且还引起植被群落发生不可逆分化,即由原生灌丛逐渐退化为杂类草草地甚至黑土滩-次生裸地。因此,确定合适的放牧强度对于维持草地生产力和物种多样性具有重要意义。
