喀斯特石漠化区植被恢复不同阶段土壤真菌群落组成分析
2019-05-31刘雯雯喻理飞严令斌刘娜赵庆
刘雯雯,喻理飞, ,严令斌,刘娜,赵庆
1. 贵州大学生命科学学院/农业生物工程研究院,贵州 贵阳 550025;2. 山地植物资源保护与种质创新教育部重点实验室/山地生态与农业生物工程协同创新中心,贵州 贵阳 550025
以贵州为中心的西南地区是喀斯特连续分布最典型的区域(盛茂银等,2013),具有高度异质性和脆弱性,易发生石漠化。植被退化是石漠化发展的重要原因和标志,退化喀斯特植被自然恢复一般有六个恢复阶段,即草本群落阶段、灌草过渡阶段、灌木灌丛阶段、灌乔过渡阶段、乔林阶段和顶极群落阶段(喻理飞等,2002),不同植被下小生境土壤分布及其理化性质、土壤微生物存在差异(廖洪凯等,2013;廖洪凯等,2012;刘方等,2008),且与植被特征相关(Sayer et al.,2017)。
高通量测序是研究微生物群落组成的一种可靠且有效的方法(Bengtsson-Palme et al.,2013)。内转录间隔区(Internal transcribed spacer,ITS)扩增子测序是研究环境微生物多样性及群落组成差异的重要技术手段之一,已被广泛应用于真菌分类鉴定中(Bachy et al.,2013;Magoč et al.,2011)。喀斯特区不同退化阶段土壤微生物类群数量、微生物群落功能多样性(胡芳等,2018;梁月明等,2010;宋敏等,2013;谭秋锦等,2014)等已有报道。真菌群落被正式描述的群落不到10%,未确定的分类信息高。本研究采用高通量测序、ITS扩增子测序技术对喀斯特区植被恢复不同阶段小生境土壤真菌进行种类鉴定与分析,阐明退化喀斯特植被恢复过程土壤真菌群落组成及优势关键类群,对深入认识喀斯特石漠化区植被恢复过程中土壤微生物作用具有重要意义。
1 材料与方法
1.1 研究区域概况
贵州省安顺市镇宁布依族苗族自治县大山镇位于贵州省西南部珠江水系与长江水系分水岭之间(东经 105°35′-106°1′,北纬 25°25′-26°11′)。海拔356-1678 m,岩溶地貌分布广,占全县面积60%以上;属北亚热带季风湿润气候,全年气候温和,雨量充沛;年平均气温 16.2 ℃,年平均日照时数为1142 h,年平均降水量1277 mm。研究区森林于 1958-1960年被采伐后,植被逐渐恢复,因存在不同干扰,研究区内出现草本群落阶段、灌草过渡阶段、灌木林阶段和乔林阶段群落,植被下发育有典型的石面、石沟、石缝等小生境。乔林阶段以化香(Platycarya strobilacea)、黄连木(Pistacia chinensis)、海金子(Pittosporum illicioides)、朴树(Celtis sinensis)为优势种,灌木林主要有化香(Platycarya strobilacea)、针齿铁仔(Myrsine semiserrata),灌草过渡阶段主要有化香(Platycarya strobilacea)、异叶鼠李(Rhamnus heterophylla)、安顺润楠(Machilus cavaleriei),草本群落阶段主要有白茅(Imperata cylindrica)、地果(Ficus tikoua)、沿阶草(Ophiopogon bodinieri)、荩草(Arthraxon hispidus)。区域内岩石裸露率为10%-60%,成土母岩为石灰岩,土壤为石灰土,土壤pH介于6.9-7.9之间。
1.2 方法
1.2.1 样品采集
在典型的乔林阶段(F)、灌木林阶段(S)、灌草过渡阶段(B)、草本群落阶段(G)4个不同恢复阶段分别设置样地,在乔林阶段设置20 m×20 m样地,灌木林阶段样地、灌草过渡阶段设置 4 m×10 m样地,草本群落阶段样地为2 m×5 m,每个阶段设置3个样地,共12个。每个样地内分别在石面(U)、石沟(D)、石缝(C)3种小生境内采集0-10 cm表层土壤样品,共36个。每个土样除去石块和动植物残体,混合均匀后,装于密封袋中并编号,立刻放入液氮罐中速冻,带回实验室放入-70 ℃冰箱中保存,用于DNA提取。样品保存在干冰中送上海美吉生物医药科技有限公司进行高通量测序。
1.2.2 DNA抽提和PCR扩增
根据土壤DNA提取试剂盒(Omega Bio-tek,Norcross,GA,U.S.)说明书进行总 DNA 抽提,DNA浓度和纯度利用NanoDrop 2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;选用引物 ITS1F:CTTGGTCATTTAGAGGAAGTAA;ITS2R:GCTGCGTTCTTCATCGATGC进行 PCR扩增。使用ABI GeneAmp® 9700型的PCR仪,扩增体系为 20 μL,2 μL 10×FastPfu 缓冲液,2 μL 2.5 mmol·L-1dNTPs,0.8 μL 引物(5 μM),0.2 μL rTaq聚合酶;10 ng DNA模板。扩增程序为:95 ℃预变性3 min,35个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。PCR产物利用IlluminaMiseq PE 300平台进行测序。
1.2.3 OTU聚类和注释
根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样品数据,截去Barcode和引物序列后使用FLASH(Su et al.,2012)对每个样品的Reads进行拼接,得到原始Tags数据;参照QIIME的Tags质量控制流程,经过Tags截取、过滤及嵌合体去除等处理后得到高质量的有效Tags数据。利用UPARSE软件,按照97%的相似度将序列聚类为OTU(sOperational Taxonomic Units),使用UCHIME软件剔除嵌合体。利用RDP classifier对每条序列进行物种分类注释。
1.2.4 统计分析
利用R语言vegan包根据丰度排名前50的类群绘制热图,从物种和样品两个层面进行聚类,分析各植被恢复阶段的优势真菌类群。通过 LEfSe(LDA Effect Size)系统分析植被不同恢复阶段具有显著差异的物种。
2 结果与分析
2.1 测序结果
样本的物种多样性随测序量的变化情况可由Shanon-Winner指数曲线反映,如图 1所示,曲线趋向平坦且文库覆盖率高于0.99,说明测序数据量足够大,足以全面反映样本中的微生物信息。
图1 Shanon-Winner指数曲线Fig. 1 Shannon-Winner index curves
36个土壤样品通过高通量测序及分析共获得2437541条有效序列(表1),每个样品获得35911条有效序列,OTU数目为5437,分属于6个门、31个纲、106个目、244个科及626个属。

表1 测序结果Table 1 Statistics of sequencing data
2.2 土壤真菌群落组成
2.2.1 门分类水平上组成
喀斯特植被下土壤真菌群落在门分类水平上主要由 4类真菌组成,分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)和未分类真菌(Others/Unclassified fungi),占比分别为53.39%、25.08%、6.91%、14.20%,其中子囊菌门高于30%,为优势菌群,担子菌门与接合菌门占比不高但在所有样品中均有出现,为常见菌群。
植被恢复不同阶段土壤真菌群落门水平的组成也相同,均由子囊菌门、担子菌门、接合菌门、未分类真菌组成,乔林阶段分别占44.18%、30.66%、8.16%、16.29%,灌木林阶段为49.06%、27.72%、6.36%、16.52%,灌草过渡阶段为51.88%、31.89%、6.70%、8.96%,草本群落阶段为68.43%、10.06%、6.40%、15.00%,可见恢复早期阶段优势菌群子囊菌门比例高,随植被恢复逐渐下降。
2.2.2 属分类水平上组成
在属分类水平上,植被恢复不同阶段土壤真菌群落组成属及相对丰度(>1%)如表2所示,其中,相对丰度>5%的属在乔林阶段和灌木林阶段相似,青霉属Penicillium仅在灌木阶段丰度稍高。
以样品为单元,将各样品中丰度排名前 50的属利用R语言绘制热图,得36个不同生境下土壤真菌属水平物种丰度聚类热图(图2)。图2表明:36个样品中除草地石面样品(GU3)、灌草过渡阶段的石缝样品(BC2)和草本群落阶段石沟样品GD1差异较大外,其余样品可归为3个土壤真菌组成类型,即类型1,由SD1/SD2/FC1/SD2/FD2/SD3/FD1/FU2/SU3/SC3/FC2/SU1/FC3/SU2/BU3/FD3组成,均为乔林阶段与灌木林阶段样品,类型 2由BU1/BC1/FU3/BC3/BD1/BD3组成,绝大部分为灌草过渡阶段样品,类型 3由 GC2/GD2/GU1/BU2GU2/GC1/GD3/GC3/GD2组成,绝大部分为草本群落阶段样品。以样品为单元的分类结果与植被恢复阶段属水平的土壤真菌群落组成一致,反映出在同一恢复阶段小生境引起的土壤真菌群落组成变化小于植被恢复阶段的影响。
植被各恢复阶段土壤真菌群落相对丰度>5%的物种属组成(表2)如下:(1)乔林和灌木林阶段有未分类真菌(11.90%-16.53%)、Geminibasidium(7.71%-11.90%)、被孢霉属Mortierella(6.35%-8.13%)、蜡壳耳属Sebacina(7.60%-9.73%)、青霉属Penicillium(4.37%-6.78%)等;(2)灌草过渡阶段有蜡壳耳属Sebacina(22.96%)、子囊菌门 Ascomycota(11.26%),Geminibasidium(7.14%)、被孢霉属 Mortierella(6.69%)、镰刀菌属Fusarium(5.29%);(3)草本群落阶段有未分类真菌(15.00%)、镰刀菌属Fusarium(12.88%)、子囊菌门 Ascomycota(13.40%)、被孢霉属Mortierella(6.17%)、Archaeorhizomyces(5.85%)。

表2 植被不同恢复阶段土壤真菌群落组成及相对丰度Table 2 Composition and relative abundance of soil fungi in different vegetation restoration stages
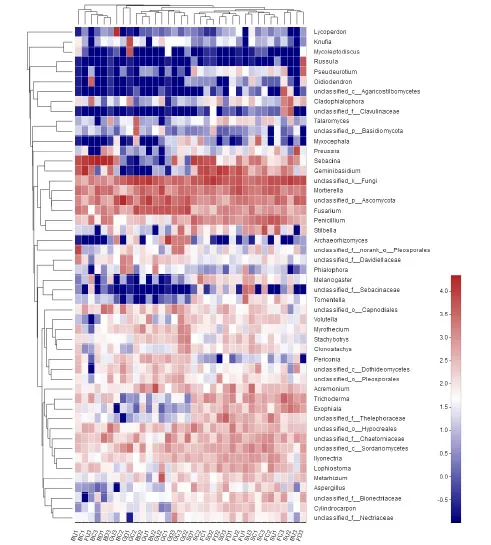
图2 植被不同恢复阶段土壤真菌的属水平物种丰度聚类热图Fig. 2 Heat map of genus level abundance of soil fungi in different vegetation restoration stages
2.3 关键真菌类群分析
LEfSe分析可用于分析组间菌群差异,找出各组间差异的微生物种类。对上述3种土壤真菌群落组成类型进行LEfSe分析(LDA值默认为4),图3表明:导致乔林、灌木林阶段土壤真菌群落组成(类型1)具显著差异并起关键作用的优势关键物种属是木霉属 Trichoderma(LDA=4.11)、青霉属Penicillium(LDA=4.35)、小蔓毛壳科Herpotrichiellaceae(LDA=4.00)、革菌科Thelephoraceae(LDA=4.10)和未分类真菌(LDA=4.86),灌草过渡阶段(类型 2)是煤炱目Capnodiales(LDA=4.15)、格孢菌目 Pleosporales(LDA=4.28)、蜡壳耳属Sebacina(LDA=5.30)、Geminibasidium(LDA=4.77),草本群落阶段(类型3)是镰刀菌属Fusarium(LDA=4.78)、肉座菌科Hypocreales(LDA=4.54)、子囊菌门(LDA=4.63)、Archeaorhizomyces属(LDA=4.48),支顶孢属Acremonium(LDA=4.22)。

图3 植被不同恢复阶段土壤真菌物种LDA值分布柱状图Fig. 3 LDA score distrubution histogram of LEfSe analysis in different vegetation restoration stages
3 讨论
3.1 喀斯特植被恢复不同阶段真菌群落组成分析
利用高通量测序技术分析了喀斯特区植被恢复过程中4个阶段土壤真菌群落组成结构,物种门组成结构分析结果表明,优势真菌主要为子囊菌门、担子菌门、接合菌门和未分类真菌;其中木霉属 Trichoderma、青霉属 Penicillium、小蔓毛壳科Herpotrichiellaceae、革菌科Thelephoraceae、蜡壳耳属Sebacina、Geminibasidium、镰刀菌属Fusarium、Archeaorhizomyces、煤炱目Capnodiales、格孢菌目Pleosporales、子囊菌门 Ascomycota未定属等为该地区的优势关键属。这与曾庆飞等(2015)认为贵州高原不同石漠化程度土壤真菌优势菌群为球囊菌门,其优势属为曲霉属 Aspergillus、镰刀菌属、被孢霉属、球囊霉属 Glomus等的研究结果不同。对黄土高原土壤(白丽等,2018)、纳帕海高原湿地(陈伟等,2018)、宁夏沙漠土壤(郭成瑾等,2017)的研究发现其优势真菌主要为子囊菌门、担子菌门和接合菌门,另外还有其他丰度较低和目前数据库无法鉴定的真菌门,其优势属为赤霉菌属Gibberella、青霉属、曲霉属、镰刀菌属等,可见其在门水平上与喀斯特区植被恢复过程中土壤真菌群落组成相似,但优势关键属存在差异。
3.2 未鉴定真菌是未来深入研究的关键
无论是喀斯特地区,还是黄土高原、纳帕海高原,土壤真菌群落组成中都存在丰度较低和目前数据库无法鉴定的真菌门,黄土高原该类真菌占比约6.15%,纳帕海高原该占比为 60%以上,本研究各植被恢复阶段中门水平上的比例达 6.36%-16.52%,属水平上的比例达8.96%-16.53%,因此,对喀斯特区土壤真菌类群库的完善是土壤真菌鉴定及多样性研究深入的关键。
3.3 喀斯特土壤真菌对参与养分循环吸收的影响
丰度占优势的类群中蜡壳耳属 Sebacina、革菌属 Tomentella、外瓶霉属 Exophiala、支顶孢属Acremonium、黑团孢属Periconia等属于菌根真菌,菌根真菌的生物量与其分泌的代谢物是重要的碳汇且在土壤复杂的有机质降解过程中有重大贡献,同时菌根真菌可利用土壤中的无机氨态氮、硝态氮、有机氮等有效提高对氮源的吸收利用(郭良栋等,2013)。木霉属 Trichoderma、镰刀菌属 Fusarium不仅分泌纤维素酶对碳的分解起作用,其与青霉属Penicillium、裸节菌属Talaromyces都参与了土壤难溶性磷的溶解,有效提高植物对磷的获取,是溶磷微生物的重要类群(杨顺等,2018)。本研究中,乔林、灌木林两阶段中菌根真菌、溶磷真菌等种类丰度高,菌根的形成促进植物对土壤磷、氮的摄取吸收,参与养分分解矿化、硝化作用等过程(韦莉莉等,2016),参与有机质降解、氮循环、磷循环等养分循环,贡献程度大;菌根真菌在灌草过渡阶段丰度高;溶磷真菌在草本群落阶段中丰度高,在活化土壤磷方面贡献较大,增加土壤磷的供应,促进植物吸收利用(沈仁芳等,2015)。因此,深入研究喀斯特植被恢复过程中功能微生物的作用是重要的研究方向。
4 结论
喀斯特植被恢复过程中不同阶段下土壤真菌群落组成分为3种类型:
类型1为乔林和灌木林阶段,由未分类真菌、Geminibasidium、被孢霉属 Mortierella、蜡壳耳属Sebacina、青霉属Penicillium、子囊菌门Ascomycota等组成,其中木霉属 Trichoderma、青霉属Penicillium、小蔓毛壳科 Herpotrichiellaceae、革菌科 Thelephoraceae、未分类真菌为该类型的关键优势真菌类群。
类型2为灌草过渡阶段,由蜡壳耳属Sebacina、Geminibasidium、被孢霉属 Mortierella等构成,其中,蜡壳耳属 Sebacina、Geminibasidium、煤炱目Capnodiales、格孢菌目 Pleosporales未定属为该类型的关键优势真菌类群。
类型3为草本群落阶段,由未分类真菌、镰刀菌属 Fusarium、子囊菌门 Ascomycota、被孢霉属Mortierella、Archaeorhizomyces等构成,镰刀菌属Fusarium、Archeaorhizomyces、支顶孢属Acremonium、肉座菌科 Hypocreales、子囊菌门Ascomycota未定属为该类型的关键优势真菌类群。
