鸡骨草叶中N-反式对香豆酰酪氨酸的纯化工艺优化Δ
2019-05-31门丽娇刘亚迪邱雨袁旭江
门丽娇,刘亚迪,邱雨,袁旭江
(广东药科大学新药研发中心,广州510006)
N-反式对香豆酰酪氨酸[N-(E)-p-coumaroyltyrosine]为酚类氨基酸衍生物,最早被发现于非洲黑木树皮中[1]。随着研究的不断深入,至今发现含有该成分的植物还有可可[2]、山茱萸根[3]、阔叶野韭菜花和茎[4]、常春藤新鲜叶子[5]等。在生物活性方面,Osakabe N[6]通过实验动物模型研究了含有N-反式对香豆酰酪氨酸的可可提取液中粗多酚的生物活性,结果表明其对乙醇诱导的胃溃疡具有一定的保护作用,可抑制维生素E缺乏大鼠的氧化应激,降低高胆固醇血症模型兔的氧化敏感性,抑制小鼠皮肤的癌变,同时还可抑制杂环胺的致突变作用。Mokhtar M等[7]研究发现,辣椒多酚提取物具有抗菌和抗氧化活性,可降低癌细胞的活力,而N-反式对香豆酰酪氨酸是该提取物可能发挥生物活性的成分之一。抑制一氧化氮(NO)合酶介导的NO过表达可能是治疗包括神经炎性疾病在内的炎症性疾病的药物靶点。Hu XL等[8]利用酶活性和对接试验显示,N-反式对香豆酰酪氨酸对诱导型靶标产生的NO合酶有抑制作用。由此可见,N-反式对香豆酰酪氨酸具有多种生物活性,但其在植物纯化富集和分析方面的研究较少。笔者在前期研究中发现,鸡骨草叶中含有N-反式对香豆酰酪氨酸,且含量较高[9-10]。为此,本研究在建立测定鸡骨草叶中N-反式对香豆酰酪氨酸含量高效液相色谱法(HPLC)的基础上,采用单因素试验优化N-反式对香豆酰酪氨酸的纯化工艺,旨在为其开发利用和质量评价提供参考。
1 材料
1.1 仪器
1100型HPLC仪,包括二极管阵列检测器、真空脱气机、四元泵、自动进样器和柱温箱(美国Agilent公司);BP211D型十万分之一电子天平(德国Sartorius公司);JJ1000型千分之一电子天平(常熟市双杰测试仪器厂);BHS-4型数显恒温水浴锅(江阴市保利科研器械有限公司);RE-52AA型旋转蒸发器(上海亚荣生化仪器厂)。
1.2 药品与试剂
N-反式对香豆酰酪氨酸对照品(广东药科大学新药研发中心自制,批号:20180601,纯度:>99%);聚酰胺树脂(100~200目,台州市路桥四甲生化塑料厂);甲醇为色谱纯,其他试剂均为分析纯,水为纯净水。
1.3 药材
24批鸡骨草叶药材(编号:S1~S24)经广东药科大学新药研发中心袁旭江副研究员鉴定分别为豆科(Leguminosae)植物相思子属(Abrus Adans.)的广州相思子(Abrus cantoniensisHance)或毛相思子(Abrus mollisHance)的干燥叶。药材样品来源见表1。
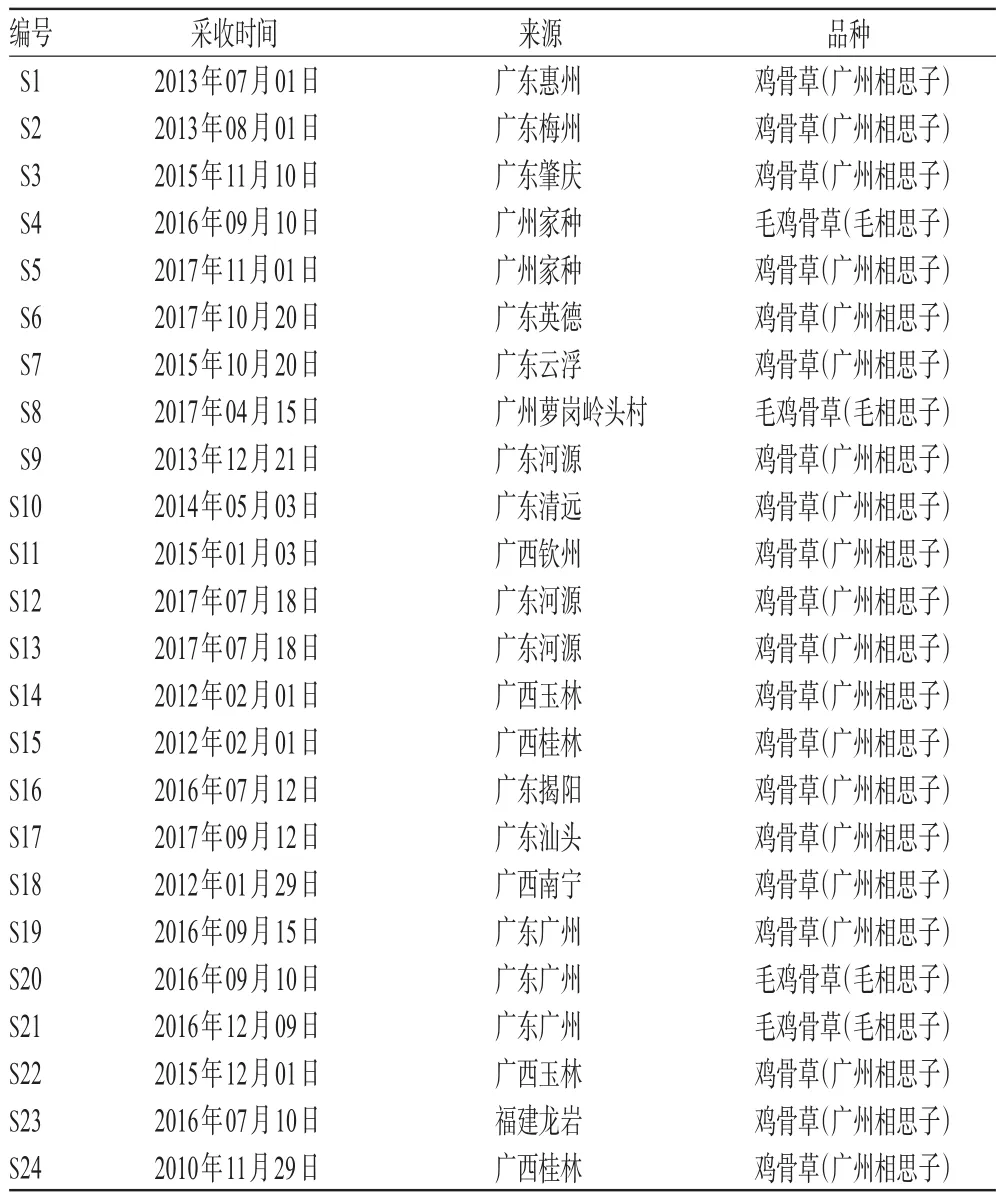
表1 药材样品来源Tab 1 Source of medicinal sample
2 方法与结果
2.1 N-反式对香豆酰酪氨酸的含量测定
2.1.1色谱条件色谱柱1:Hypersil BDS C18(150 mm×4.6 mm,5 μm);流动相:0.1%甲酸水溶液(A)-甲醇(B),梯度洗脱(0~20 min,33%B→51%B);流速:1.0 mL/min;柱温:25℃;检测波长:300 nm;进样量:10 μL。在该色谱条件下,N-反式对香豆酰酪氨酸色谱峰与相邻色谱峰的分离度均大于1.5,理论板数大于5 000,阴性对照对测定无干扰,详见图1。
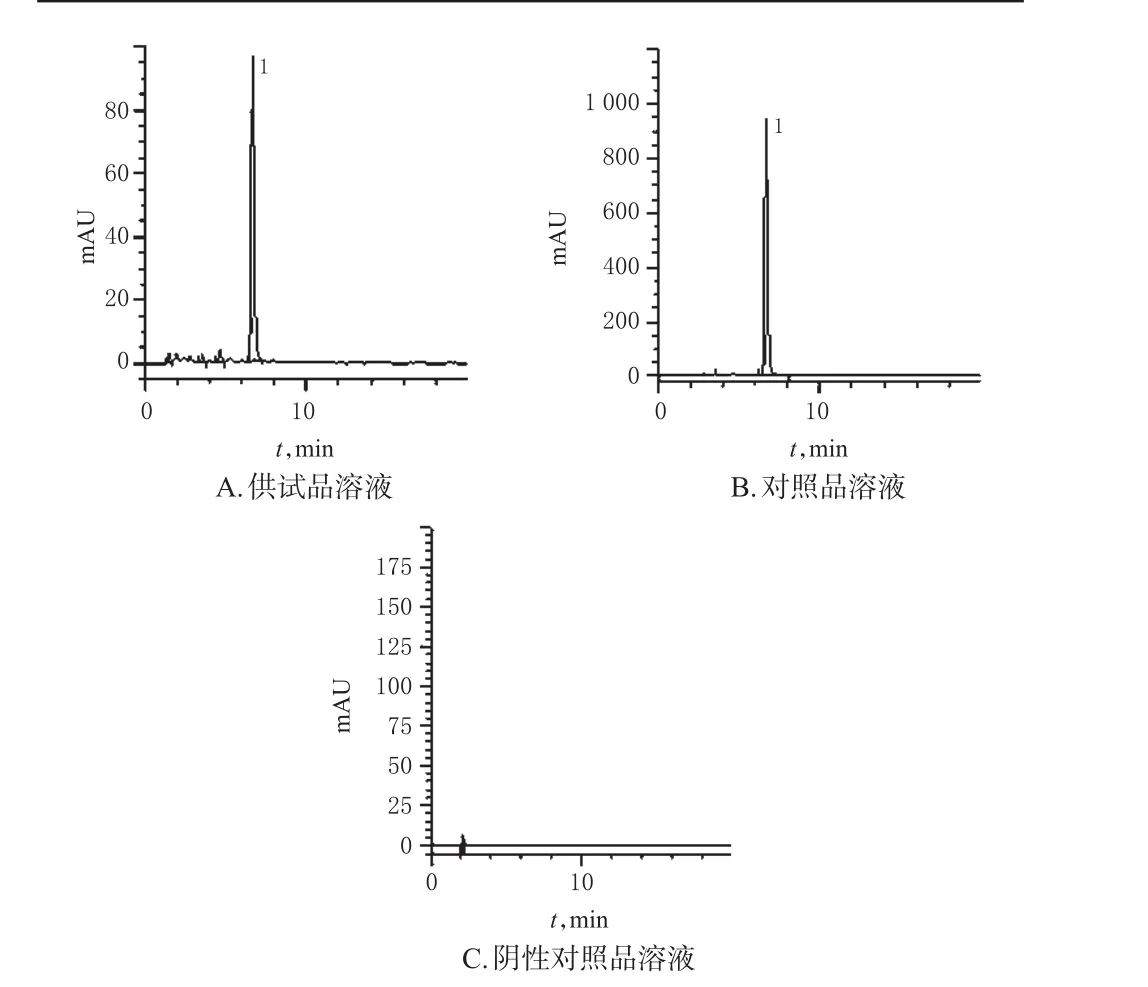
图1 高效液相色谱图Fig 1 HPLC chromatograms
2.1.2 对照品溶液的制备 取N-反式对香豆酰酪氨酸对照品适量,精密称定,置于50 mL量瓶中,加50%乙醇溶解并定容,摇匀,制成质量浓度为5.15 mg/mL的对照品溶液。
2.1.3 供试品溶液的制备 取药材样品2.0 g,精密称定,置于锥形瓶中,按照1∶30的比例(g/mL)加入20%乙醇,于95℃加热回流3次,每次1 h,滤过,合并3次滤液,减压回收至无醇味,浓缩液加水定容至50 mL。取全部样品上聚酰胺柱(100~200目,5.0 g,湿法上柱,直径2.5 cm,长40 cm),上样流速1.0 mL/min,依次用水(含0.1%乙酸)、20%乙醇(含0.1%乙酸)洗脱至流出液无色后,再用氨水(pH 10)洗脱至无色,收集氨水洗脱液,减压浓缩至干,残渣置于50 mL量瓶中,加50%乙醇溶解并定容。取适量经0.45 μm微孔滤膜滤过,取续滤液,即得供试品溶液。
2.1.4 阴性对照溶液的制备 取50%乙醇适量,经0.45 μm微孔滤膜滤过,取续滤液,即得阴性对照溶液。
2.1.5 线性关系及不同色谱柱适用性考察 取“2.1.2”项下对照品溶液0.5、1、2、5、8、10 mL,分别置于10 mL量瓶中,加50%乙醇定容,按“2.1.1”项下色谱条件进样测定,以进样量(x,μg)为横坐标、峰面积(y)为纵坐标进行线性回归,得N-反式对香豆酰酪氨酸回归方程为y=441.34x-8.259 4(r=0.999 9)(色谱柱1);y=447.20x-64.309 0(r=0.999 9)[色谱柱 2:Hypersil BDS C18(250 mm×4.6 mm,5 μm)],表明N-反式对香豆酰酪氨酸检测进样量的线性范围为2.575~51.50 μg,详见表2。
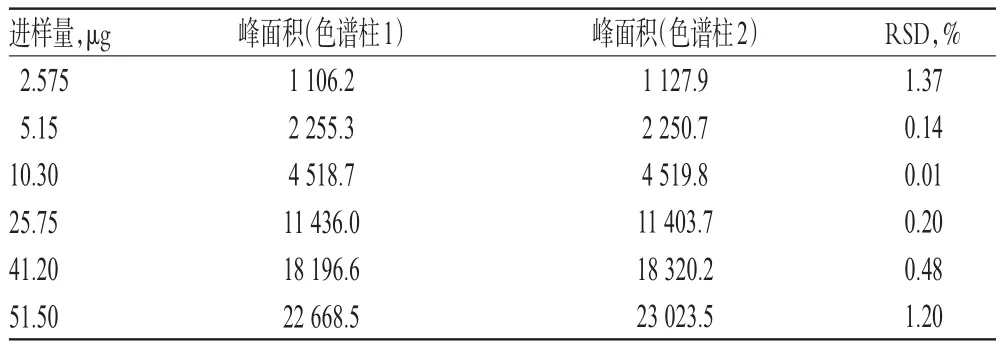
表2 不同色谱柱的线性关系及适用性考察结果Tab 2 Linear range of different chromatogram column and suitability
2.1.6 定量限与检测限考察 取“2.1.2”项下对照品溶液适量,倍比稀释,按“2.1.1”项下色谱条件进样测定,以信噪比10∶1、3∶1分别计算定量限、检测限。结果,N-反式对香豆酰酪氨酸的定量限为0.000 618 μg、检测限为0.000 129 μg。
2.1.7 精密度试验 取“2.1.3”项下供试品溶液(编号:S15)10 μL,按“2.1.1”项下色谱条件于同日内连续进样测定6次,记录峰面积。结果,N-反式对香豆酰酪氨酸峰面积的RSD为1.15%(n=6),表明本方法日内精密度良好。精密量取“2.1.3”项下供试品溶液(编号:S15)10 μL,按“2.1.1”项下色谱条件连续进样测定3 d,记录峰面积。结果,N-反式对香豆酰酪氨酸峰面积的RSD为1.14%(n=3),表明本方法日间精密度良好。
2.1.8 稳定性试验 取“2.1.3”项下供试品溶液(编号:S15)适量,分别于室温放置0、2、4、6、8、12、24 h时按“2.1.1”项下色谱条件进样测定,记录峰面积。结果,N-反式对香豆酰酪氨酸峰面积的RSD为0.30%(n=7),表明供试品溶液于室温下放置24 h内基本稳定。
2.1.9 重复性试验 取药材样品(编号:S15)适量,共6份,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,记录峰面积并按回归方程计算样品含量。结果,N-反式对香豆酰酪氨酸的平均含量为11.81 mg/g,RSD为2.43%(n=6),表明本方法重复性良好。
2.1.10 加样回收率试验 取已知含量的药材样品(编号:S15)1.0 g,精密称定,共6份,分别加入一定量的N-反式对香豆酰酪氨酸对照品,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表3。
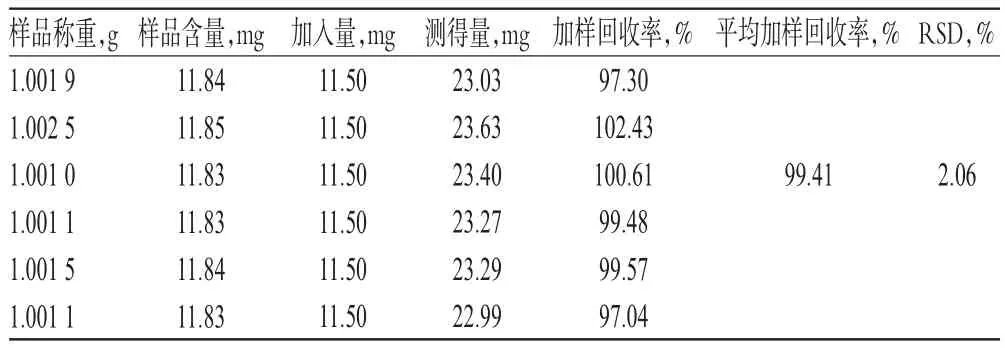
表3 加样回收率试验结果(n=6)Tab 3 Results of recovery tests(n=6)
2.1.11 样品含量测定 取24批样品,每批2.0 g,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,平行操作3次,记录峰面积并按回归方程计算样品含量,结果见表4。
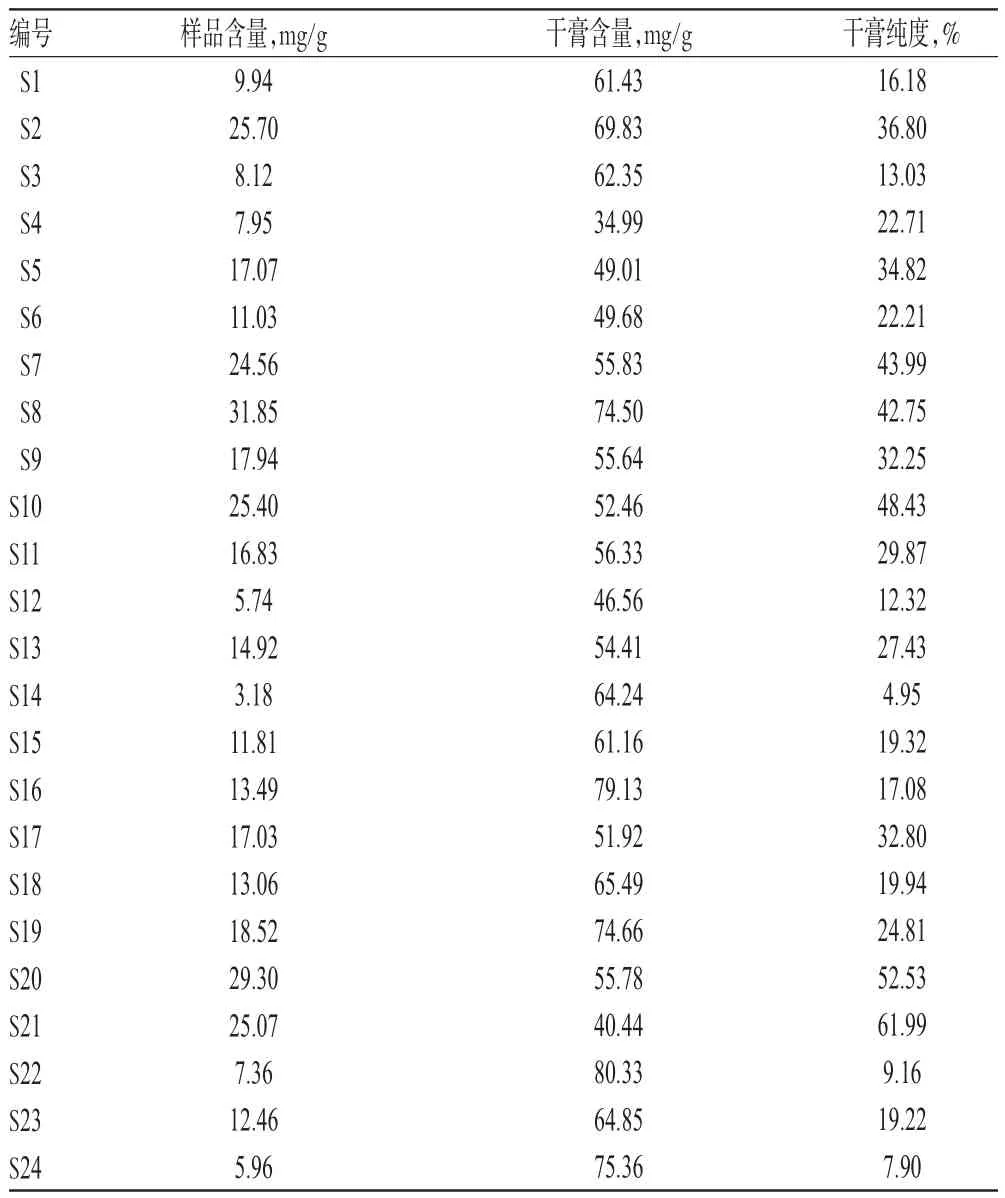
表4 样品含量测定结果(n=3)Tab 4 Results of content determination of samples(n=3)
2.1.12 干膏含量及干膏纯度测定 供试品溶液用氨水洗脱后,定容至50 mL,取40 mL,按2015年版《中国药典》(三部)通则干燥失重法干燥后得样品干膏[11],并计算干膏含量及干膏纯度。干膏含量(mg/g)=(减失的质量×5/4)/样品质量;干膏纯度(%)=N-反式对香豆酰酪氨酸在样品中的含量/干膏含量×100%,结果见表4;干膏含量与干膏纯度的相关性散点图见图2。由图2可知,干膏含量与干膏纯度存在线性关系(R2=0.834 1)。
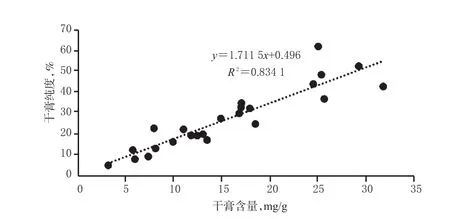
图2 相关性散点图Fig 2 Scattered plot of correlation
2.2 N-反式对香豆酰酪氨酸纯化工艺优化
2.2.1 纯化前样品溶液制备 取药材样品40.0 g,置于圆底烧瓶中,按照1∶30的比例(g/mL)加入20%乙醇,于95℃加热回流3次,每次1 h,滤过,合并3次滤液,减压回收至无醇味,浓缩液加水定容至1 000 mL,即得。
2.2.2 洗脱溶剂考察 称取聚酰胺树脂5.0 g,共2份,每份分为2柱,分别湿法上柱,取“2.2.1”项下样品溶液50 mL,上样流速1.0 mL/min,静置吸附时间20 min,样品溶液质量浓度0.04 g/mL(以鸡骨草叶药材计,下同),每柱依次用水(含0.1%乙酸)、20%乙醇(含0.1%乙酸)、氨水(pH 10)洗脱至流出液无色,分别收集水洗脱液、乙醇洗脱液和氨水洗脱液,减压浓缩至干,残渣加50%乙醇定容至25 mL,每个样品平行2份,取适量,经0.45 μm微孔滤膜滤过,取续滤液,按“2.1.1”项下色谱条件进样测定。结果,水洗脱液、乙醇洗脱液中N-反式对香豆酰酪氨酸得率均为0,但水溶性杂质和黄酮类成分被洗脱,氨水洗脱液中N-反式对香豆酰酪氨酸得率分别为96.27%、100.03%,提示N-反式对香豆酰酪氨酸被富集在氨水洗脱液中,故选择用水(含0.1%乙酸)、20%乙醇(含0.1%乙酸)、氨水(pH 10)为洗脱溶剂依次洗脱,并收集氨水洗脱液进行含量测定(氨水洗脱液中N-反式对香豆酰酪氨酸的质量/样品溶液中N-反式对香豆酰酪氨酸的质量×100%)。
2.2.3 静置吸附时间考察 称取聚酰胺树脂5.0 g,共6份,分为3组(每组2柱),分别湿法上柱,取“2.2.1”项下样品溶液50 mL,上样流速1.0 mL/min,样品溶液质量浓度0.04 g/mL,每组分别静置吸附5、10、20 min,每柱依次用水(含0.1%乙酸)、20%乙醇(含0.1%乙酸)、氨水(pH 10)洗脱至流出液无色,弃去水洗脱液、乙醇洗脱液,分别收集每柱的氨水洗脱液,减压浓缩至干,残渣加50%乙醇定容至25 mL,每个样品平行2份,取适量,经0.45 μm微孔滤膜滤过,取续滤液,按“2.1.1”项下色谱条件进样测定。结果,N-反式对香豆酰酪氨酸得率分别为94.34%、98.65%、99.65%。这提示静置吸附时间越长,N-反式对香豆酰酪氨酸吸附得越紧密,在前期经水、乙醇洗脱时越不易随杂质洗脱,综合考虑,最终选择静置吸附时间为20 min。
2.2.4 上样量考察 称取聚酰胺树脂5.0 g,共6份,分为3组(每组2柱),分别湿法上柱,取“2.2.1”项下样品溶液30、50、70 mL,上样流速1.0 mL/min,静置吸附时间20 min,样品溶液质量浓度0.04 g/mL,每柱依次用水(含0.1%乙酸)、20%乙醇(含0.1%乙酸)、氨水(pH 10)洗脱至流出液无色,弃去水洗脱液、乙醇洗脱液,分别收集每柱的氨水洗脱液,减压浓缩至干,残渣加50%乙醇定容至25 mL,每个样品平行2份,取适量,经0.45 μm微孔滤膜滤过,取续滤液,按“2.1.1”项下色谱条件进样测定。结果,N-反式对香豆酰酪氨酸得率分别为100.11%、100.02%、97.05%。这提示当上样量为70 mL时,N-反式对香豆酰酪氨酸不能被聚酰胺树脂完全吸附,综合考虑,最终选择上样量为50 mL。
2.2.5 样品溶液质量浓度考察 称取聚酰胺树脂5.0 g,共6份,分为3组(每组2柱),分别湿法上柱,取“2.2.1”项下样品溶液50 mL,分别制成质量浓度为0.02、0.04、0.06 g/mL的上样液,上样流速1.0 mL/min,静置吸附时间20 min,每柱依次用水(含0.1%乙酸)、20%乙醇(含0.1%乙酸)、氨水(pH 10)洗脱至流出液无色,弃去水洗脱液、乙醇洗脱液,分别收集每柱的氨水洗脱液,减压浓缩至干,残渣加50%乙醇定容至25 mL,每个样品平行2份,取适量,经0.45 μm微孔滤膜滤过,取续滤液,按“2.1.1”项下色谱条件进样测定。结果,N-反式对香豆酰酪氨酸得率分别为101.32%、100.22%、100.42%。这提示当样品溶液质量浓度为0.02~0.06 g/mL时,N-反式对香豆酰酪氨酸均可被全部洗脱下来,考虑到实际操作,最终选择样品溶液质量浓度为0.04 g/mL。
2.2.6 酸性洗脱溶剂含酸量考察 称取聚酰胺树脂5.0 g,共6份,分为3组(每组2柱),分别湿法上柱,取“2.2.1”项下样品溶液50 mL,上样流速1.0 mL/min,静置吸附时间20 min,样品溶液质量浓度0.04 g/mL,每柱依次用不含乙酸、含0.1%乙酸、含0.2%乙酸的水和不含乙酸、含0.1%乙酸、含0.2%乙酸的20%乙醇、氨水(pH 10)洗脱至流出液无色,弃去水洗脱液、乙醇洗脱液,分别收集每柱的氨水洗脱液,减压浓缩至干,残渣加50%乙醇定容至25 mL,每个样品平行2份,取适量,经0.45 μm微孔滤膜滤过,取续滤液,按“2.1.1”项下色谱条件进样测定。结果,N-反式对香豆酰酪氨酸得率分别为0、100.20%、101.12%。这提示在洗脱溶剂中增加适量的乙酸可使N-反式对香豆酰酪氨酸在聚酰胺树脂上的吸附力加大,提高得率,考虑到经济成本,最终选择酸性洗脱溶剂为水(含0.1%乙酸)。
2.2.7 验证试验 按上述考察结果得到最优纯化工艺为0.04 g/mL样品溶液50 mL、上样流速1.0 mL/min、静置吸附时间20 min,以水(含0.1%乙酸)、20%乙醇(含0.1%乙酸)、氨水(pH 10)为洗脱溶剂依次洗脱,在此纯化工艺条件下制备N-反式对香豆酰酪氨酸,按“2.1.1”项下色谱条件进样测定,平行操作3次,结果见表5。
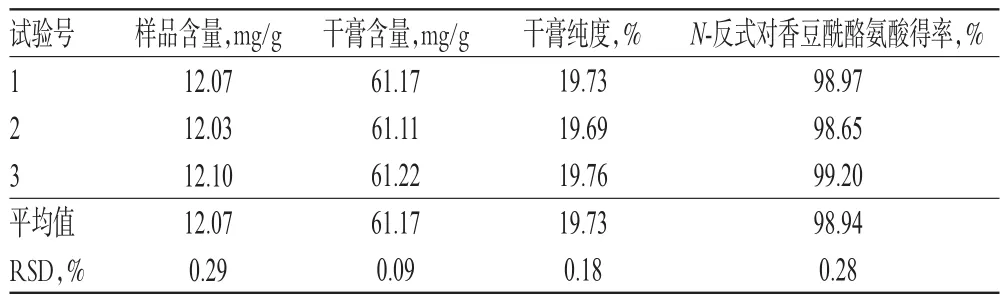
表5 验证试验结果(n=3)Tab 5 Results of verification test(n=3)
3 讨论
鸡骨草叶总提取液工艺可将N-反式对香豆酰酪氨酸完全提取。笔者在富集纯化时通过比较发现,使用聚酰胺树脂比硅胶、大孔树脂吸附效果更好,且提取液中加入少量乙酸可较好地促进目标成分的吸附,去除黄酮类等杂质。故选择洗脱溶剂、静置吸附时间、上样量、样品溶液质量浓度和酸性洗脱剂含酸量为考察因素,进一步探讨这些因素对N-反式对香豆酰酪氨酸纯化富集的影响,以筛选出最佳工艺参数,为后期高纯度单体制备提供依据。
本研究采用HPLC法进行含量测定时,得到了较为单一的N-反式对香豆酰酪氨酸峰,这为N-反式对香豆酰酪氨酸的分析和质量评价提供了有利的分析条件。通过不同色谱柱适用性和方法学考察,发现该方法专属性较强,且色谱柱的长短对该成分的分析无显著影响。为实现快速分析,本试验最终采用短柱进行含量测定。
笔者通过对不同来源鸡骨草叶进行含量测定时发现,广州相思子和毛相思子的样品含量范围分别为3.18~25.70、7.95~31.85 mg/g;相对于广东,广西产鸡骨草叶中N-反式对香豆酰酪氨酸含量相对较低,提示产地不同可导致成分含量存在一定的差异;另外,采收期的不同也可使样品含量存在一定的差异[12],但是否具有规律性有待后续研究进一步探讨。不同来源鸡骨草叶中N-反式对香豆酰酪氨酸干膏纯度为4.95%~61.99%,经相关性分析结果显示,干膏纯度与干膏含量存在线性关系,这为后期N-反式对香豆酰酪氨酸的进一步纯化及单体制备的选材奠定了基础。
综上所述,所建含量测定方法简便、准确、稳定性较好;优化所得工艺稳定、可行。
