白及有效成分Militarine在肝微粒体中的体外代谢途径及其酶促动力学特征Δ
2019-05-31夏涛王昌权陈浩郑林巩仔鹏李月婷李勇军黄勇潘洁
夏涛,王昌权,陈浩,郑林,巩仔鹏,李月婷,李勇军,黄勇,潘洁#
(1.贵州省药物制剂重点实验室/药用植物功效与利用国家重点实验室,贵阳 550004;2.贵州医科大学药学院,贵阳 550004;3.民族药与中药开发应用教育部工程研究中心,贵阳 550004)
白及为兰科植物白及[Bletilla striata(Thunb.)Reichb.f.]的干燥块茎,是2015年版《中国药典》(一部)收载的常用药材,具有收敛止血、消肿生肌的作用,可用于治疗咯血、外伤出血、疮疡肿毒、皮肤皲裂等病症[1-2]。目前,以白及为主药制备并上市的药品有白百抗痨颗粒、百贝益肺胶囊、结核丸等多个品种。本课题组前期研究发现,白及有效部位可通过促进血小板活化、形变、聚集、凝血来增加血液黏度,从而发挥止血作用[3-4]。Militarine为白及有效部位中含量较高的活性成分,其在白及药材中的含量达1.45%~3.32%[5-6]。药理研究证实,Militarine能改善慢性脑缺血模型大鼠的认知功能障碍,减轻其脑白质缺血性损伤,并具有舒张血管的作用[7-8]。由此可见,Militarine是一种具有药物开发前景的天然化学成分。
药物代谢是药物在体内产生药效及毒性的主要过程,为筛选药物活性成分、降低药物研发过程中的高淘汰率,对候选化合物的代谢过程进行基础研究具有重要意义[9]。肝脏富含众多药物代谢酶,是药物代谢的主要场所[10]。肝微粒体是应用最为广泛的一个体外代谢模型,通过其获得的药物体外代谢特征可在一定程度上反映药物的体内代谢特性[11]。目前,关于Militarine的体内过程研究鲜见报道,其吸收、分布、代谢和排泄特征尚不明确。因此,本课题组采用肝微粒体体外孵育法对Militarine进行代谢研究,通过超高效液相色谱-四极杆-飞行时间质谱联用技术对Militarine的代谢产物进行结构鉴定,推测其在肝微粒体中可能的代谢途径;并通过超高效液相色谱-三重四极杆串联质谱联用技术考察Militarine在肝微粒体中代谢的酶促动力学特征,为该活性成分的代谢机制及在体药动学研究奠定基础。
1 材料
1.1 仪器
UHPLC-QTOF型超高效液相色谱-四极杆-飞行时间质谱联用仪(包括MassLynx V4.1质谱工作站、UNIFI数据库,美国Bruker公司);Acquity UPLC I-Class/Xevo TQ-S型超高效液相色谱-三重四极杆串联质谱联用仪(包括MassLynx V4.1质谱工作站,美国Waters公司);KQ-300DE型数控超声波清洗器(四川沃特尔科技发展有限公司);NA-5L型氮空一体机(北京中兴汇利科技发展有限公司);TARGIN VX-Ⅲ型多管涡旋振荡器(北京踏锦科技有限公司);HtPot70型恒温孵育箱(美国ABSON科学仪器集团);Coulter Optima XPN-100型智能型超速离心机(美国Beckman公司);ST40R型台式大容量冷冻离心机(美国Thermo Fisher公司)。
1.2 药品与试剂
Militarine对照品(成都普思生物科技股份有限公司,批号:ps171128-04,纯度:≥98%);葛根素对照品(内标,中国食品药品检定研究院,批号:110752-201512,纯度:≥96.0%);二喹啉甲酸(BCA)蛋白浓度测定试剂盒(江苏碧云天生物技术研究所);人肝微粒体(武汉普莱特生物医药技术有限公司,批号:M10001.2017002,蛋白浓度:20 mg/mL;于-80℃冷冻保存,临用前用PBS稀释至所需浓度);还原性辅酶Ⅱ(NADPH,批号:1113N021)、磷酸盐缓冲液(PBS,pH 7.4)均购自北京索莱宝科技有限公司;氯化钠注射液(山东齐都药业有限公司,规格:500 mL∶4.5 g;可作生理盐水使用);乙腈、甲酸为色谱纯,其余试剂均为分析纯,水为超纯水。
1.3 动物
SPF级健康雄性SD大鼠,体质量为(220±20)g,由湖南长沙天勤生物技术有限公司提供,动物生产许可证号:SCXK(湘)2014-0011。动物均在室温(23±2)℃、湿度(45±5)%的条件下适应性饲养1周后进行后续实验。
2 方法与结果
2.1 溶液的配制
2.1.1 Militarine标准溶液 精密称取Militarine对照品适量,用甲醇溶解制成浓度为100 nmol/mL的对照品母液。临用前以甲醇稀释至所需浓度,即得。
2.1.2 内标溶液 精密称取内标对照品适量,用甲醇溶解制成质量浓度为1 μg/mL的内标溶液。
2.1.3NADPH溶液 精密称取NADPH适量,以PBS溶解制成400 mg/mL(即538µmol/mL)的母液,于-80℃下保存,备用。临用前以PBS稀释至所需浓度。
2.2 大鼠肝微粒体的制备
取大鼠6只,禁食不禁水过夜,次日经股动脉取血,然后处死。开腹迅速取出肝脏,用生理盐水灌注至土黄色,以1.15%氯化钾溶液洗涤3次,滤纸吸干后称定质量。将肝脏剪碎至约3 mm×3 mm×3 mm的碎片,加3倍体积(mL/g)生理盐水,冰浴中匀浆。匀浆液在4℃条件下以3 000×g离心10 min;取上清液,以双层纱布滤过后,在4℃条件下以12 000×g离心20 min;取上清液,继续在4℃条件下以100 000×g离心45 min,所得沉淀即为大鼠肝微粒体。在沉淀中加入含20%甘油的生理盐水,用移液枪吹散均匀,取适量,采用BCA试剂盒测得总蛋白质量浓度为15 mg/mL。剩余大鼠肝微粒体于-80℃冷冻保存,临用前以PBS稀释至所需浓度。
2.3 Militarine在大鼠/人肝微粒中的代谢途径考察
2.3.1色谱条件色谱柱:Waters BEH C18(50 mm×2.1 mm,1.7µm);保护柱:Waters VanGuard BEH C18(5 mm×2.1 mm,1.7µm);流动相:0.01%甲酸水溶液(A)-0.01%甲酸乙腈溶液(B),梯度洗脱(0~2 min,95%A;2~8 min,95%A→2%A;8~10 min,2%A;10~12 min,2%A→95%A);流速:0.4 mL/min;柱温:35 ℃;进样量:1 µL。
2.3.2 质谱条件 电喷雾离子源(ESI);扫描方式:负离子扫描(ESI-);质荷比(m/z)扫描范围:50~1 200;毛细管电压:1.5 kV;离子源温度:100℃;锥孔电压:30 V;脱溶剂气温度:300℃;锥孔气流量:50 L/h;碰撞能量:20~30 eV;脱溶剂气流量:10 L/min;数据采集模式:全信息串联质谱;甲酸钠校正,校正模式:Sensitivity。
2.3.3 Militarine在大鼠肝微粒体中的代谢产物测定(1)孵育条件:在离心管中加入大鼠肝微粒体溶液100 μL(蛋白终浓度为1 mg/mL,下同)、PBS 48 μL、50 nmol/mL的Militarine标准溶液2 μL(作为样品组),于37℃下预孵育5 min;然后加入1µmol/mL NADPH溶液40 μL启动反应。分别于反应0、10、30、60、120 min时,加入预冷的甲醇200 μL并立即在-20℃条件下冻存30 min以终止反应。同时设置空白组和对照组,空白组除不加入Militarine标准溶液、对照组除加入灭活的大鼠肝微粒体(加适量甲醇灭活)之外,其余操作相同,并分别于反应0、120 min后终止反应。(2)代谢产物测定:将反应液涡旋混匀3 min,超声(功率:300 W,频率:50 kHz)5 min,5 000 r/min离心5 min;取上清液,于37 ℃下以氮气流吹干,残渣加50%甲醇200µL复溶,按“2.3.1”“2.3.2”项下色谱、质谱条件测定。每个时间点均采用双样本分析。
2.3.4 Militarine在人肝微粒体中的代谢产物测定 取冻存的人肝微粒体溶液,于4℃下自然解冻、稀释后,按“2.3.3”项下方法同步操作,进行分组体外孵育反应及代谢产物测定。
2.3.5 Militarine的代谢途径分析 经MassLynx V4.1质谱工作站对“2.3.3”“2.3.4”项下测定结果进行分析与处理,Militarine在不同组大鼠/人肝微粒体中代谢120 min时的总离子流图见图1、图2。结果显示,Militarine及其代谢产物在ESI-模式下响应较好,结合UNIFI数据库并参考文献[12-13]后认为,在保留时间4.44 min处出现的m/z725.268 1[M-H]-峰所对应的化合物可能为Militarine,而在4.18 min处出现的m/z457.174 1[M-H-C13H16O6]-峰与Militarine对照品的主要碎片离子峰保留时间一致。由此确定,保留时间为4.44 min的峰(Y1)对应化合物为Militarine;而对于保留时间为4.18 min的峰(M1),采用Single Mass Analysis功能模块预测其对应化合物的化学式为C21H29O11。据此推测,M1可能为Militarine的酯键水解代谢产物。Militarine在肝微粒体中的可能代谢途径见图3。
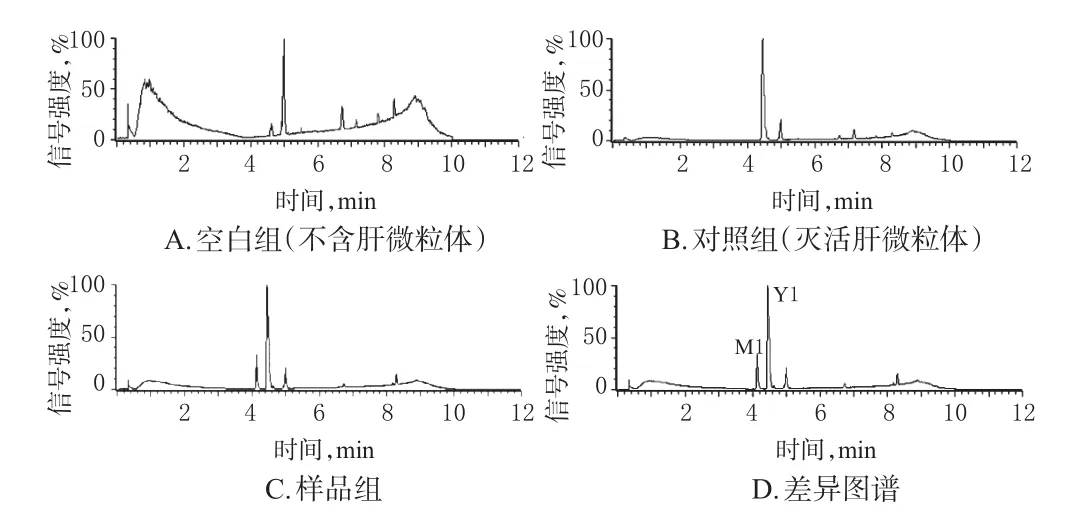
图1 Militarine在大鼠肝微粒体中代谢120 min时的总离子流图Fig 1 Total ion chromatograms of the metabolites of Militarine in rat liver microsomes for 120 min
2.4 Militarine在大鼠肝微粒体中的酶促动力学考察
2.4.1色谱条件色谱柱:Waters BEH C18(50 mm×2.1 mm,1.7µm);流动相:0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱(0~0.5 min,90%A;0.5~1 min,90%A→10%A;1~2 min,10%A;2~3 min,10%A→90%A);流速:0.3 mL/min;柱温:40 ℃;进样量:1µL。
2.4.2 质谱条件 ESI;毛细管电压:3 kV;离子源温度:150℃;去溶剂气温度:600℃;去溶剂气:氮气,流速:1 000 L/h;反吹气:氮气,流速:50 L/h;碰撞气:氩气,流速:0.16 mL/min;扫描方式:多反应离子监测模式(MRM)。
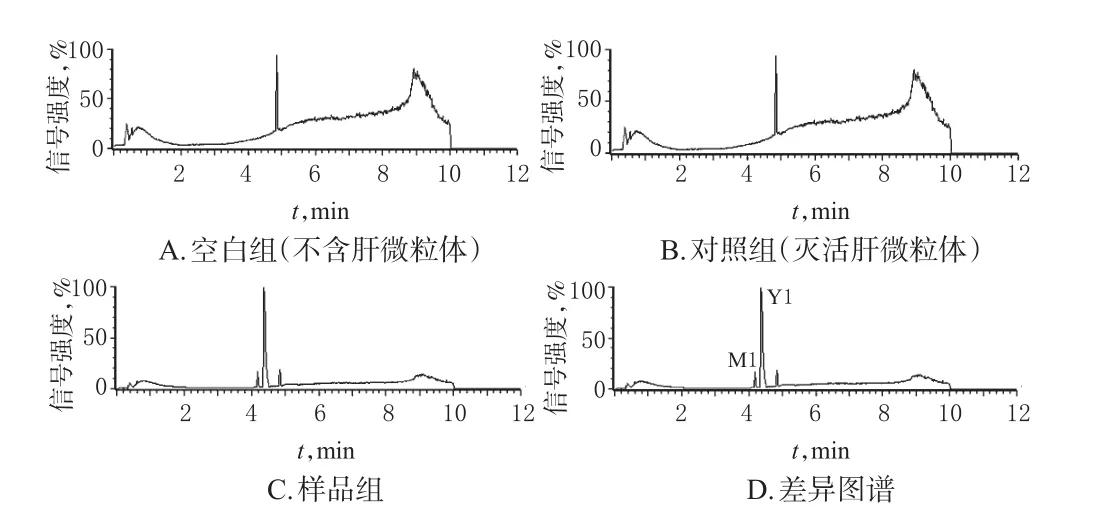
图2 Militarine在人肝微粒体中代谢120 min时的总离子流图Fig 2 Total ion chromatograms of the metabolites of Militarine in human liver microsomes for 120 min
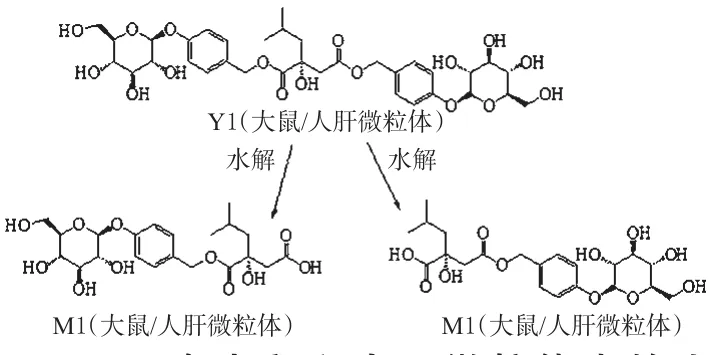
图3 Militarine在大鼠和人肝微粒体中的生物转化途径Fig 3 Biotransformation pathway of Militarine in rat and human liver microsomes
2.4.3 方法学考察 (1)专属性考察。参照“2.3.3(1)”项下体外孵育条件,取空白大鼠肝微粒体100 μL,加甲醇200 μL灭活,除不加入Militarine标准溶液与内标溶液外,其余同法操作,孵育反应60 min,得空白组样品。另取空白大鼠灭活或不灭活肝微粒体100 μL,均分别加入 50 μmol/L 的 Militarine标准溶液 2 μL、内标溶液200 μL,同法操作,作为对照组样品和样品组样品。然后按“2.4.1”“2.4.2”项下色谱、质谱条件测定。结果显示,Militarine与其他峰之间的分离度良好;Militarine与内标的保留时间分别为1.33、1.27 min(图略)。
(2)线性关系考察。取空白大鼠肝微粒体100 μL,加入适量甲醇灭活,再加入系列不同浓度的Militarine标准溶液2 μL(终浓度分别为0.001、0.01、0.1、1、5、10、15 nmol/mL)、内标溶液200 μL,参照“2.3.3(1)”项下体外孵育条件,孵育反应60 min,再按“2.4.1”“2.4.2”项下色谱、质谱条件测定。以待测物浓度为横坐标(x)、待测物与内标的峰面积之比为纵坐标(y)进行线性回归,得标准曲线为y=1 232.1x+0.081(r=0.999 9),表明Militarine浓度在0.001~15 nmol/mL范围内线性关系良好。
(3)提取回收率和基质效应考察。按“2.4.3(2)”项下方法分别配制含Militarine低、中、高浓度(终浓度分别为0.001、1、10 nmol/mL)的大鼠肝微粒体孵育体系质控(QC)样品,加入内标溶液200 μL,平行6份操作,参照“2.3.3(1)”项下体外孵育条件进行反应,得样品A。另配制空白灭活大鼠微粒体孵育体系,除不加Militarine标准溶液与内标溶液外,同法进行孵育反应,然后向沉淀蛋白后的上清液中加入相应低、中、高浓度的Militarine溶液与内标溶液,得样品B。另以初始流动相配制对应浓度的Militarine标准溶液与内标溶液,作为样品C。分别按“2.4.1”“2.4.2”项下色谱、质谱条件测定,计算样品A与样品B的峰面积之比,作为提取回收率;计算样品B与样品C的色谱峰面积之比,作为基质效应。结果显示,低、中、高浓度Militarine的提取回收率为87.01%~99.29%,基质效应为91.18%~99.92%。
(4)准确度和精密度考察。按“2.4.3(3)”项下方法分别配制含Militarine低、中、高浓度的QC样品,加入内标溶液200 μL,平行6份操作,参照“2.3.3(1)”项下体外孵育条件进行反应,连续测定2 d;同时建立随行标准曲线,按随行标准曲线计算QC样品的浓度。将测得值与QC样品理论值相比较,以其百分比评价方法准确度;同时,对测得值进行比较以评价方法精密度。结果显示,低、中、高浓度样品准确度为80.24%~99.19%,测得值的RSD值均小于10%,表明该方法准确度和精密度均良好。
(5)稳定性考察。按“2.4.3(3)”项下方法分别配制含Militarine低、中、高浓度的QC样品,加入内标溶液200 μL,平行6份操作,参照“2.3.3(1)”项下体外孵育条件进行反应。然后在室温下放置0、12 h时分别进样测定。另配制低、中、高浓度QC样品,分别在4℃下冷藏24 h、-20℃冷冻-融化循环3次,同法孵育反应后测定。结果显示,Militarine在上述条件下放置后测得值的RSD值均小于10%,表明其稳定性良好。
2.4.4 孵育条件优化 参照“2.3.3(1)”项下体外孵育条件,考察不同蛋白终浓度(0、0.125、0.25、0.5、1 mg/mL)和不同孵育时间(0、10、20、30、60、90 min)对Militarine(固定加入50 nmol/mL Militarine标准溶液2 μL)代谢的影响,优化其孵育条件。分别以蛋白浓度和孵育时间为横坐标、Militarine在微粒体中代谢转化量(Militarine初始浓度为C0,终止反应后测定浓度为Ct,代谢转化量为C0-Ct)为纵坐标,经GraphPad Prism 5.0软件拟合代谢转化曲线(见图4)。结果显示,Militarine的代谢转化量随微粒体蛋白浓度增大而增加;而随着孵育时间延长,其代谢转化量先增加,后逐渐趋于饱和。因此,选择蛋白浓度0.5 mg/mL、孵育时间30 min作为最佳孵育条件进行酶促动力学试验。
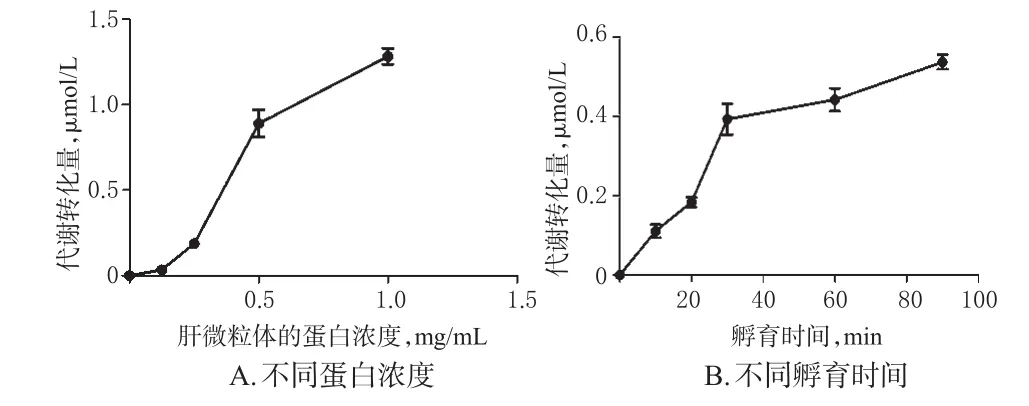
图4 Militarine在大鼠肝微粒体中的代谢转化曲线Fig 4 Metabolic transformation curves of Militarine in rat liver microsomes
2.4.5 酶促动力学考察 为考察Militarine的酶促反应是否依赖于NADPH,故分为NADPH组和NADPH阴性组进行考察。参照“2.3.3(1)”项下体外孵育条件操作,配制含不同浓度Militarine的孵育体系(终浓度分别为 0.005、0.01、0.25、0.5、0.1、0.25、0.5、0.75、1、5、10 nmol/mL,并确保反应体系中甲醇的体积分数≤1%),除加入或不加入NADPH外,其他条件相同,孵育60 min后终止反应。其中NADPH组的反应以加入NADPH时开始计时,NADPH阴性组(加入等体积PBS代替NADPH溶液)的反应以加入Militarine时开始计时。反应完毕后将反应液涡混3 min,在4℃下15 000 r/min离心5 min,取上清液,按照“2.4.1”“2.4.2”项下色谱、质谱条件测定。以Militarine的浓度(S)为横坐标、Militarine的清除速率(v)为纵坐标绘制酶促反应动力学曲线。根据米氏方程v=vmax×S/(km+S),采用规划求解的方法计算最大清除速率(vmax)、米氏常数(km)和固有清除率(CLint,计算公式为:CLint=vmax/km)。Militarine的酶促反应动力学参数结果见表1,NADPH组和NADPH阴性组Militarine酶促反应动力学曲线分别见图5、图6。经SPSS 24统计学软件处理,采用t检验,结果显示,Militarine在有/无NADPH参与的反应条件下,其CLint差异无统计学意义(P>0.05),表明其体外代谢不依赖于由NADPH启动的细胞色素P450(CYP)酶代谢途径,推测可能是经由肝微粒体中其他水解酶代谢。
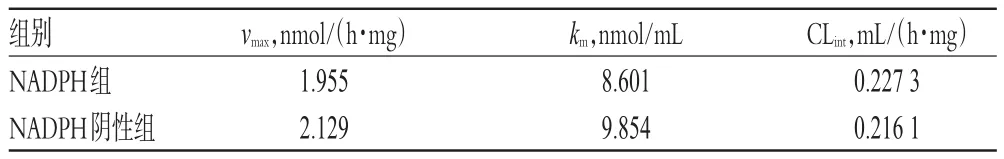
表1 Militarine的酶促反应动力学参数Tab 1 Kinetic parameters of Militarine enzymatic reaction
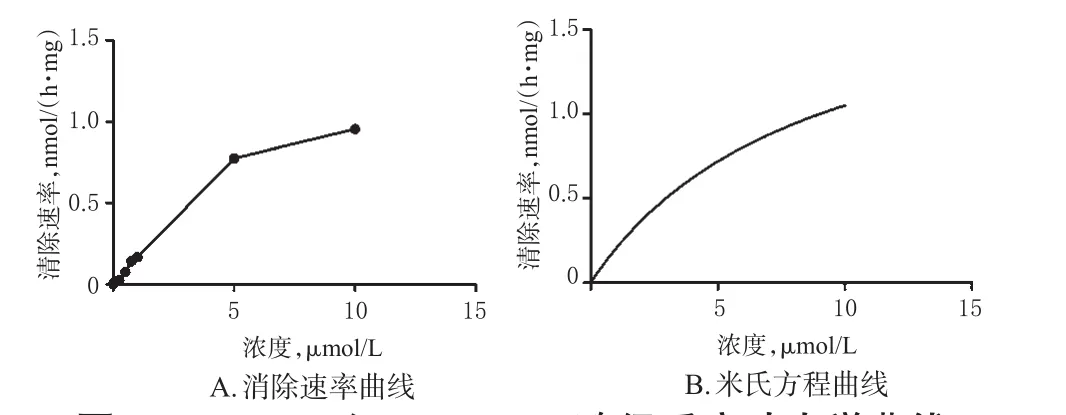
图5 NADPH组Militarine酶促反应动力学曲线Fig 5 Kinetic curves of Militarine enzyme reaction in NADPH group
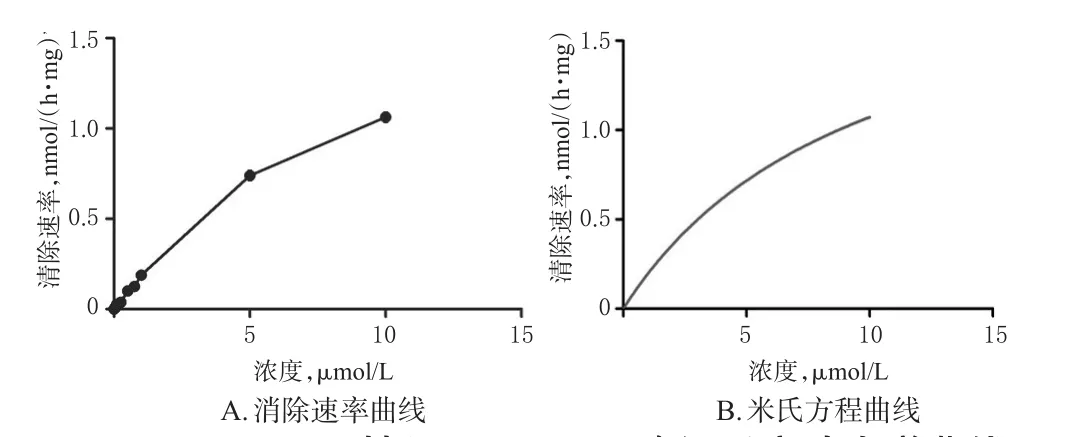
图6 NADPH阴性组Militarine酶促反应动力学曲线Fig 6 Kinetic curves of Militarine enzyme reaction in NADPH negative group
3 讨论
肝脏是药物重要和主要的代谢器官,是药物发生生物转化的重要场所,因其富含药物代谢酶系统,故参与了大部分药物的体内代谢过程,因此药物的体外代谢模型主要以肝脏为基础。体外代谢研究具有排除体内代谢诸多干扰因素,为体内代谢研究提供可靠的理论依据,且不消耗大量的实验动物和样品等优点,在药物代谢研究中得以广泛的应用[14-15]。肝微粒体体外温孵试验是采用从肝脏中获取的肝微粒体,在体外模拟生理环境条件下进行的代谢反应,该方法代谢过程快、结果重现性好,便于收集和积累代谢样品供代谢产物的结构确证研究,在实际工作中得到普遍运用[11]。
药物在肝脏中的代谢分为Ⅰ相代谢(生物转化)和Ⅱ相代谢(结合反应),Ⅰ相代谢包括氧化、还原和水解,其中最主要的酶促反应为氧化反应,其次是还原和水解反应[16]。水解反应相关的酶主要为酯酶和过氧化物水解酶,其中酯酶介导的水解反应包括酯类、酰胺类、肼类和氨基甲酸盐类化合物的水解,主要发生在血浆(由非特异性乙酰胆碱酯酶、假胆碱酯酶和其他酯酶催化)和肝脏(由作用于特异性化合物的酯酶催化)中,而过氧化物水解酶主要催化混合功能氧化酶系反应生成的过氧化代谢物[17]。Militarine是从白及中分离得到的单体,为丁二酸苄酯苷类化合物,是由2-异丁基苹果酸与4-葡萄糖基苄醇形成的双酯类衍生物,其化学结构中C1、C4位存在的两个酯键使其极易发生水解反应[11]。本研究采用超高效液相色谱-质谱联用技术分别对Militarine经大鼠或人肝微粒体体外孵育后的代谢产物进行定性鉴定,利用其质谱碎片离子信息对主要代谢产物进行鉴定;同时,建立了采用超高效液相色谱-串联质谱联用技术测定Militarine含量的方法,该方法的专属性、回收率、精密度、稳定性较好,具有灵敏、准确、快速的特点,可为Militarine体内过程的定量分析提供技术支持。
本研究结果显示,Militarine能在肝微粒体中代谢,主要代谢产物M1为Militarine酯键水解产物。但Militarine可分别在C1、C4位发生酯键水解,所产生两个代谢产物互为同分异构体,具有相同分子式、碎片离子等信息,因此在缺乏M1对照品的情况下,本研究尚无法确定水解发生在C1位还是C4位,所生成的到底是哪一个代谢产物还需进一步研究。但能够明确的是,Militarine在肝脏中的代谢为酯键断裂,所得代谢产物化学式预测为C21H29O11。
vmax、km和CLint为酶促动力学的主要参数,其中vmax值反映的是酶对底物的最大反应效力和酶促反应速度的快慢[18];km值代表了酶对底物的亲和能力,该值越大,则提示酶对底物的亲和能力越弱;CLint则反映了酶对底物的清除能力,该值越大,则提示酶对底物的清除能力越强[15]。本研究通过考察Militarine的酶促反应动力学发现,NADPH参与或不参与的酶促反应的CLint值差异无统计学意义(P>0.05)。这表明Militarine在肝微粒体中的代谢不依赖于由NADPH启动反应的CYP酶代谢途径,推测其可能经由肝微粒体中其他水解酶途径代谢。
综上所述,白及有效成分Militarine在肝微粒体中代谢的主要途径为C1、C4位酯键的水解,且并不依赖于由NADPH启动的CYP酶代谢途径。
