猪JMJD3基因真核表达及其对炎性因子表达调控的研究
2019-05-31张彦兵魏建超邵东华李蓓蓓马志永孙延鸣邱亚峰
杨 义,陆 艳,张彦兵,魏建超,刘 珂,邵东华,李蓓蓓,马志永,孙延鸣,邱亚峰
(1.石河子大学动物科技学院,石河子 832003;2.中国农业科学院上海兽医研究所,上海 200241)
JMJD3又称KDM6B,是含JMJC结构域的组蛋白去甲基化酶家族成员之一[1]。自从2006年,鉴定出第一个含JMJC结构域的组蛋白去甲基化酶,并命名为JHDM1A又称KDM2A。目前,该家族已鉴定多个成员,如JHDM1A、JHDM1B、JMJD1A、JMJD2A、JMJD2B、JMJD2C、JMJD3、JMJD6、JARID1A、JARID1B、JARID1C、JARID1D、 UTX和UTY等[2-11]。该家族去甲基化酶活性的催化机制已比较清楚,JMJC结构域在Fe2+、α-酮戊二酸和O2的参与下,催化组蛋白赖氨酸残基上甲基化氨基生成羟基化中间体,同时产生1分子琥珀酸盐和1分子CO2,随后该中间体生成不稳定的半氨醛,并进一步分解为去甲基化赖氨酸和甲醛[12]。
虽然JMJD3是H3K27特异的去甲基化酶,但是,JMJD3可以通过去甲基化酶依赖或非依赖的途径介导基因的转录调控,进而参与发育、癌症以及免疫反应等多种生命活动。值得一提的是,JMJD3参与免疫反应调控,主要通过去甲基化酶依赖或非依赖的途径介导炎性因子的表达调控。其中,JMJD3去甲基化酶依赖的途径,即改变H3K27的甲基化的水平从而影响炎性因子的表达,这种JMJD3的调控作用可通过其特异性的抑制剂GSK-J4进行抑制[13]。此外,有研究显示JMJD3可以作为STAT1和STAT3的靶分子介导LPS诱导的炎性反应,该作用是不依赖其去甲基化酶活性的[14]。
在兽医临床上,病原微生物感染往往伴随有剧烈的炎性反应,JMJD3是否在其中起着重要的作用还未见报道。本研究聚焦于猪JMJD3分子,通过构建猪JMJD3基因真核表达载体,并通过瞬时转染研究其在细胞内的表达情况。随后,利用建立的过表达模型探讨猪JMJD3对炎性因子的表达调控作用。本研究结果为将来研究JMJD3对炎性因子的表达调控作用奠定了基础。
1 材料与方法
1.1 载体、细胞及主要试剂 真核表达载体p3x Flag-CMV-14、293T细胞、猪髋动脉内皮细胞由本实验室保存;DNA Marker、大肠杆菌DH5α 购自北京天根生物公司;氨苄青霉素钠购自摩贝(上海)生物科技有限公司;鼠抗Flag一抗购自Sigma-Aldrich公司、辣根过氧化物酶(HRP)标记的羊抗鼠二抗购自Abcam公司;蛋白预染Marker、Lipofectamine 2000和羊抗小鼠荧光二抗购自Thermo公司;大提质粒试剂盒购自QIAGEN公司;DMEM培养基、胎牛血清购自Gibco公司;TRIzol、PrimeScriptTMRT Master Mix(Perfect Real Time)、TB GreenTMPremix ExTaqTMII(Tli RNaseH Plus)和限制性内切酶购自宝日医生物技术(北京)有限公司(TaKaRa中国)。
1.2 真核表达载体的构建、转染及表达鉴定
1.2.1 真核表达载体的构建 含有JMJD3基因(GenBank登录号:MK250967)的质粒pUC57-JMJD3,由本实验室构建。本研究以重组克隆质粒为模板进行PCR扩增(引物序列见表1)。反应条件:98℃变性10 s,68℃延伸6 min,30个循环,4℃ 保存。通过琼脂糖凝胶电泳将目的DNA片段进行纯化回收,将回收的PCR产物与p3xFlag-CMV-14真核表达载体分别用NotI 和XbaI 进行双酶切,酶切产物纯化后16℃连接过夜,连接产物转化至DH5α感受态中,涂布于含有Amp的LB琼脂平板,37℃ 培养12~16 h,挑取单克隆接种于含有Amp的LB液体培养基中,5~8 h后通过菌液PCR鉴定,提取质粒进行双酶切鉴定,将鉴定阳性的重组质粒送上海英骏生物技术有限公司进行测序。
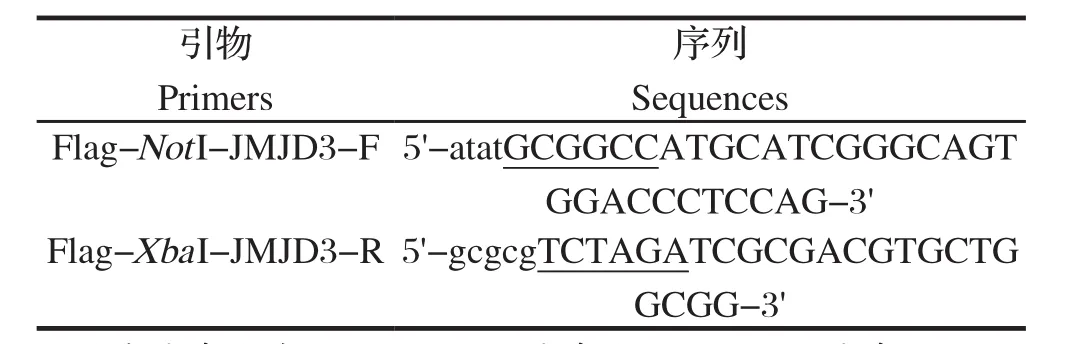
表1 PCR扩增所用引物Table 1 The primers in this study
1.2.2 真核表达质粒转染细胞 提前12 h将293T细胞铺到六孔板中,当细胞长到70%~80%聚合时,利用Lipofectamine 2000将p3xFlag-CMV-14载体和Flag-JMJD3 质粒分别瞬时转染,转染24 h后收取细胞样品,用于后续实验。
1.2.3 Western blot检测 配制8%聚丙烯酰胺凝胶进行SDS-PAGE,湿转160 min转印至NC膜,5%脱脂乳室温摇床封闭1 h,弃去封闭液,TBST漂洗后加入稀释好的鼠抗Flag抗体(1∶3000),4℃摇床孵育过夜,回收抗体后加TBST置室温摇床漂洗10 min重复3次,加入HRP标记的羊抗鼠二抗(1∶5000),室温摇床孵育1 h,弃去抗体加TBST置室温摇床漂洗10 min重复3次,暗室中进行显影。
1.2.4 间接免疫荧光检测(indirect immunoinfluorescence assay,IFA) 提前12 h将细胞铺到六孔板中,按照相同的方法转染PIEC,24 h后弃去上清,PBS漂洗一遍,用4%多聚甲醛于4℃固定30 min,PBS漂洗3遍后,1% NP40通透15 min,再用PBS漂洗3次,用含2%羊血清的封闭液室温封闭30 min,室温孵育鼠抗Flag一抗(1∶400)1 h,加PBS室温摇床漂洗5 min,重复3次,室温避光孵育羊抗鼠488二抗1 h,加PBS室温摇床漂洗5 min,重复3次。然后DAPI染色10 min,加PBS室温摇床漂洗5 min,重复3次,最后用封片剂封片,荧光显微镜观察拍照。
1.3 猪JMJD3介导的炎性调控作用分析 提前12 h将PIEC铺至24孔板,按照相同方法转染PIEC,24 h后PBS 洗1遍,弃去PBS后每孔加入1 mL TRIzol ,收取RNA样品,反转录后进行实时荧光定量PCR分析[15]。引物见表2。
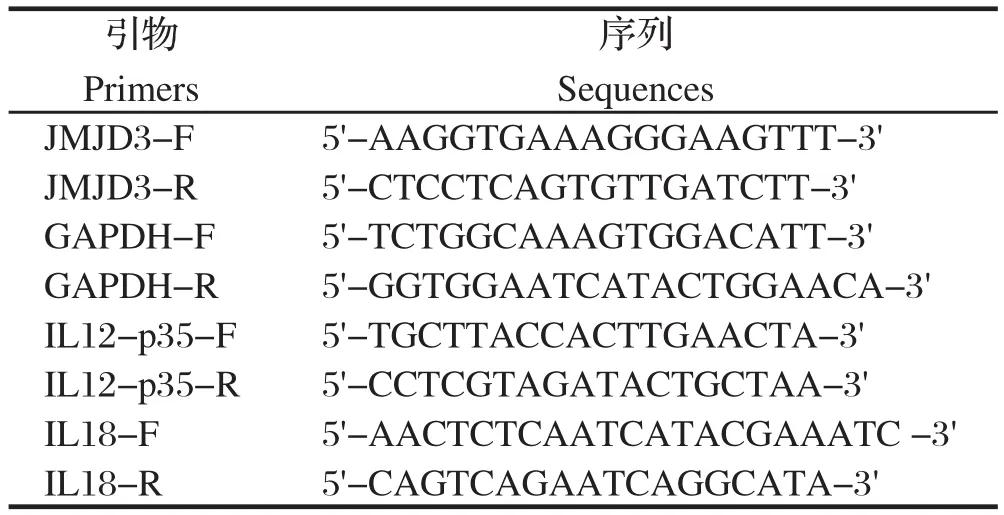
表2 实时荧光定量PCR引物Table 2 Primers for real-time qPCR
2 结果
2.1 猪JMJD3真核表达载体的构建 以pUC57-JMJD3克隆质粒为模板,利用PCR扩增JMJD3基因,扩增产物经0.8% 凝胶电泳检测,结果显示在约5000 bp处有一特异性条带,与预期一致(图1A)。将PCR产物经NotI和XbaI双酶切后克隆到p3xFlag-CMV-14真核表达载体中,获得的重组质粒Flag-JMJD3利用NotI和XhoI进行双酶切鉴定,可见两条大小分别为7700 bp及3500 bp左右的片段,与预期结果一致(图1B)。此外,对阳性质粒进行测序验证,结果显示猪JMJD3基因成功插入p3xFlag-CMV-14真核表达载体中。
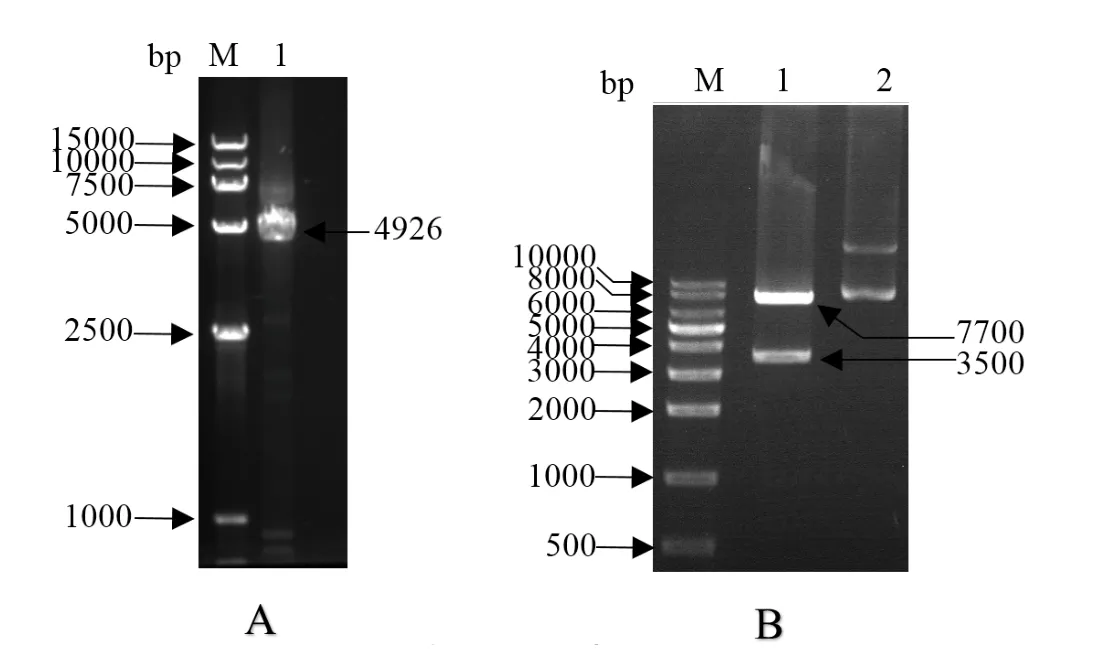
图1 猪JMJD3真核表达载体的构建Fig.1 Construction of eukaryotic expression vector of porcine JMJD3
2.2 Western blot 分析rJMJD3表达 将重组表达质粒Flag-JMJD3与 Flag-vector分别转染293T细胞,24 h后收取细胞总蛋白进行Western blot分析,利用抗Flag 标签抗体鉴定Flag-JMJD3的表达。结果显示,转染Flag-JMJD3 组在约200 kDa 处出现特异性的条带(图2),Flag-vector组没有出现条带。以上结果说明Flag-JMJD3质粒可在293T细胞系中成功表达,表达的蛋白命名为rJMJD3。

图2 Western blot 鉴定rJMJD3表达Fig.2 Analysis of Flag-JMJD3 expression by Western blot
2.3 IFA分析rJMJD3表达及细胞定位 为进一步检测Flag-JMJD3的表达及细胞定位,将重组表达质粒Flag-JMJD3和Flag-vector瞬时转染入PIEC,并利用IFA对转染的样品进行分析。结果显示:仅转染Flag-JMJD3的细胞显示特异的绿色荧光,并且定位于细胞核中(图3)。因此,IFA结果进一步验证了rJMJD3在细胞中的表达,并且揭示表达的rJMJD3主要定位于细胞核。
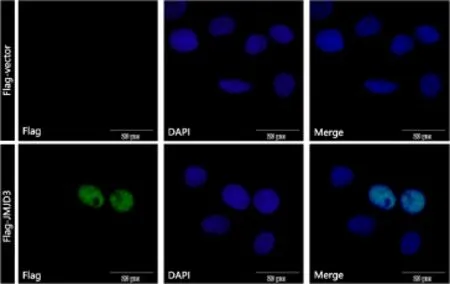
图3 IFA分析结果(x400)Fig.3 Analysis of rJMJD3 expression by IFA
2.4 JMJD3 对炎性因子表达调控分析 为了探讨猪JMJD3对炎性因子的表达调控作用,将重组表达质粒Flag-JMJD3和Flag-vector瞬时转染PIEC,24 h后收获样品。首先,采用Western blot检测Flag-JMJD3表达JMJD3情况,结果显示能有效表达rJMJD3(图4A)。随后,采用RT-qPCR对炎性细胞因子IL12-p35、IL-18等表达情况进行检测,结果显示:相对于空载体组对照组,rJMJD3的表达可以显著促进IL12-p35和IL-18的表达(图4B、4C)。因此,以上结果表明猪JMJD3参与炎性因子的表达调控。
3 讨论
本研究通过真核表达鉴定了猪JMJD3的表达特征,包括:1)在真核细胞中,猪JMJD3的分子质量约200 kDa;2)表达的JMJD3主要定位于细胞核中。另外,我们的研究还揭示了过表达猪JMJD3可促进炎性因子IL-12p35和IL-18的表达,并说明猪JMJD3在炎性细胞因子表达调控中起重要的作用。
在人和小鼠上,JMJD3已鉴定为H3K27的特异的去甲基化酶[1,11]。因此,不难理解过表达的猪JMJD3主要定位于细胞核中,这一结果与人和小鼠的结果一致。但猪JMJD3是否为H3K27的去甲基化酶需要进一步的研究,另外,猪JMJD3是否可以介导其他组蛋白如H3K4、H3K9、H3K36等去甲基化也还不清楚,需要进一步研究。
染色体表观遗传修饰控制基因的表达或沉默,其中,H3K27m3作为一种重要的基因沉默或转录抑制的形式[16],控制基因的表达,从而参与发育、炎性反应、癌症等生命活动。在炎性反应调控中,JMJD3作为H3K27m3特异的去甲基化酶,可以降低H3K27的甲基化水平,进而降低基因转录的抑制,从而诱导相关基因的表达[17]。比如H3K27m3可以靶向于IL-12的启动子,继而抑制IL-12基因的转录,而JMJD3的表达可介导H3K27的去甲基化,从而促进IL-12的表达[18]。
我们的研究结果显示过表达猪JMJD3也可以促进IL-12p35的表达(图4C),同时,JMJD3过表达还可以促进IL-18的表达。这些结果说明JMJD3可以介导炎性因子的表达调控。然而,目前对JMJD3过表达促进这些细胞因子表达机制还不清楚,即是通过去甲基化酶依赖的途径还是非依赖的途径需要进一步的研究。总之,本研究明确了猪JMJD3在真核细胞中的表达特征,并初步揭示了JMJD3在炎性因子表达调控中起重要作用。这些结果对将来揭示猪JMJD3在炎性疾病中的作用奠定基础。

图4 过表达rJMJD3 对炎性因子表达的影响Fig.4 Influence of rJMJD3 overexpression on the expression of inflammatory factors
