猪外周血及骨髓源树突状细胞分化方法的建立
2019-05-31赵文影姜一峰虞凌雪朱豪杰李国新张玉娇李丽薇周艳君刘雪兰童光志
赵文影,姜一峰,虞凌雪,赵 款,朱豪杰,高 飞,李国新,张玉娇,李丽薇,周艳君,刘雪兰,童光志,3
(1.安徽农业大学动物科技学院,合肥230036;2.中国农业科学院上海兽医研究所,上海200241;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
树突状细胞(dendritic cell,DC)是目前已知的机体内功能最强的抗原递呈细胞,是将抗原递呈给B细胞和T细胞从而引发获得性免疫应答的主要细胞[1]。DC于19世纪30年代被美国学者分离出来,在抗病毒、肿瘤治疗的研究中均得到广泛应用[2-3]。目前公认的DC类型按来源主要有两种:髓系和淋巴系,二者在特性和功能上存在一定差别,但是均具有很强的抗原递呈能力,在获得性免疫应答建立过程中发挥重要作用[4]。获取人源和鼠源DC的方法较为成熟,有商品化的试剂盒可供使用,但目前还没有商品化的猪源DC分化试剂盒可供使用,各种猪源DC分化方法间也存在较大差别。本研究对猪外周血和骨髓源单核细胞DC分化方法进行比较和研究,建立了成熟的外周血和骨髓单核细胞源DC分化方法,为进一步研究病毒感染后猪体建立获得性免疫应答的机制奠定了平台基础。
1 材料和方法
1.1 试剂与仪器 淋巴细胞分离液(50494LSM®Lymphocyte Separation Medium)购自Biomedicals MP公司,红细胞裂解液购自Biosharp公司,Recombinant Porcine IL-4和Recombinant Porcine GM-CSF购自R&D公司,CD152(CTLA-4)-muIgR-APC Conjugate 购自ANCELL公司,胎牛血清(FBS)和RPMI 1640 培养基购自GIBCO公司,流式细胞分析仪型号为艾森NovoCyte 452170627408。
1.2 实验动物 15日龄猪繁殖与呼吸综合征病毒(Porcine reproductive respiratory syndrome virus,PRRSV)、猪瘟病毒(Classical swine fever virus,CSFV)、伪狂犬病毒(Psevdorabies virus,PRV)和猪圆环病毒Ⅱ型(Porcine circovirus,PCV2)阴性健康试验猪只购自上海某猪场。
1.3 外周血单核细胞(peripheral blood mononuclear cell,PBMC)制备 静脉采集15日龄猪只抗凝血按照50494 LSM®Lymphocyte Separation Medium说明书进行PBMC的分离。取9 mL抗凝血用PBS进行2倍稀释;将稀释后的抗凝血缓慢加入同体积的淋巴细胞分离液中,采用500×g的转速在室温下离心30 min(快速升速,缓慢降速);用长枪头缓慢吸出液体中间层的PBMC;将吸出的PBMC用400×g的转速在4℃下离心5 min;若底部有红细胞,则按1∶4体积加入红细胞裂解液,静置10 min后在4℃温度下以400×g的转速离心5 min,之后用PBS洗涤3次;最后用含1%双抗的无血清RPMI-1640重悬细胞计数并铺板。
1.4 骨髓源单核细胞的分离 取15日龄的仔猪股骨和胫骨,尽可能的去除附着的肌肉和结缔组织并在75%的酒精中浸泡5 min;用酒精灯轻微煅烧,而后用PBS冲洗干净;用灭菌的骨钳剪开股骨和胫骨两端的骨膜,然后用灭菌的骨髓穿刺针在其两端穿孔;用含有1%双抗的不完全RPMI-1640培养基反复冲洗骨髓腔,收集细胞悬液;用500×g的转速离心10 min, 弃掉上清;用红细胞裂解液裂解5 min后,在4℃下用500×g的转速离心5 min,弃上清;用PBS洗涤2次,用含1%双抗的RPMI-1640培养基重悬细胞,再用70 nm的无菌细胞筛过滤并计数。
1.5 外周血源单核细胞的分化 将1.3中制备的PBMC按每孔2×106个细胞数量铺于六孔板中,置于37℃、5% CO2的培养箱中孵育12 h,弃去上清,用无血清RPMI-1640清洗涤洗2次,此时贴壁的细胞为较为纯净的猪PBMC。用终浓度为100 U/mL青霉素、100 mg/mL链霉素和0.25 mg/mL两性霉素B的RPMI-1640完全培养基进行培养,用不同浓度的GM-CSF和IL-4进行刺激分化,持续7 d。每隔2.5 d,替换一半包含相同浓度细胞因子的完全RPMI-1640培养基,刺激后第7 d在流式细胞仪上检测DC细胞表面分子标志。
1.6 骨髓源单核细胞的分化 将1.4中制备的骨髓细胞按1.5中的方法进行DC细胞表面分子标志检测。
1.7 DC表面分子标志检测 将5×105个DC取置于1.5 mL EP管内进行流式染色,取5 μL CD152抗体加入管内,混匀后置于4℃ 避光静置30 min;PBS洗涤3次;用含1% FBS的杜氏磷酸缓冲液(Dulbecco's phophate buffered saline,DPBS)重悬细胞,在流式细胞仪上进行检测。
2 结果
2.1 外周血来源和骨髓源单核细胞源DC形态 通过单核细胞贴壁时间以及刺激浓度的选择,确定当单核细胞贴壁12 h后,能够获得最多的分化的DC(结果未展示)。刺激7 d后外周血单核细胞和骨髓源单核细胞发生形态学变化,细胞直径变大且表面出现突触(图1)。

图1 单核细胞形态变化Fig.1 Morphology change during stimulation
2.2 外周血单核细胞源DC分化条件的确定 采取不同浓度的GM-CSF和IL-4对贴壁12 h的单核细胞持续刺激,对刺激后0 d、5 d和7 d后的细胞进行流式检测,结果显示当GM-CSF浓度为80 ng/mL、IL-4浓度为40 ng/mL时,刺激后7 d能够获得最大比例的树突状细胞(图2)。
2.3 外周血单核细胞源DC刺激分化结果 选取15日龄仔猪外周血分离PBMC,贴壁12 h后用终浓度为80 ng/mL的GM-CSF和40 ng/mL的IL-4对PBMC持续刺激7 d,用抗CD152抗体进行流式细胞术检测,结果显示通过此方法能够将61.66%的PBMC细胞刺激分化为CD152+的树突状细胞(图3)。

图2 不同刺激条件下CD152+细胞比率Fig.2 The ratio of CD152+ cells stimulated with different conditions
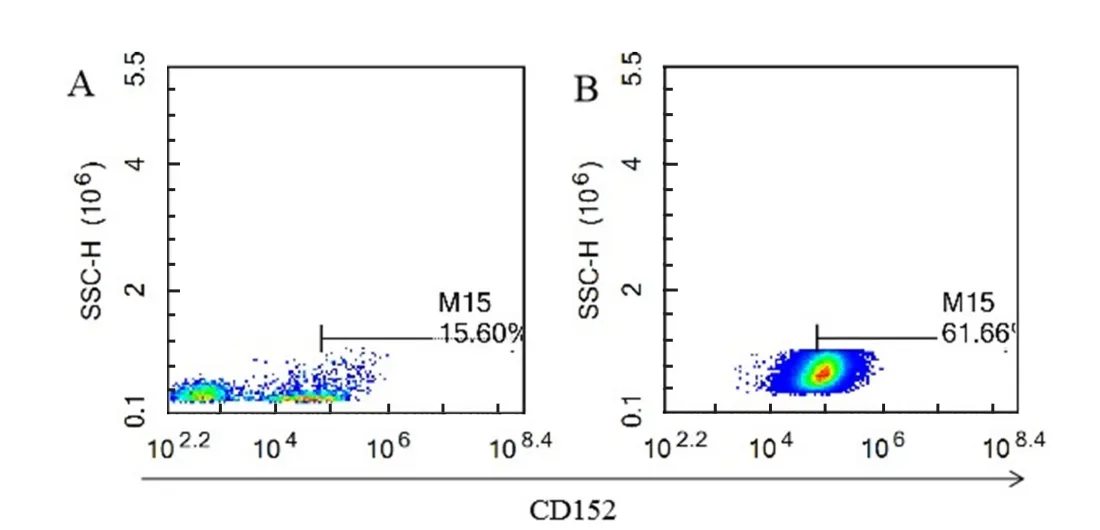
图3 外周血单核细胞源DC表面分子CD152的活化情况Fig.3 Detection of CD152+ cells from PBMCs
2.4 骨髓源DC刺激分化结果 参考外周血分化DC的方法,利用80 ng/mL的GM-CSF和40 ng/mL的IL-4对骨髓源单核细胞进行刺激,连续刺激7 d后,用CD152抗体检测阳性细胞数。结果显示用此方法能够显著刺激骨髓源DC的分化,可以获得约63%的CD152+细胞(图4)。
3 讨论
树突状细胞(DC)是免疫系统中最强的抗原递呈细胞和诱导T细胞和B细胞分化的细胞,是连接先天性和获得性免疫的关键[5]。DC表达一系列的模式识别受体,通过模式识别受体识别入侵宿主的微生物、病毒及内源性危险的信号分子,从而触发多种免疫反应,在抗病毒、抗肿瘤免疫以及免疫耐受的过程中发挥重要作用[6-8]。
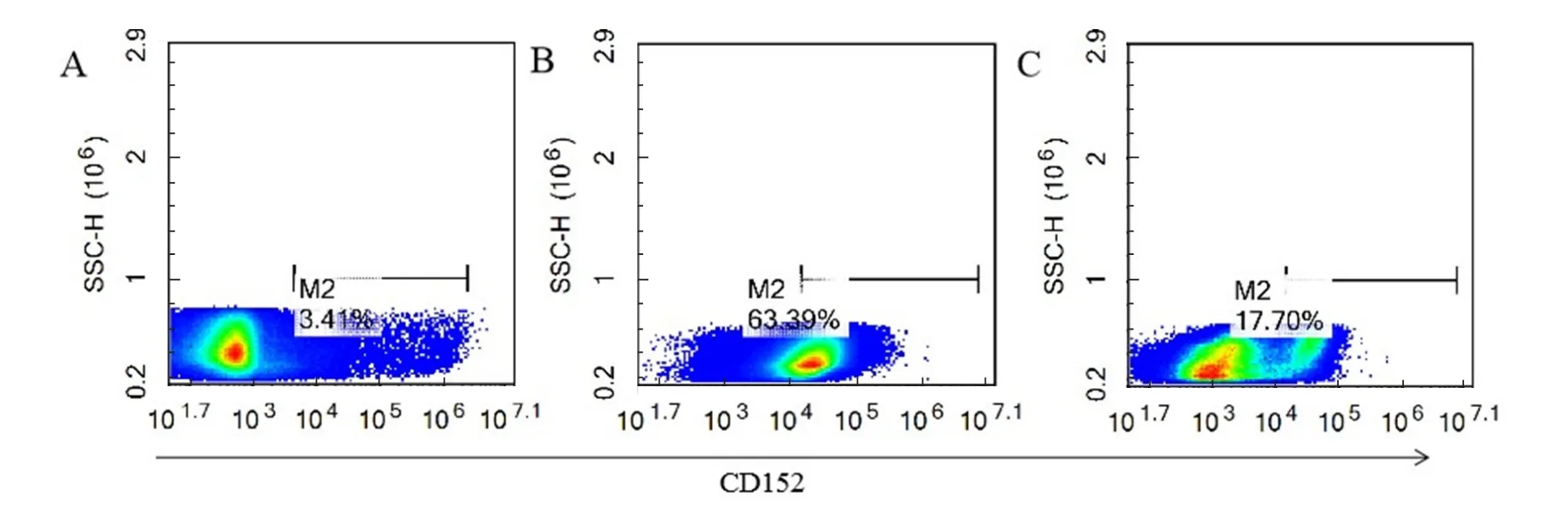
图4 骨髓单核细胞源DC表面分子CD152的活化情况Fig. 4 Detection of CD152+ cells from the bone-derived DC
DC是由造血干细胞在不同的细胞因子刺激下分化而来,并触发不同类型的效应T细胞和B细胞的分化[9-10]。DC的分化成熟是一个复杂的过程,这个过程不仅与DC亚群的特性有关,还与其所在的内环境有关。传统的DC细胞主要分为3个亚群:pDC、cDC1和cDC2[11]。另外,造血干细胞也可分化为单核细胞源的DC细胞(MoDC),且由于单核细胞具有较多与髓样cDC2共有的表面标记分子,MoDC很难与髓样cDC2区分[12-14]。在体外培养MoDC的过程中,人们发现IL-4和GM-CSF是诱导单核细胞向DC分化的主要细胞因子[15]。IL-4是抑制单核细胞向巨噬细胞和粒细胞分化的细胞因子,从而引导单核细胞向DC方向分化,GM-CSF是促进DC存活及分化的最有效的细胞因子[16-20]。DCs形态不规则,表面许多膜状或树突状突起,细胞表面有特征性标志分子,如CD80、CD86,CD152,CD83[21-22]。目前猪源的DC特征性标记分子还不明确,人们现在最常用的标记分子是CD86、CD80、CD152、CD83等[22-23]。在本研究前期实验中,我们选取了一些人源和鼠源的CD86、CD83和CD152抗体,在分化成熟后进行流式检测,发现只有人源的CD152抗体能检测到DC的分化情况,这与其他一些实验者的数据不一致[24-25],我们推测可能是由于猪的品种以及选择的流式抗体来源不同造成的。在本实验中我们对外周血来源和骨髓来源单核细胞分化DC的条件进行了摸索探究,以期找到能更好的分化DC的方法。在实验初期,采用外周血来源的单核细胞对刺激浓度及刺激时间进行摸索同时观察细胞的形态,细胞形态随刺激时间的延长逐渐变大,表面有树突状突起,且在前期成团,后期呈单一分布并半悬浮于培养基中生长。对猪只日龄和刺激浓度的比较发现,15日龄猪只的PBMC在经过7 d连续刺激且刺激物GM-CSF的浓度为80 ng/mL和IL-4的浓度为40 ng/mL时获得较大比例的DC,这与Park[23]的实验结果不一致,我们推测可能与猪的品种有关。随后我们参照外周血来源单核细胞分化DC的方法,建立了骨髓源单核细胞分化DC方法。对这两种方法进行比较发现骨髓源单核细胞分化DC的方法获得的DC较为纯净(未展示),阳性细胞数量达到63%以上且更适合用于后续实验的进行,而外周血来源单核细胞分化DC的方法不确定因素太多,实验结果的重复性稍差。
本实验通过对两种DC分化方法的摸索与比较,建立了外周血来源DC和骨髓源DC分化方法,为进一步研究病毒感染后猪体建立获得性免疫应答的机制奠定了平台基础。
