适用于Nimble Cloning系统的pCambia载体改造
2019-05-30曾妍静沈文涛庹德财黎小瑛
曾妍静,沈文涛,庹德财,黎小瑛,言 普*,周 鹏*
(1.海南大学热带农林学院,中国海南海口570228;2.中国热带农业科学院热带生物技术研究所,中国海南海口571101)
DNA分子克隆技术是在分子生物学研究中广泛使用的基础技术[1]。目前,常用的酶切连接克隆、Gateway克隆、Gibson克隆等方法存在受限位点多或价格昂贵等问题[2~5]。因此,本实验室开发了一种新的简单快速的克隆方法,命名为Nimble Cloning。该技术的核心是在目标载体的克隆位点处设计Sfi I-ccdB-Sfi I结构(NC克隆框),这样与此结构侧翼具有20 bp左右重叠序列(接头)的目标DNA在Nimble Mix反应液作用下可直接与环状质粒完成克隆反应[6]。根据Nimble Cloning的工作原理,将现有表达载体改造为该系统配套的载体,只需要将NC克隆框插入到克隆位点处即可,并且改造一次可永久使用。但Sfi I为Nimble Cloning系统的受限位点,如果载体中含有Sfi I位点,需要将Sfi I位点突变去除。
在植物学研究领域常用的表达载体包括瞬时表达载体和双元表达载体(含T-DNA)[7]。我们分析发现植物瞬时表达载体不含Sfi I位点,常用的植物双元表达载体中,pGreen系列不含Sfi I位点,而pCambia系列含有5个Sfi I位点[8~9],改造难度相对较大。因此,本项目试图从pCambia系列载体入手,将它们改造为Nimble Cloning系统的载体,解决Nimble Cloning系统中载体改造的最大障碍。
由于pCambia系列载体的5个Sfi I位点均位于STA(stabilization)和replication origin区域,与质粒在农杆菌的稳定性和复制有关,所以需要分析对载体的改造是否影响其在农杆菌中的稳定性。本实验通过多次传代,利用菌液PCR鉴定改造质粒是否能在农杆菌中稳定存在,并且使用Nimble Cloning的方法在改造后的载体中插入GFP(green fluorescent protein)基因,再使用农杆菌注射法在本氏烟草叶片中瞬时表达,研究5个Sfi I位点的突变是否对基因表达产生影响。
1 材料与方法
1.1 材料
1.1.1 菌株及载体
实验中所使用的大肠杆菌感受态细胞Trans5α和DB3.1购自北京全式金生物技术有限公司。农杆菌感受态细胞GV3101和pCambia1304质粒由实验室自备。
1.1.2 供试植物
野生型本氏烟草(Nicotiana benthamiana)种植于25℃温室,用于农杆菌注射的瞬时表达研究。
1.1.3 主要试剂
高保真DNA聚合酶PrimeSTAR Max Premix、phusion酶、普通 Taq酶Premix Taq(Taq version 2.0)、琼脂糖凝胶回收试剂盒、质粒DNA小量提取试剂盒购自TaKaRa公司(日本);SfiⅠ限制性内切酶购自NEB公司(美国);Nimble Cloning反应液购自海南壹田生物科技有限公司。
1.2 方法
1.2.1 引物设计
SfiⅠ酶切位点识别序列是GGCCNNNNNGGCC。利用Verctor NTI Advance软件分析发现pCambia1304载体上有5个SfiⅠ酶切位点,分别位于 3 623、4 057、4 066、5 332、5 644 这 5 个位置。通过碱基替换突变去除SfiⅠ酶切位点的方法在这5个位置上设计上下游引物(表1)。引物合成由英潍捷基(上海)贸易有限公司完成。
1.2.2 片段扩增
以本实验室保存的pCambia1304质粒为模板,利用phusion酶,分别用引物对M1Sfi I F、M2Sfi I R和引物对M2Sfi I F、M3Sfi I R以及引物对 M3Sfi I F、M4Sfi I R进行 PCR,扩增目的DNA 片段 M1、M2、M3。PCR 反应体系为 50 μL:25 μL phusion 酶,上、下游引物各 1 μL,0.2 μL pCambia1304质粒,22.8 μL ddH2O。PCR 反应程序:98℃预变性30 s;[98℃变性8 s,55℃退火25 s,72℃延伸25 s]×30个循环;72℃终延伸10 min。PCR产物经1%的琼脂糖凝胶电泳检测后,使用凝胶回收试剂盒对目的片段M1、M2、M3进行胶回收。

表1 引物列表Table 1 Primer sequences
1.2.3 pCambia1304的位点突变
将回收的3个不含SfiⅠ酶切位点的片段M1、M2、M3 与原始 pCambia1304 混合,利用Nimble Cloning技术使3个片段克隆到pCambia1304并替换相应的含有Sfi I位点的片段(图1)。反应体系为3个片段各20 ng,pCambia1304原始载体 50 ng,Nimble Mix 5 μL,共 10 μL 反应体系,50℃反应1 h。将反应产物转化大肠杆菌感受态细胞Trans5α,然后挑取单菌落进行菌液PCR鉴定,把PCR初步鉴定为阳性克隆的菌液送往英潍捷基(上海)贸易有限公司,使用表1中的引物进行进一步测序验证。对于测序结果正确的5个SfiⅠ位点均突变的载体,我们将其命名为pMCambia1304。
1.2.4 pMCambia1304在农杆菌中的稳定性
通过电击转化农杆菌的方法,将质粒pMCambia1304转化至农杆菌感受态细胞GV3101中,涂布于含卡那霉素和利福平的LB平板上,28℃培养两天。从平板上随机挑取8个单菌落进行菌液PCR鉴定,挑出阳性克隆,划线传代5次并做菌液PCR鉴定,分析pMCambia1304在农杆菌中的稳定性。
1.2.5 pMCambia1304在植物中的表达
分析pMCambia1304质粒的序列,在NcoⅠ和PmlⅠ这两个酶切位点的位置,分别设计上、下游引物MCa-NC F和MCa-NC R(表1),引物的序列由Nimble Cloning配套的通用接头序列和与pMCambia1304质粒有20 bp重叠的重叠序列组成,使用Nimble Cloning配套的NC克隆框片段为模板,PCR扩增MCa-NC片段,再经电泳回收。使用NcoⅠ酶和PmlⅠ酶对pMCambia1304质粒进行酶切,并通过Pre-Nimble Mix将MCa-NC片段与酶切后的pMCambia1304片段进行拼接,从而把NC克隆框插入pMCambia1304质粒中。将连接产物转化大肠杆菌感受态细胞DB3.1,然后进行菌液PCR鉴定以及测序分析,序列正确的质粒命名为pNC-Cam1304-35S。利用GFP-NC F和GFPNC R(表1)扩增GFP基因,获得的GFP片段与pNC-Cam1304-35S混合,使用Nimble Cloning技术将GFP基因片段克隆到pNC-Cam1304-35S中。Nimble Cloning反应体系:2 μL GFP片段,3 μL pNC-Cam1304-35S质粒,5 μL Nimble Cloning反应液,50℃,1 h。重组质粒pNC-Cam1304-35SGFP经测序验证后转化到农杆菌感受态细胞GV3101中待用。使用NcoⅠ和PmlⅠ对原始pCambia1304质粒进行酶切,并通过Pre-Nimble Mix将GFP片段与酶切后的pCambia1304进行拼接,转化大肠杆菌后,经鉴定获得pCambia1304-35S-GFP质粒,再将其转入农杆菌感受态细胞GV3101中待用。使用农杆菌注射接种的方法[10]分别将pNC-Cam1304-35S-GFP和pCambia1304-35S-GFP注射本氏烟草的叶片,2~3 d后利用荧光显微镜检测表达。
1.2.6 其他pCambia系列载体的SfiⅠ位点突变
将其他pCambia系列载体改造成适用于Nimble Cloning系统的载体,只需使用引物对M1Sfi I F、M4Sfi I R,以 pMCambia1304 为模板,扩增突变后的片段,再将需要改造的载体与突变后的片段混合,使用Nimble Mix便能将突变后的片段与Sfi I位点的片段互换,得到不含Sfi I位点的载体。
2 结果与分析
2.1 pCambia1304的位点突变
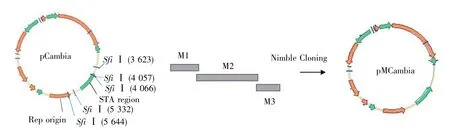
图1 pCambia1304的Sfi I位点突变示意图Fig.1 Schematic diagram of Sfi I mutation in pCambia1304
使用引物对M1Sfi I F、M2Sfi I R和引物对M2Sfi I F、M3Sfi I R 以及引物对 M3Sfi I F、M4Sfi I R扩增的3个不含SfiⅠ位点的片段的长度分别为 M1:471 bp、M2:1 295 bp、M3:343 bp,进行琼脂糖凝胶电泳检测后,能够在对应的位置得到目的条带(图2A)。通过Nimble Cloning技术将片段M1、M2、M3 与原始 pCambia1304 中含 SfiⅠ位点的相应片段进行替换,再转入大肠杆菌中,随机挑取6个单菌落进行初步的菌液PCR鉴定,鉴定出5个阳性克隆(图2B)。从这5个阳性克隆中挑取1个对其改造区域进行测序鉴定,并与原始pCambia1304的序列进行比对分析,结果显示在原先SfiⅠ酶切位点的位置各有一个碱基突变,表明pCambia1304中的5个SfiⅠ酶切位点已成功突变。

图2 pMCambia1304载体构建和鉴定的电泳结果(A)不含SfiⅠ位点的M1、M2、M3片段的扩增结果;(B)大肠杆菌菌液PCR鉴定。M:DNA marker DL2000;泳道1~6:随机挑取的6个单菌落的鉴定结果。Fig.2 Construction and identification of pMCambia1304 plasmid(A)Amplification result of M1,M2,and M3 fragments without SfiⅠlocus;(B)PCR identification with E.coli solution.M:DNA marker DL2000;Lanes 1~6:Six randomly selected single colonies.
2.2 pMCambia1304稳定性分析
将质粒pMCambia1304转化至农杆菌中,传代5次,使用引物对M1Sfi I F、M2Sfi I R进行菌液PCR,鉴定该质粒在农杆菌中能否稳定存在。PCR电泳结果显示鉴定的8个菌落中均有目标条带(图3),表明质粒pMCambia1304能够在农杆菌中稳定存在,5个Sfi I位点的突变对质粒在农杆菌中的稳定性和复制没有影响。
2.3 pMCambia1304的表达情况分析
在pMCambia1304质粒中插入NC克隆框,得到pNC-Cam1304-35S质粒。使用Nimble Cloning的方法将GFP基因片段插入pNC-Cam1304-35S中,获得pNC-Cam1304-35S-GFP,再通过农杆菌注射接种烟草,以未突变的pCambia1304-35S-GFP作为对照,通过荧光显微镜观测GFP的表达情况。研究结果如图4,pNC-Cam1304-35SGFP和pCambia1304-35S-GFP均有较强的荧光表达,且两者间没有明显区别,表明pCambia1304载体中5个Sfi I位点的突变对其介导的基因在植物中的表达没有影响。

图3 pMCambia1304质粒在农杆菌中的菌液PCR鉴定结果M:DNA marker DL2000;泳道1~8:随机挑取的8个单菌落的鉴定结果;+、-:正、负对照。Fig.3 PCR identification of pMCambia1304 plasmid in AgrobacteriumM:DNA marker DL2000;Lanes 1~8:Eight randomly selected single colonies;+and-:The positive and negative controls.
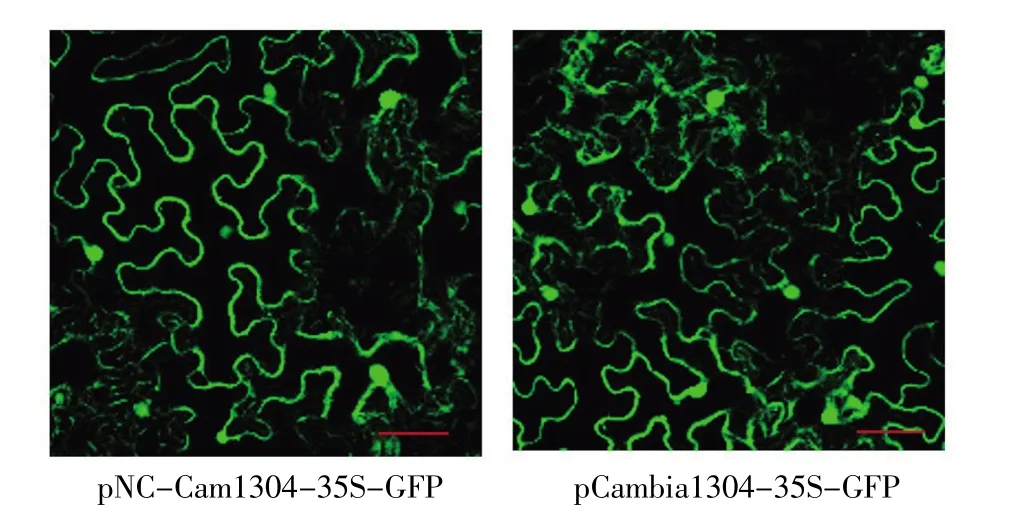
图4 pNC-Cam1304-35S-GFP和pCambia1304-35SGFP 的表达情况(标尺:50 μm)Fig.4 ExpressionofpNC-Cam1304-35S-GFPandpCambia1304-35S-GFP(scale bar:50 μm)
2.4 其他pCambia系列载体的Sfi I位点突变
将其他pCambia系列载体改造成适用于Nimble Cloning系统的载体,只需使用引物对M1Sfi I F、M4Sfi I R,以 pMCambia1304 为模板,扩增突变后的片段,再将需要改造的载体与突变后的片段混合,使用Nimble Cloning将突变后的片段与Sfi I位点的片段互换,即可得到不含Sfi I位点的改造后载体(图5)。本研究以pCambia2301为例,将pCambia2301与突变后的片段混合,进行Nimble Cloning反应,然后在转化后的平板中挑选6个单菌落进行测序鉴定,结果显示6个菌落的Sfi I位点均成功突变,表明该方法用于pCambia系列载体改造具有高效性。

图5 其他pCambia系列载体的Sfi I位点突变原理图Fig.5 Schematic diagram of other pCambia series plasmids with Sfi I locus mutation
3 讨论
Nimble Cloning是一种新型的DNA分子克隆技术,但目前该克隆技术的配套载体较少。将现有表达载体改造为该技术配套的载体,只需要将NC克隆框插入到克隆位点处即可,但如果载体中含有SfiⅠ位点,需要先将SfiⅠ位点突变去除。植物双元表达载体pCambia系列的载体骨架含有5个SfiⅠ位点,是改造难度最大的一类载体。本研究成功将pCambia1304中的5个SfiⅠ位点进行了突变,并发现5个SfiⅠ位点突变不影响载体在农杆菌中的复制和稳定性以及在植物中的表达,为Nimble Cloning系统的配套载体改造清除了一大障碍。以突变后的载体pMCambia1304为模板,可以方便地扩增获得含5个SfiⅠ突变位点的片段,将该片段与pCambia系列载体混合,再利用Nimble Cloning反应即可快速方便地获得突变后的pCambia系列载体(图5)。因此,本研究为其他pCambia系列载体改造成Nimble Cloning系统载体提供了模板和参考。
此外,本研究通过农杆菌注射烟草瞬时表达GFP发现,改造后的载体pMCambia1304不影响基因的表达。该过程中GFP基因是通过Nimble Cloning技术直接克隆到配套载体pNC-Cam1304-35S中,克隆反应中质粒pNC-Cam1304-35S不需要先酶切线性化处理,而是直接使用环状载体,反应过程简单、快速,为Nimble Cloning技术的应用提供了一个实例。
