斑马鱼TANK基因的克隆及功能初探
2019-05-30张音音
张音音,晏 俊,彭 俊,冯 浩,肖 军*
(1.省部共建淡水鱼类发育生物学国家重点实验室,中国湖南长沙410081;2.湖南师范大学生命科学学院,中国湖南长沙410081)
脊椎动物的免疫系统分为两类:天然免疫与获得性免疫。其中天然免疫又称非特异性免疫,是宿主抵御病原微生物的第一道防线,同时也是鱼类抗病的主要防御机制。天然免疫在脊椎动物抵御外界不利条件如病毒和细菌类病原微生物的入侵时发挥着非常重要的作用[1~3]。天然免疫系统通过模式识别受体(pattern-recognition receptors,PRRs)识别保守的病原相关分子模式(pathogen-as sociated molecular patterns,PAMPs),为宿主抵御微生物入侵提供关键的防御[4~7]。入侵病原体被PRRs识别后,通过下游信号通路诱导干扰素(interferon,IFN)和干扰素刺激基因(interferon stimulated genes,ISGs)表达,进而触发天然免疫应答。模式识别受体主要包括Toll样受体(Toll-like receptors,TLRs)、RIG-Ⅰ样受体(RIG-Ⅰ-like receptors,RLRs)、核苷酸寡聚域样受体(nucleotide oligomerization domainlike receptors,NLRs)[8~9]。其中,RIG-Ⅰ样受体是宿主细胞内识别RNA病毒的核心受体,其介导的RLR抗病毒信号通路是宿主细胞识别RNA病毒并引发抗病毒天然免疫反应的关键信号通路,是目前鱼类抗病毒研究的热点[10]。RLR家族包括视黄酸诱导基因蛋白Ⅰ(retinoic acid-inducible geneⅠ,RIG-Ⅰ)、黑色素瘤分化基因5(melanoma differentiation-associated gene 5,MDA5)、遗传学和生理学实验室蛋白2(laboratory of genetics and physiology 2,LGP2),这3个RLR成员结构相似,都具有中心的DExD/H-box解旋酶域和C端调控域(RD)[11]。此外,RIG-Ⅰ和MDA5的N端还具有2个CARD结构域,在被病原分子激活后,可与线粒体上的线粒体抗病毒信号蛋白(mitochondrial antiviral-signaling protein,MAVS)N端CARD 结构域发生相互作用[12~13],激活MAVS并使其发生多聚化,进而募集下游的干扰素基因刺激物(stimulator of interferon genes,STING)、肿瘤坏死因子受体相关因子(TNF receptor-associated factor,TRAF)家族成员(TRAF2、TRAF3和TRAF6)等接头分子。TRAF家族成员蛋白继续募集并诱导TANK结合激酶1(TANK-binding kinase 1,TBK1)、抑制性 κB 激酶(inhibitor of nuclear factor kappa-B kinase,IKK)α/β和γ等活化。这些激酶进而活化核因子κB(nuclear factor kappa-B,NF-κB)和干扰素调节因子3/7(interferon regulatory factor 3/7,IRF3/7),使其转移到细胞核,激活促炎症因子与IFN的表达[14~16]。
TANK是在对TRAF2的相互作用蛋白质进行研究时,分离出的一种新的蛋白质[17]。有研究报道,在哺乳动物中过表达TRAF2时,TANK能激活NF-κB信号通路[18],但亦有研究显示TANK能负调控 TNF-α、IL-1 和 CD40介导的 NF-κB 活化[17],这表明TANK蛋白对NF-κB通路的影响具有双重作用。TBK1、TANK和TRAF2可以形成一个三元复合物,从而激活TBK1,活化的TBK1抑制TANK介导的NF-κB激活,但不阻断由TNF-α、IL-1或CD40介导的激活[19]。此外,TANK还可以与RLRs信号通路中多个调控分子如MAVS、β干扰素TIR结构域衔接蛋白(TIR-domain-containing adapterinducing interferon-β,TRIF)、TRAF3 以及转录调控因子IRF3发生相互作用,调控IRF3的磷酸化并诱导IFN的产生[20]。最近的研究表明,LPS、poly(I:C)和病毒刺激可显著增强青鱼TANK(black carp TANK,bcTANK)诱导干扰素启动子的表达活性,并且在EPC细胞中过表达bcTANK能显著增强其抗病毒能力,表明bcTANK在宿主抗病毒天然免疫反应中具有重要作用[21]。但TANK在其他硬骨鱼类中是否具有类似的功能,仍有待进一步研究。
本文以模式动物斑马鱼为研究对象,首次克隆并获得了斑马鱼TANK(DrTANK)编码区(coding sequence,CDS)序列并对其功能进行了初探,证实了DrTANK为一种胞质蛋白,并且poly(I:C)和GCRV刺激可显著增强DrTANK诱导干扰素启动子的表达活性,表明了DrTANK在斑马鱼抗病毒天然免疫反应中具有重要作用,为后续TANK在硬骨鱼抗病毒天然免疫中的功能研究奠定了基础。
1 材料与方法
1.1 实验鱼
本文中所用的斑马鱼(野生型,AB系)购自于国家斑马鱼资源中心(武汉),饲养在位于湖南师范大学校内的“教育部多倍体鱼繁殖与育种技术工程研究中心”。
1.2 仪器与试剂
PCR仪(Mastercycler nexus gradient,德国 Eppendorf公司);高速冷冻离心机(5804R,德国Eppendorf公司);电泳仪(DYY-6C,北京六一仪器厂);转膜仪(Trans-Blot SD Cell,美国Bio-Rad公司);CO2细胞培养箱(371型,美国Thermo公司);倒置相差显微镜(DMI3000B,瑞士LEICA公司);激光共聚焦显微镜(FV1200,日本Olympus公司)。逆转录试剂盒(Thermo公司,美国);抗Flag鼠单克隆抗体(Sigma公司,美国);羊抗鼠IgG(Sigma公司,美国);Alexa 488偶联二抗(Invitrogen公司,美国);poly(I:C)(sigma公司,美国);双荧光素酶报告检测试剂盒(Promega公司,美国);胎牛血清(BI公司,以色列);Triton-x-100(BBI生命科学有限公司)等。
1.3 细胞和质粒
实验中所用到的HEK293T细胞(293T)、EPC(epithelioma papulosum cyprini)细胞和CIK(Ctenopharyngodon idella kidney)细胞均为实验室自有细胞[22]。所有的细胞系均用含有10%胎牛血清(fetal bovine serum,FBS)、2 mmol/L 谷酰胺、100 mg/L 青霉素、100 mg/L链霉素的DMEM培养。其中,HEK293T细胞培养在 37℃、5%CO2培养箱;EPC、CIK细胞培养在26℃、5%CO2培养箱。
实验中所用到的质粒pcDNA5/FRT/TO、pRLTK、Luci-DrIFNφ1、Luci-DrIFNφ3、Luci-eIFN[21]为实验室自有质粒。DrTANK重组载体pcDNA5/FRT/TO-DrTANK-Flag是在克隆获得DrTANK开放阅读框(open reading frame,ORF)序列后,通过HindⅢ和XhoⅠ双酶切,将DrTANK编码区序列插入到C端带有Flag标签的pcDNA5/FRT/TO中获得。
1.4 DrTANK编码区的克隆及序列比对分析
采用Trizol法从斑马鱼的肾脏组织提取RNA后,使用逆转录试剂盒合成cDNA第一链,然后根据NCBI上已有的斑马鱼TANK预测序列设计引物(表1),通过聚合酶链式反应(polymerase chain reaction,PCR)对斑马鱼TANK的ORF进行扩增。将获得的PCR产物连接到C端带有Flag标签的pcDNA5/FRT/TO表达载体上,测序获得DrTANK序列信息,并利用MEGA 6.0程序和GeneDoc程序将DrTANK与其他脊椎动物的氨基酸序列进行比对分析,构建系统进化树。
1.5 病毒的生产及病毒滴度的测定
实验中所用到的草鱼呼肠孤病毒(grass carp reovirus,GCRV)为华中农业大学张永安教授馈赠,病毒株型号为GCRV106。制备病毒时,将低感染复数(multiplicity of infection,MOI)的 GCRV 病毒加到用含有2%FBS培养基培养的CIK细胞中,2~3 d后,收集含病毒的上清液储存在-80℃冰箱。病毒滴度测定采用文献[23]报道的方法,简要步骤如下:首先将收集的病毒上清液三冻三融,再将依次稀释10倍(10-1~10-7)的病毒加到EPC细胞中,孵育2 h后用含有2%FBS和0.75%的甲基纤维素培养基换液,3 d后观察并计数病毒斑,计算病毒滴度。
1.6 免疫印迹
将EPC细胞和HEK293T细胞接种到6孔板中,每孔分别转染3 000 ng的pcDNA5/FRT/TODrTANK-Flag,对照组转染等量的pcDNA5/FRT/TO质粒,48 h后收集细胞,3 000 r/min离心3 min,去上清液,加入等体积的PBS(phosphate buffered saline)和 2× SDS loading buffer,沸水中煮 20 min。用10%SDS-PAGE分离细胞裂解液;恒压半湿法转膜;5%的脱脂牛奶封闭1~2 h;随后加一抗(抗Flag的鼠单克隆抗体,1︰3 000)4℃孵育过夜,TBST(Tris-buffered saline and Tween-20)清洗 4遍,每次8 min;再加二抗(羊抗鼠IgG,1︰30 000)室温孵育1 h,TBST清洗4遍,每次8 min;最后用碱性磷酸酶显色。
1.7 免疫荧光
将EPC细胞接种到24孔板中,每孔转染500 ng的 pcDNA5/FRT/TO-DrTANK-Flag。24 h后,吸去上清,PBS清洗,用4%的多聚甲醛固定15 min,PBS清洗;0.2%Triton-x-100穿透 15 min,PBS清洗;10%FBS(PBS+胎牛血清)封闭1 h,PBS清洗;加一抗(抗Flag的鼠单克隆抗体,1︰300)孵育1 h,PBS清洗6遍,每次8 min;加二抗(Alexa 488偶联二抗,1︰1 000)孵育1 h,PBS清洗6遍,每次8 min;封片。晾干后利用激光共聚焦显微镜拍照,也可置于-20℃避光环境下保存数天后拍照。
1.8 双荧光素酶报告基因实验
将用于双荧光素酶报告基因实验的EPC细胞接种在24孔板中,待细胞到达80%左右密度时,进行转染。在检测DrTANK能否诱导干扰素产生的实验中,共转 pRL-TK(25 ng)、Luci-DrIFNφ1/Luci-DrIFNφ3(250 ng)、空载体或 pcDNA5/FRT/TO-DrTANK-Flag(50/100/200 ng);在检测poly(I:C)或者GCRV刺激是否会影响DrTANK诱导干扰素产生能力的实验中,共转pRL-TK(25 ng)、Luci-DrIFNφ1(250 ng)、空载体或 pcDNA5/FRT/TO-Dr-TANK-Flag(50/100/200 ng),并用浓度为50 mg/L的 poly(I:C)或者 MOI为 0.1的 GCRV处理 2 h。每个孔转染的质粒总量为475 ng,当转染的质粒质量不足475 ng时,则用空载体补足到475 ng。转染24 h后,用细胞裂解液(passive lysis buffer,PLB)裂解细胞,振荡15 min,用酶标仪测定荧光素酶活性。

表1 PCR引物序列Table 1 Primers used in PCR
1.9 统计学处理
荧光素酶报告基因测定结果和病毒滴度测量结果中的所有数据均来自3个独立重复实验。误差线表示3个独立实验的平均值的标准差,星号(*)代表P<0.05。数据分析采用双尾t检测。
2 结果
2.1 DrTANK基因的克隆和序列分析
为了探究DrTANK在斑马鱼天然免疫中的功能,我们从斑马鱼的肾脏组织中克隆出了其TANK CDS区序列(NCBI序列号:MK715455)。结果显示,DrTANK CDS由1 047个核苷酸组成,编码349个氨基酸残基,预测的相对分子质量为39.27 kD,等电点为5.64(http://web.expasy.org/protparam/)。为了研究TANK的进化关系,将DrTANK氨基酸序列与人、小鼠和火鸡的TANK氨基酸序列进行多重比对,发现DrTANK N端的氨基酸序列相对保守(图1)。同时,从选定的物种中系统分析TANK氨基酸序列的同源性(图2),结果显示DrTANK与青鱼TANK的氨基酸相似性最高,表明这两个物种在进化上的遗传关系较近 (74.9%,表2)。
2.2 DrTANK蛋白的表达
为后续研究DrTANK的功能,我们构建了DrTANK表达载体并将其转染到HEK293T和EPC细胞中,观察DrTANK蛋白的表达(以β-actin作为内参)。免疫印迹实验显示,在哺乳动物细胞和鱼类细胞中,pcDNA5/FRT/TO-DrTANK-Flag均能正确表达DrTANK蛋白(图3)。
2.3 DrTANK在细胞内的定位
在之前的研究中,我们已经证实了青鱼的TANK为胞质蛋白[21]。为了检测DrTANK在细胞内的分布情况,我们在EPC细胞中过表达Dr-TANK后进行免疫荧光染色,发现DrTANK表达区域(绿色)包围细胞核(蓝色)(图 4),表明 Dr-TANK也是一种胞质蛋白。

图1 DrTANK的同源比对利用MEGA 6.0程序和GeneDoc程序将斑马鱼与其他脊椎动物的TANK氨基酸序列进行比较,图片中颜色深浅代表同源性强弱,颜色越深表示该位点同源性越高。Fig.1 Homology comparison of the DrTANKThe DrTANK amino acid sequence was compared with those of other vertebrate TANKs by using MEGA 6.0 program and Gene-Doc program.The shades in the picture represent the homology between different species,the darker the color,the higher the homology of this locus.
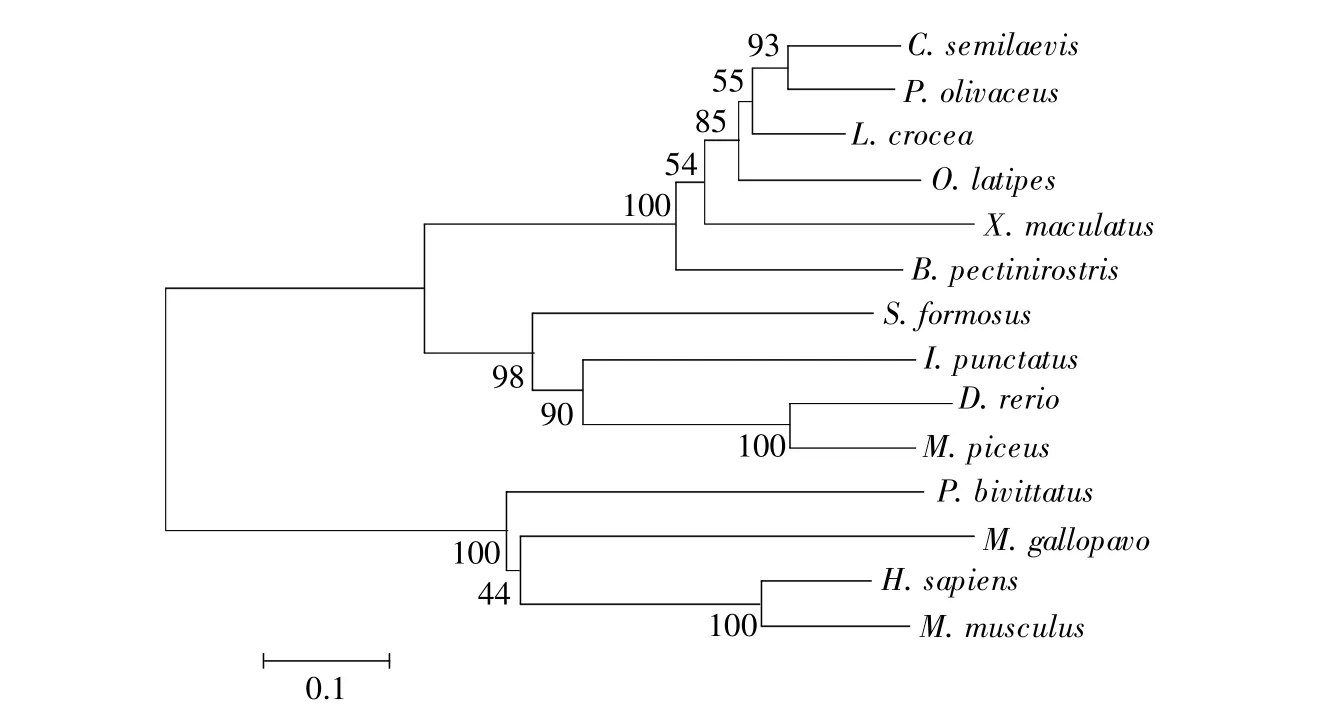
图2 DrTANK的进化分析利用MEGA 6.0软件将DrTANK与不同物种的TANK进行氨基酸序列比对。这些物种包括Cynoglossus semilaevis(XP_008-326921)、Paralichthys olivaceus(NW_017859656.1)、Larimichthys crocea(XP_010730520)、Oryzias latipes(XP_004081941)、Xiphophorus maculatus(XP_005805397)、Boleophthalmus pectinirostris(XP_020784622)、Scleropages formosus(XP_018597007)、Ictalurus punctatus(XP_017325567)、Mylopharyngodon piceus(MG462752)、Meleagris gallopavo(XP_010711971)、Python bivittatus(XP_007427628)、Homo sapiens(NP_004171)、Mus musculus(NP_035659)。Fig.2 Evolution analysis of the zerbrafish TANKBy using MEGA 6.0 software,the amino acid sequence of the zerbrafish TANK was aligned with those of TANKs from different species,including(GenBank accession number)Cynoglossus semilaevis(XP_008326921),Paralichthys olivaceus(NW_0178-59656.1),Larimichthys crocea(XP_010730520),Oryzias latipes(XP_004081941),Xiphophorus maculatus(XP_005805397),Boleophthalmus pectinirostris(XP_020784622),Scleropages formosus(XP_018597007),Ictalurus punctatus(XP_017325567),Mylopharyngodon piceus(MG462752),Meleagris gallopavo(XP_010711971),Python bivittatus(XP_007427628),Homo sapiens(NP_004171),Mus musculus(NP_035659).
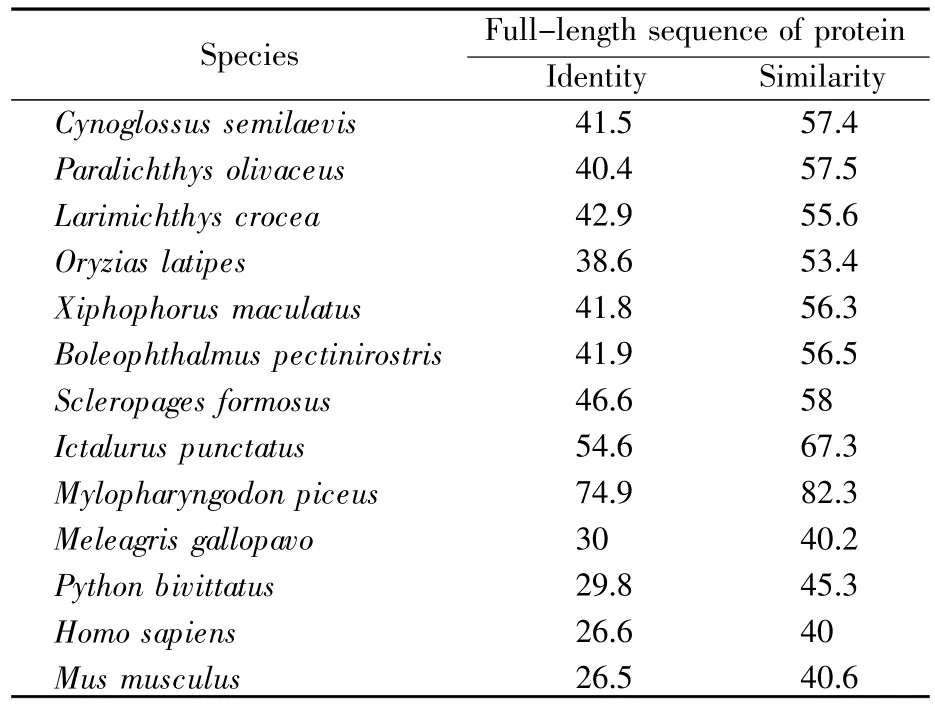
表2 DrTANK与其他脊椎动物TANK的比较(%)Table 2 Comparison of the DrTANK with other vertebrate TANKs(%)
2.4 DrTANK对干扰素的诱导活性
为研究DrTANK在干扰素产生过程中的作用,我们在EPC细胞中过表达DrTANK,并用双荧光素酶报告系统分析DrTANK是否能诱导斑马鱼干扰素启动子1/3(DrIFNφ1/3)的表达。结果显示,在EPC细胞中过表达斑马鱼TANK不上调或者仅能微弱上调DrIFNφ1/3启动子表达活性(图5A,B)。当用ploy(I:C)和GCRV刺激上述过表达DrTANK的EPC细胞时,DrIFNφ1双荧光素酶报告实验结果显示,在上述刺激下,DrTANK诱导干扰素表达的能力明显增强(图5C,D),这些结果表明DrTANK在斑马鱼抗病毒天然免疫反应中具有重要作用。
3 讨论

图3 DrTANK蛋白的表达分析(A)EPC细胞中的免疫印迹分析;(B)HEK293T细胞中的免疫印迹分析。Ctr:转染空载体的EPC细胞或HEK293T细胞,Dr-TANK-Flag:转染pcDNA5/FRT/TO-DrTANK-Flag表达载体的细胞。Fig.3 Protein expression of DrTANK(A)Immunoblot assay of EPC cells;(B)Immunoblot assay of HEK293T cells.Ctr:EPC cells or HEK293T cells transfected with empty vector;DrTANK-Flag:Cells transfected with pcDNA5/FRT/TO-DrTANK-Flag.

图4 DrTANK蛋白在细胞内的定位EPC细胞免疫荧光染色。(A)视野中绿色区域是DrTANK蛋白表达区域;(B)视野中蓝色区域是细胞核所在区域;(C)A图与B图的融合;(D)C图方框圈定区域的放大图。TANK-Flag:pcDNA5/FRT/TO-DrTANK-Flag。Fig.4 Intracellular localization of DrTANKImmunofluorescence staining of EPC cells.(A)The green represents the expression region of DrTANK;(B)The blue represents the region where the nucleus is located;(C)The fusion of A and B;(D)A larger view of the area boxed in Figure C.TANK-Flag:pcDNA5/FRT/TO-DrTANK-Flag.
斑马鱼(Danio rerio)是一种重要的模式动物,其作为研究脊椎动物发育和造血的模型已被广泛用于生物医学研究。近年来,斑马鱼亦被广泛应用于免疫学领域。受精后,由于斑马鱼适应性免疫系统需要4~6周后才能在形态和功能上成熟,所以其幼苗中仅存在天然免疫系统,这为脊椎动物天然免疫研究提供了良好的模型[24]。天然免疫是保障机体不受外来病原体入侵的一道重要防线,当病原体入侵时,体内会产生一系列的级联反应,并最终诱导Ⅰ型干扰素产生。Ⅰ型干扰素被很多转录因子调控,如干扰素调节因子IRF3、NF-κB和ATF-1-c-Jun等[25]。TRAF家族蛋白 (TRAF1~TRAF7)在调节免疫应答、NF-κB和凋亡信号通路中发挥着重要作用[26],TANK可以抑制依赖于不同TRAF信号传导的TBK1非依赖性途径(例如TNF-α和IL-1),并且可以以TBK1依赖性方式与TRAF2、5和6协同激活NF-κB[27]。TANK与MCPIP1/USP10形成的复合物能介导TRAF6的去泛素化,并负向调控由于DNA损伤诱导的NF-κB信号通路的级联反应[28]。在TLRs的信号通路中,TANK能与TBK1和IKKε相互作用,磷酸化IRF3/7和上调Ⅰ型干扰素的表达[29]。当用EMCV 3C蛋白酶裂解TANK时,TANK-TBK1-IKKε-IRF3复合体被破坏,从而抑制IRF3的磷酸化和干扰素的表达[30]。以上信息说明TANK在诱导干扰素的表达过程中具有重要作用。
目前,鱼类中有关TANK功能研究的报道仅限于青鱼[21]。该研究发现脂多糖(lipopolysaccharide,LPS)、聚肌胞苷酸[poly(I:C)]、鲤春病毒血症病毒(spring viremia of carp virus,SVCV)和草鱼呼肠孤病毒(GCRV)刺激均可以上调青鱼细胞中TANK基因的转录水平,同时LPS、poly(I:C)和GCRV刺激可显著增强青鱼TANK激活干扰素的能力;另外在EPC细胞中过表达青鱼TANK可显著增强其抗病毒能力,该研究首次在硬骨鱼中报道了bc-TANK在宿主抗病毒天然免疫反应中具有重要作用。但在其他硬骨鱼中,TANK在天然免疫反应中的功能有待进一步研究。
在本文中,我们以模式动物斑马鱼为研究对象,对其TANK基因进行了克隆及功能初探。结果显示,TANK在陆生动物和水生动物中的同源性较低,推测可能与TANK在不同物种中的功能多样性有关。在免疫印迹实验中,DrTANK蛋白迁移约为50 kD,大于Expasy网站(http://web.expasy.org/protparam/)预测的值,我们猜想DrTANK可能在表达过程中发生了蛋白质修饰,比如磷酸化或SUMO化[29,31]。为了进一步阐明病毒感染介导的DrTANK基因诱导IFN的机制,我们对其在天然免疫抗病毒RLRs通路中的作用进行了探索。双荧光素酶报告实验结果显示,过表达DrTANK本身并不能诱导Ⅰ型IFN的产生,但是在病原(细菌或病毒)刺激下其诱导Ⅰ型IFN表达的能力增强,这与之前青鱼中的结果一致。这可能是因为在外界的刺激下,TANK会与体内的TBK1、IKKε和TRAF家族成员相互作用,诱导了干扰素的表达。总的来讲,本研究为证明TANK在硬骨鱼天然免疫中具有重要的功能提供了佐证,同时也为之后验证TANK在先天性免疫途径的作用,以及能否参与到其他信号转导途径中的研究奠定了基础。当然,有关DrTANK诱导干扰素产生的机制仍有待进一步研究。

图5 DrTANK诱导干扰素启动子表达的能力(A)在EPC细胞中,共转pRL-TK、Luci-DrIFNφ1、空载体或 pcDNA5/FRT/TO-DrTANK-Flag(50/100/200 ng),用双荧光素酶报告系统测定不同剂量DrTANK诱导DrIFNφ1启动子表达的能力;(B)在EPC细胞中,共转pRL-TK、Luci-DrIFNφ3、空载体或pcDNA5/FRT/TO-DrTANK-Flag(50/100/200 ng),用双荧光素酶报告系统测定DrTANK诱导DrIFNφ3启动子表达的能力;(C)将pRL-TK、Luci-DrIFNφ1、空载体或pcDNA5/FRT/TO-DrTANK-Flag(50/100/200 ng)共同转染EPC细胞,并用浓度为50 mg/L的poly(I:C)处理2 h,24 h后用双荧光素酶报告基因测定poly(I:C)刺激后DrTANK诱导DrIFNφ1启动子表达的能力;(D)将pRL-TK、Luci-DrIFNφ1、空载体或pcDNA5/FRT/TO-DrTANK-Flag(50/100/200 ng)共同转染EPC细胞,并用MOI=0.1的GCRV处理2 h,24 h后用双荧光素酶报告基因测定GCRV刺激后DrTANK诱导DrIFNφ1启动子表达的能力。误差线表示标准偏差,数据来自3次独立重复实验。误差线上方的数字代表IFN相对转录活性。Fig.5 IFN-inducing activity of DrTANK(A)In EPC cells,pRL-TK,Luci-DrIFNφ1,an empty vector or pcDNA5/FRT/TO-DrTANK-Flag(50/100/200 ng)were co-transfected and assayed using the dual luciferase reporter system to test the promoter activity of DrIFNφ1 induced by DrTANK;(B)In EPC cells,pRL-TK,Luci-DrIFNφ3,an empty vector or pcDNA5/FRT/TO-DrTANK-Flag(50/100/200 ng)were co-transfected and assayed using the dual luciferase reporter system to test the promoter activity of DrIFNφ3 induced by DrTANK;(C)EPC cells were co-transfected with pRL-TK,Luci-DrIFNφ1,an empty vector or pcDNA5/FRT/TO-DrTANK-Flag (50/100/200 ng)and treated with poly(I:C)at a concentration of 50 mg/L for 2 h.After 24 h,the promoter activity of DrIFNφ1 induced by DrTANK after poly(I:C)stimulation was assayed by the dual luciferase reporter system;(D)EPC cells were co-transfected with pRL-TK,Luci-DrIFNφ1,an empty vector or pcDNA5/FRT/TO-DrTANK-Flag(50/100/200 ng)and infected with GCRV at the MOI of 0.1 for 2 h.After 24 h,the promoter activity of DrIFNφ1 induced by DrTANK after GCRV infection was assayed by the dual luciferase reporter system.Error bars indicate standard deviation and data from 3 independent replicates.The number above the error bar represents IFN relative transcription activity.
