流感病毒影响大鼠胚胎心脏发育机制的初步探究
2019-05-30岳树盛向红群朱泽曙丁浩东范雄伟吴秀山莫小阳
岳树盛,史 艳,向红群,王 珩,朱泽曙,丁浩东,范雄伟,吴秀山,李 芳,莫小阳
(湖南师范大学生命科学学院心脏发育研究中心,中国湖南长沙410081)
先天性心脏病,简称先心病,是临床胎儿心血管发育异常、心功能不全而导致胎儿心脏或大血管畸形,甚至死亡的一类先天性疾病[1]。先心病发病率占新生儿的1%~2%,而患病婴儿的死亡率超过29%,因此先心病是影响儿童身心健康、家庭生活质量以及国家人口素质的重大科学和社会问题[2]。目前认为遗传因素、环境因素及其相互作用是先心病发生的主要原因[3]。现阶段,遗传因素导致先心病的分子机制已取得一定的进展[4~5],但环境因素致先心病的分子机制尚不明确。
诱发先心病的环境因素复杂多样,孕期宫内病毒感染、药物、化学污染、不良生活习惯及母体疾病(如高血压)等都会导致先心病的发生[6~10]。赖杰等[11]报道,1990—2000年重庆市先心病患儿与流感发病数呈正相关,且母体感染流感病毒与先天性心脏病(如室间隔缺损等)的发生相关[12~14]。人类胚胎心脏发育的第2~8周是先心病发生的重大风险时期,孕母体早期感染流感病毒后,胎儿出现心血管畸形的概率显著增加[15]。但流感病毒引发先心病的发病机制仍不清楚,探究流感病毒致先心病发生的分子机制对先心病预防和治疗具有重要的理论及临床意义。
为研究流感病毒对大鼠胚胎发育的影响,我们以SPF级F344大鼠品系为材料,建立了稳定的流感病毒H1N1感染的大鼠模型。随后,通过荧光定量PCR(quantitative reverse transcriptase polymerase chain reaction,qRT-PCR),检测了实验室前期筛选出的8个与心脏发育相关的基因(BMP4、FGF12、WWOX、NRG1、SHOX2、BCL2、DDR2 和 EPHB3)[16~24]在感染流感病毒的心脏组织中的表达。结果表明,BMP4、FGF12、WWOX、DDR2 和 EPHB3 基因的表达降低。本文可为探究流感病毒导致先心病发生的分子机制提供一定的理论基础,对先心病的预防和治疗具有重要的临床意义。
1 材料与方法
1.1 病毒和实验动物
1.1.1 病毒
本实验所用到的病毒株为流感病毒A/PR/8/34(H1N1),由湖南师范大学分子病毒实验室提供,密封保存于-80℃。用噬斑形成单位(plaque forming unit,PFU)法测定流感病毒滴度后按最适剂量攻毒。
1.1.2 实验动物
SPF级F344大鼠品系,三月龄,购自北京维通丽华实验动物技术有限公司。动物实验均在湖南师范大学SPF级动物房操作。
1.1.3 试剂和实验材料
RNA反转录试剂盒购自北京全式金生物技术有限公司,qRT-PCR试剂盒(TaKaRa)购自北京宝日医生物技术有限公司,异丙醇、无水乙醇均购自湖南汇虹试剂有限公司。荧光定量384孔反应板购自ABI生物有限公司。
1.2 方法
1.2.1 大鼠的怀孕检测
前一晚上8点,将大鼠按照雌雄1︰1的比例合笼,每12 h进行雌鼠阴道涂片检测,观察到雄鼠精子即为胚胎0.5 d。
1.2.2 大鼠攻毒及取材
在鼠胚胎心脏发育的初始阶段,即胚胎发育8.5 d(E8.5 d)时采用滴鼻法攻毒,攻毒地点在湖南师范大学动物房攻毒专用房间,大鼠孕鼠攻毒剂量为0.553×104PFU。取大鼠E13.5 d时期胚胎以及胚胎心脏进行形态学观测;取大鼠E11.5 d时期胚胎心脏保存于-80℃冰箱待RNA提取。此外,取大鼠E11.5 d时期的胚胎,统计每次解剖的胚胎数量,对照组和实验组的各孕母鼠样本数量均不少于3只。
1.2.3 荧光定量PCR
取大鼠胚胎11.5 d心脏组织,用TRIZOL裂解细胞,采用氯仿、异戊醇萃取RNA,随后用75%乙醇洗去杂质,再用RNA-Free water溶解。按照TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒(北京全式金生物技术有限公司)说明书的详细步骤,将mRNA反转录成cDNA文库。以得到的cDNA文库作为模板,按照TransStart Tip Green qPCR SuperMix(TaKaRa)说明书配制反应体系(表1),在Quanstudio 5(Ther-mo Fisher)仪器上按照标准的两步法运行Q-PCR。将正常样本用Ct值均一化(以 β-ACTIN作为管家基因进行校正)后,按照2-△△Ct法计算基因在攻毒样本中的表达量。文中所用到的引物序列详见表2。

表1 qRT-PCR各组分体积表Table 1 The component volumes in qRT-PCR
1.2.4 统计学分析
2 结果
2.1 流感病毒影响大鼠的胚胎发育
我们首先建立大鼠宫内感染流感病毒H1N1的模型,观察胚胎11.5 d、13.5 d的发育状况。结果显示,与正常对照相比,感染流感病毒后,胚胎都出现了发育滞缓现象(图1)。胚胎11.5 d时,尾部较长,颈部外曲圆小,耳和眼睛发育较迟(图1 B);胚胎13.5 d时,体形瘦小,四肢较短,后肢尤为明显,尾部稍长且鼻上颌未完全闭锁,脑部液体充盈,全身动脉血管发育不全,软骨化程度低,体内脂肪含量低导致整体较为通透,尤其是头、颈部(图1D)。此外,感染流感病毒后,大鼠的胚胎死亡率约为20%,且孕鼠均有流产迹象,表现为死胎增多,流产率加重(图1G)。以上结果说明,H1N1流感病毒感染大鼠孕鼠后,胚胎的发育受到抑制,甚至会造成胚胎的畸形或流产。
2.2 流感病毒影响大鼠胚胎的心脏发育
实验室前期研究表明流感病毒导致小鼠胚胎心脏的发育缺陷(数据待发表)。在本研究中,我们利用流感病毒感染的大鼠模型,探究流感病毒是否影响大鼠胚胎的心脏发育。结果显示,与正常组相比,攻毒孕鼠E13.5 d时期的胚胎心脏表现出左、右心房充血扩张,左、右心室缩小,右室流出道未完全向左倾斜,主动脉根部膨出等症状(图2)。这些与孕小鼠感染病毒后胚胎早期发育心脏的表型一致。以上结果表明H1N1流感病毒感染大鼠孕鼠可能影响其胚胎的心脏发育,导致胚胎心脏发育畸形。

表2 特异性qRT-PCR检测引物Table 2 Primers for specific qRT-PCR detection

图1 大鼠宫内感染流感病毒后的胚胎表型分析A,B:正常大鼠和攻毒大鼠E11.5 d胚胎形态图(白色箭头所指的是颈部外曲圆);C~F:正常大鼠和攻毒大鼠E13.5 d胚胎形态图(白色五角星指的是鼻上颌),E和F分别是C、D白色五角星处的放大图;G:大鼠在正常和攻毒条件下所取胚胎数量图,0表示孕鼠胚胎全部死亡。Control表示正常对照组;H1N1表示流感病毒感染组;数据以平均值±标准误差呈现;**,P<0.01;标尺=2 mm。Fig.1 The embryonic phenotype analysis of rats infected with influenza virus in uteroA and B:E11.5 d embryo morphology image of normal rats and influenza virus infected rats(white arrows refer to the outer curve of the neck);C~F:E13.5 d embryo morphology of normal and influenza virus infected rats(white pentagram refers to the upper maxilla).E and F are magnified views of white pentagram positions in C and D,respectively;G:The number of embryos taken under normal and influenza virus infected conditions in rats,and 0 indicates the total death of pregnant rat embryos.“Control”means the normal control group,and “H1N1” means influenza virus infection group.Data are shown as mean±standard error(±sx).**:P<0.01;scale bar=2 mm.
2.3 流感病毒对大鼠胚胎心脏发育相关基因的影响
实验室前期构建了流感病毒NS1蛋白融合质粒,转染大鼠心肌细胞系(H9C2)后进行了ChIPSeq分析,筛选出了8个与大鼠心脏发育相关的基因:BMP4、FGF12、WWOX、DDR2、EPHB3、NRG1、SHOX2和BCL2(数据待发表)。为了进一步研究流感病毒导致大鼠胚胎心脏发育异常的分子机制,我们利用qRT-PCR检测筛选出的基因在病毒感染后大鼠胚胎心脏中的表达。
实验结果表明,与对照组相比,在H1N1流感病毒感染后的大鼠胚胎心脏组织中显著下调的基因有 BMP4(表达下调 85.5%,P=0.000 54)、FGF12(表达下调 89.0%,P=0.000 31)、WWOX(表达下调93.0%,P=0.000 16)、DDR2(表达下调 89.4%,P=0.017)、EPHB3(表达下调 76.0%,P=0.049);而NRG1(P=0.07)、SHOX2(P=0.42)和 BCL2(P=0.19)的表达水平没有显著变化(图3)。以上结果表明,BMP4、FGF12、WWOX、DDR2、EPHB3 基因的表达下调可能是流感病毒引起先心病发生的重要分子途径。但是具体的分子机制,还有待进一步阐明。
3 讨论
先天性心脏病是最常见的新生儿缺陷,研究先心病的发病机制对先心病的预防和治疗具有极为重要的意义[25]。目前,环境因素与先心病的分子机制研究甚少。在流感病毒大爆发时期,先心病的发病率骤然升高,孕母体流产甚至死亡等临床病症高度增加[26]。因此,揭示流感病毒导致先心病的发病机理对了解先心病的发生和预防具有重要意义。

图2 大鼠E13.5 d时期胚胎心脏表型Control,正常大鼠胚胎心脏;H1N1,宫内感染流感病毒的胚胎心脏。RA:右心房;RV:右心室;LA:左心房;LV:左心室。Fig.2 E13.5 d embryonic cardiac phenotype“Control” means the heart of normal rats,and “ H1N1” means the heart of H1N1 infections.RA:Right atrial;RV:Right ventricle;LA:Left atrial;LV:Left ventricle.
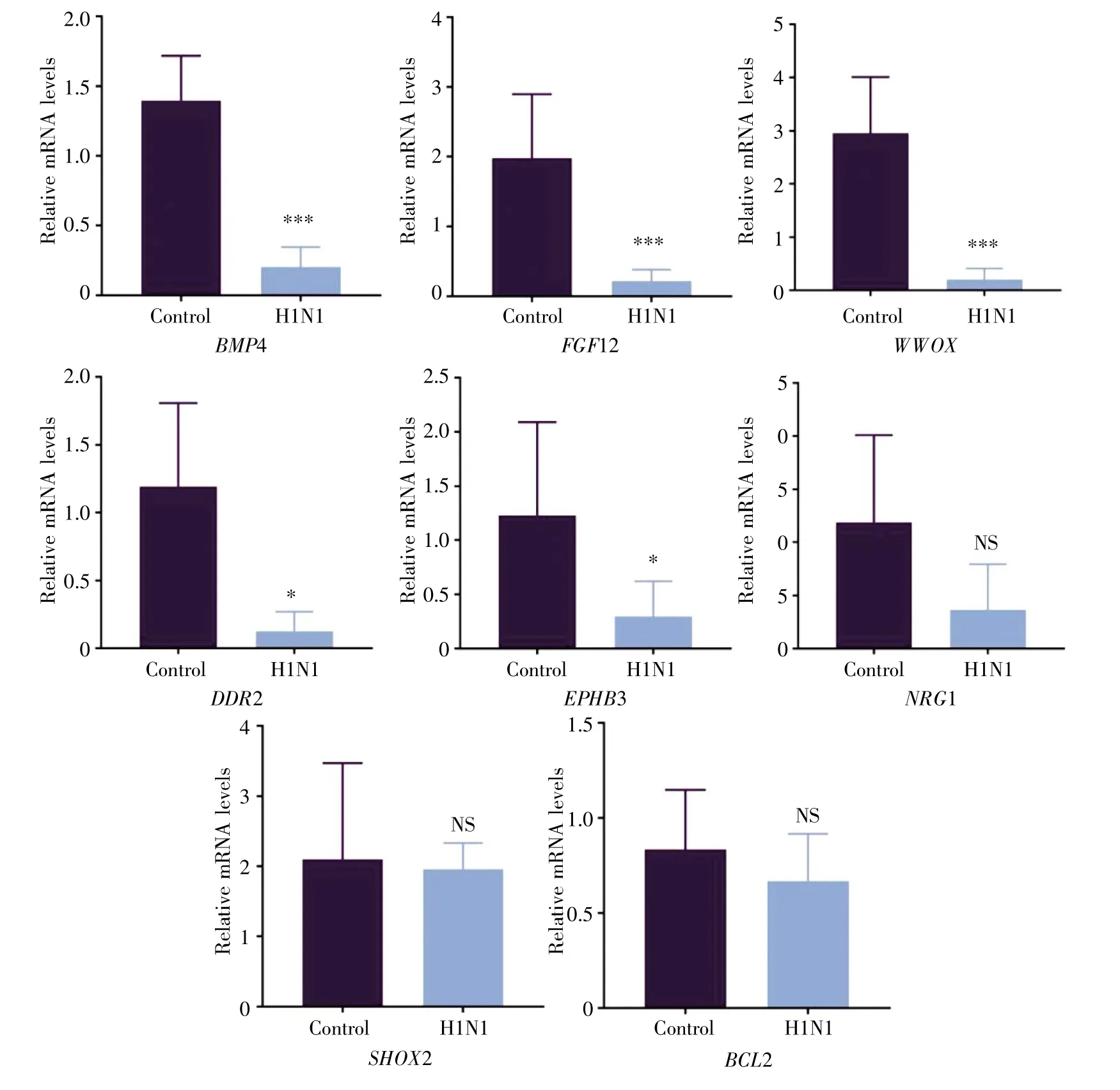
图3 流感病毒对大鼠胚胎心脏发育相关基因表达的影响所有数据用平均值±标准误差(±s)表示,采用 Student’s t-test进行显著性分析。 ***,P<0.001;*,P<0.05;NS,P>0.05。Fig.3 Relative expression of genes involved in the fetal heart development of rats infected with influenza virusData are analysed by Student’s t-test and shown as mean±standard error(±s).***,P<0.001;*,P<0.05;NS,P>0.05.
心脏发育的信号调控是复杂的,单基因的表达异常可能导致信号调控网络出现紊乱,从而导致先心病的发生。本研究建立了F344大鼠流感病毒宫内感染模型,发现流感病毒影响大鼠胚胎和胚胎心脏的发育,造成胚胎发育迟缓、体积减小、心脏发育畸形以及流产等现象。其中心脏发育表型畸形包括流出道缩短和膨出、心房充血扩张和心室缩小,但心脏内部的结构缺陷仍需进一步探究。BMP4、FGF12、WWOX、DDR2和 EPHB3基因的正常表达对胚胎心脏的发育至关重要。BMP4是一种心肌细胞标记因子,直接参与调控房室垫以及房室间隔的形成。敲除小鼠BMP4基因后,会导致房室管缺损,引发先天性心脏病,胚胎在发育到中期之前即出现死亡[16]。FGF12与Na+通道的相互作用在引起心律失常中发挥重要作用,FGF12的下调会导致心室心动过速[17]。WWOX基因高度保守,WWOX敲除小鼠同样存在发育迟缓,并且骨结构发育异常;出生后18 d,小鼠骨体积和皮质厚度减少,在3周内全部死亡[18]。大鼠WWOX基因突变后,会导致侏儒症并伴有癫痫症状[19]。DDR2在心脏早期的心外膜及内皮细胞和间充质细胞中均有表达,在心尖和房室垫的局部区域表达增加[23]。EPHB3在胚胎血管系统中高度表达,对于胚胎心脏以及胚胎血管系统的生成和重塑至关重要[24]。qRT-PCR检测发现在感染流感病毒的大鼠胚胎心脏中,这些基因都发生显著性下调,可能是引起大鼠胚胎心脏发育畸形的重要原因之一,其潜在的分子机制还有待于进一步研究。
综上所述,本文通过形态学观察和荧光定量PCR分析发现,流感病毒感染大鼠孕鼠后,影响其胚胎、胚胎心脏及发育相关基因的表达,这为以后流感病毒致先心病研究提供了理论基础。但是,本文的研究在大鼠中仍不够完善,H1N1流感病毒具体调控心脏发育异常的信号机制仍需后续研究。
