十二烷基硫酸钠毛细管电泳法分析非还原单克隆抗体药物纯度的前处理条件优化
2019-05-30刘振东徐玲丽王庆民陈泓序
刘振东, 高 铁, 徐玲丽, 杨 勇, 王庆民*, 陈泓序*
(1. CE & Biopharma, Sciex, 北京 100015; 2. 齐鲁制药有限公司药物研究院, 山东 济南 250100)
十二烷基硫酸钠毛细管电泳法(sodium dodecyl sulfate capillary electrophoresis, CE-SDS)作为当前单克隆抗体(monoclonal antibody, mAb)纯度检测的主要方法,已经收录到《中国药典》2015版中,并在单抗药物的质量研究及放行检测中用于纯度分析。药典中要求对单抗药物的还原(reduced, r)和非还原(non-reduced, nr)样品进行分别检测,汇报两种纯度结果[1]。还原和非还原单抗纯度分析的差别在于样品前处理[2,3]。两种分析方法中样品均需要与十二烷基硫酸钠(sodium dodecyl sulfate, SDS)络合,但还原单抗纯度分析时需要使用巯基乙醇等还原剂将单抗结构中的二硫键断裂,形成轻链和重链。而非还原单抗纯度分析则需要保持二硫键稳定不断裂,故需加入巯基封闭剂对裸露的巯基进行封闭[4],防止游离巯基介导的链间二硫键断裂而产生碎片。
目前大部分生物药生产企业均采用CE-SDS纯度分析试剂盒(Sciex公司)中的标准条件进行前处理[5],即还原和非还原单抗分析均采用0.1 mol/L Tris-HCl+1%SDS (pH 9.0)溶液作为样品缓冲液对免疫球蛋白G(IgG)进行还原和非还原处理以及与SDS的络合[6]。而对于非还原单抗纯度分析,使用现有的样品缓冲液(pH 9.0)时,单抗样品在处理过程中可能会发生抗体链间二硫键断裂而产生非预期的降解片段,如轻链(light chain, LC)、重链(heavy chain, HC)、重轻链(heavy chain-light chain, HL)、重重链(heavy chain-heavy chain, HH)、重重轻链(heavy chain-heavy chain-light chain, HHL)[7]。影响非还原单抗药物纯度分析的准确性,使纯度测定结果偏低。
为了保证非还原单克隆抗体CE-SDS纯度分析的客观和准确性,我们对非还原单抗CE-SDS纯度分析的样品前处理条件进行了优化。发现:这些非预期的降解主要来源于巯基封闭剂的效果不佳,使单抗分子链间发生了二硫键断裂而产生了额外的降解片段。通过对碘乙酰胺(iodoacetamide, IAM)和N-乙基马来酰亚胺(N-ethylmaleimide, NEM)两种常用巯基封闭剂作用机理的研究,我们发现上述两种巯基封闭剂均产生如下效果:样品缓冲液的pH会影响封闭反应,进而影响抗体的降解。
1 实验部分
1.1 仪器、试剂及样品
毛细管电泳仪(PA800 Plus生物制药分析系统,Sciex公司);电热恒温水槽(DK-8,上海森信实验室仪器有限公司);分析天平(AL104, Mettler Toledo公司);离心机(Biofuge, Thermo公司)。
IgG纯度分析试剂盒(A10663, Sciex公司):包含SDS凝胶缓冲液、样品缓冲液(pH 9.0)、熔融石英毛细管、0.1 mol/L HCl和0.1 mol/L NaOH; IAM (A14715, Alta Aesar公司); NEM (N808609-5g, Macklin公司);磷酸氢二钠(Na2HPO4, 20040618,国药化学试剂公司);柠檬酸(102120170303,湖南尔康公司);十二烷基硫酸钠(0227-100G, Amresco公司);二次去离子水(Millipore公司)。
mAb A(IgG1)、mAb B(IgG2)、mAb C(IgG1)、mAb 1(IgG1)、mAb 2(IgG1片断)、mAb 3(IgG1)、mAb 4(IgG2)、mAb 5(IgG4)、mAb 6(IgG2)、mAb 7(IgG1)样品及其不同批次样品均由齐鲁制药有限公司药物研究院生物技术研究所制备。
1.2 溶液配制
1.2.1样品缓冲液
pH 9.0样品缓冲液:0.1 mol/L Tris-HCl+1%SDS(取自Sciex IgG纯度分析试剂盒)。pH 6.0、7.0、8.0样品缓冲液:20 mmol/L Na2HPO4-柠檬酸+1%SDS(不同pH由1 mol/L NaOH进行调节)。
1.2.2巯基封闭剂
用二次去离子水分别配制1 mol/L IAM和0.1 mol/L NEM,需在实验前现用现配。
1.3非还原CE-SDS样品前处理
取不同pH的样品缓冲液,加入2 μL 1 mol/L的IAM或5 μL 0.1 mol/L的NEM,再加入100 μg的样品,使其终体积为100 μL,其中IAM的终浓度为0.02 mol/L, NEM的终浓度为0.005 mol/L。70 ℃温浴10 min,冷却,10 000 r/min离心5 min。需在毛细管电泳进样前现用现配。
1.4毛细管电泳条件
毛细管:20/30 cm(有效/总长度),内径50 μm;毛细管温度:25 ℃;样品储存温度:25 ℃;进样:-10 kV, 20 s;分离电压:-15 kV,分离时间:35 min;检测器:二极管阵列检测器,220 nm。
1.5毛细管电泳冲洗条件
新更换毛细管使用0.1 mol/L NaOH、0.1 mol/L HCl、二次去离子水、SDS凝胶缓冲液分别在0.5 MPa条件下冲洗10 min,再进行-15 kV电压平衡10 min;针间冲洗为0.1 mol/L NaOH、0.1 mol/L HCl、二次去离子水分别在0.5 MPa下冲洗3 min, SDS凝胶缓冲液0.5 MPa冲洗10 min。
2 结果与讨论
2.1 样品缓冲液pH对非还原单抗纯度分析的影响
非还原单抗前处理时使用巯基封闭剂来封闭游离的巯基,防止游离巯基介导的链间二硫键断裂而产生碎片[8,9]。据文献报道,两种常用的巯基封闭剂IAM和NEM的最佳封闭条件均在pH 6.0~7.0[10,11],而现有商品化试剂盒中的样品缓冲液pH为9.0。因此我们考察了不同pH (pH 6.0、7.0、8.0、9.0)的样品缓冲液的封闭效果,对4种样品缓冲条件下的分析结果进行了比较。
3种单抗样品(mAb A、mAb B、mAb C)采用两种烷基化试剂(IAM、NEM)和4种不同pH(6.0、7.0、8.0、9.0)的样品缓冲液进行前处理,电泳分析后进行主峰纯度的对比,主峰纯度在不同pH条件下的趋势如图1。结果表明,采用IAM或NEM作为巯基封闭试剂,随着样品缓冲液pH的逐渐升高,非还原单抗的CE-SDS主峰含量逐渐下降,pH 6.0与pH 9.0时的主峰含量差值可达6.5%之多,且在使用IAM和NEM两种封闭试剂的条件下具有相同的趋势。用pH 6.0样品缓冲液进行前处理时的抗体纯度明显高于用pH 9.0的样品缓冲液,此结论与之前Zhang等[12]的报道一致。

图 1 不同pH样品缓冲液条件下单抗纯度的变化趋势Fig. 1 Purity trend of mAbs under differentsample buffer pHThe purity trend of mAb A/mAb B/mAb C by non-reduced CE-SDS via different sample buffer pH and different alkylation agents.
pH低于6.0的缓冲溶液会影响IAM和NEM封闭游离巯基的效果,且考虑到抗体样品较为稳定的处理环境,以上对比试验未采用pH低于6.0的样品缓冲液。
以mAb C为例,经不同烷基化试剂(IAM、NEM)和两个pH(6.0、9.0)的样品缓冲液处理后的电泳图谱如图2。在pH 6.0、IAM的单抗前处理条件下,抗体片段LC、HH、HHL的含量明显低于pH 9.0、IAM的前处理条件;在pH 6.0、NEM的单抗前处理条件下,抗体片段LC、HH、HHL的含量明显低于pH 9.0、NEM的前处理条件。说明采用pH 6.0样品处理液前处理条件更能客观准确地检测抗体药物纯度;而在相同pH条件下,IAM和NEM两种封闭试剂在抗体纯度检测中的结果相近,NEM处理的样品纯度略高于IAM,因此后续试验以NEM为例进行考察。

图 2 不同样品缓冲液进行非还原mAb C处理的CE-SDS电泳图Fig. 2 Electropherogram of non-reduced CE-SDS formAb via different sample preparationSample: mAb C; CE-SDS conditions: capillary, 20/30 cm effective/total length, inner diameter 50 μm; capillary temperature, 25 ℃; sample storage temperature, 25 ℃; injection, -10 kV, 20 s; separation voltage, -15 kV; separation time, 35 min; detector, PDA 220 nm.
为了证实该pH影响纯度的变化趋势适用于大部分单抗样品,我们又使用了16个批次的7种单抗样品,考察了在pH 6.0和pH 9.0两个样品缓冲液条件下的纯度。结果与预期的一致,对于考察的所有单抗样品,pH 6.0的样品缓冲液兼具了屏蔽游离巯基和保护蛋白质稳定性的作用,均为最佳样品缓冲液条件,提供单抗产品最真实客观的纯度质量结果。例如,对于两个批次的mAb 7样品,pH 6.0样品缓冲液条件下主峰校正峰面积百分比的平均值比pH 9.0条件下高了4.45%(见表1);对于不同的样品而言,由于游离半胱氨酸残基的数量不同,在不同pH条件下的主峰纯度差值不同[13]。为了验证采用pH 6.0样品缓冲液进行前处理时方法的可靠性,以mAb 1和mAb 6为例,进行了pH 6.0和pH 9.0样品缓冲液条件下的精密度测试,RSD均在1%以下(0.08%~0.24%)。非还原CE-SDS的结果再次证明,高pH的样品处理液会导致抗体产生较多的降解片段,进而产生不能反映产品实际质量情况的纯度结果。由于巯基封闭试剂的作用是尽最大可能防止抗体在前处理过程中产生降解,因此在下面的工作中我们对不同pH样品处理液影响巯基封闭试剂封闭游离巯基作用能力的机理进行了探讨。

表 1 16个批次的7种单抗样品的非还原CE-SDS纯度分析结果
2.2 pH影响IAM封闭能力的机理探讨
IAM在碱性条件下会发生亲核取代反应脱碘形成羟基(见图3),羟基在碱性作用下会解离一个质子,形成带一个电子的负电荷结构。由此可见,碱性样品缓冲液会使IAM发生亲核取代反应从而影响IAM对巯基的封闭效果。如果用IAM进行巯基封闭,就此反应而言,不适合使用碱性样品缓冲液。
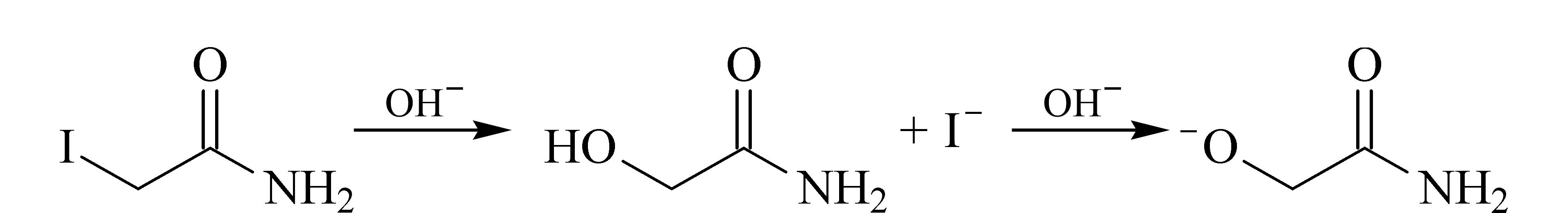
图 3 IAM在碱性条件下的亲核取代反应Fig. 3 Nucleophilic substitution reaction of IAMunder alkaline condition
2.3 pH影响NEM封闭能力的机理探讨
NEM封闭巯基的最佳pH是6.0~7.0,在该pH下NEM既能保持巯基的亲核活性,又能降低与氨基的副反应。当pH>7.0时,NEM与氨基的反应活性高于巯基,故pH>7.0时大部分NEM被氨基消耗掉,不能起到预期封闭巯基的效果,且产生副产物。在pH<6.0时,NEM也可以用于游离巯基的封闭,只是反应活性稍低。
由图2电泳图可知:用NEM封闭剂处理样品后的电泳图在8 min左右有个特征峰(IAM作为封闭剂时无此峰)。且使用pH 9.0的样品缓冲液时该特征峰明显高于使用pH 6.0的样品缓冲液时。推测可能发生了如图4所示的水解反应。NEM在碱性条件下发生开环反应,最终形成带上一个负电荷的水解产物hNEM,其可随电动进样进入毛细管中被检测到。酸性条件下不会发生该反应。而NEM本身不带电荷不会被检测到。因此推断,NEM发生的开环反应,影响其封闭效果,所以应用NEM封闭游离巯基时,应在pH<7.0的条件下进行。
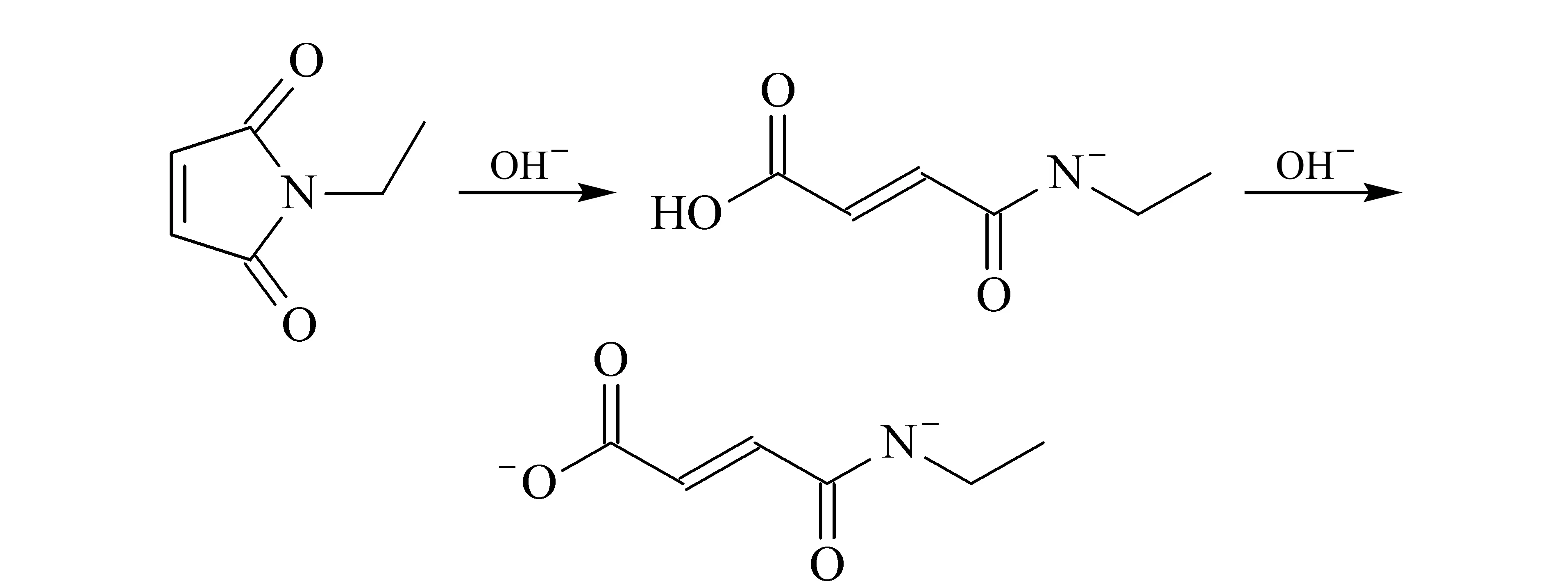
图 4 NEM的水解反应Fig. 4 Hydrolysis of NEM
经以上分析,IAM和NEM在pH 9.0的样品缓冲液条件下均出现明显的降解,失去封闭游离巯基的作用,进而易产生游离巯基介导的链间二硫键断裂,导致样品处理过程中发生降解。
3 结论
通过上述实验及结果分析,我们发现在非还原单抗的CE-SDS纯度分析中,样品缓冲液的pH会显著影响纯度的分析结果,随pH增高纯度有降低的趋势。pH 9.0时纯度分析结果低于pH 6.0时,主峰纯度相差可达6.5%之多。通过封闭试剂的机理研究得出结论:在pH较高的样品缓冲液中,两种常用的封闭剂IAM和NEM均出现明显的降解,降低了封闭游离巯基的作用,易产生游离巯基介导的链间二硫键断裂,导致样品处理过程中发生非预期降解而产生额外的碎片。该降解现象在pH 6.0的样品缓冲液中明显好转。因此,为客观、准确评价单抗产品的质量及质量变化情况,非还原单抗的CE-SDS纯度分析应采用pH 6.0的样品缓冲液。