超高效液相色谱-串联质谱法测定茶叶中游离氨基酸成分
2019-05-30杜颖颖刘相真叶美君徐建峰高海燕郑国建
杜颖颖, 刘相真, 叶美君, 徐建峰, 高海燕, 郑国建
(中华全国供销合作总社杭州茶叶研究院, 国家茶叶质量监督检验中心, 浙江 杭州 310016)
茶叶中的游离氨基酸是茶叶化学组分中的重要组成部分,也是茶叶品质的重要评价因子之一。大多数氨基酸都存在D型和L型两种异构体,其中L-氨基酸是人体重要营养物质[1]。茶叶中含有20多种L型游离氨基酸,其组成和含量将直接影响茶叶的香气和滋味。其中茶叶特有的氨基酸----茶氨酸具有类似味精的鲜爽和焦糖香气[2],可缓解茶的苦涩味,增强其甜味[3],也是茶叶鲜爽滋味的主要来源,其他的氨基酸也具有各自的风味特征。因此,茶叶中L型游离氨基酸组分分析对于茶叶品质鉴定具有十分重要的意义。
对茶叶中游离氨基酸的检测方法一直在摸索与精进中。茚三酮比色法是目前测定游离氨基酸总量的常规方法,也是国标《茶 游离氨基酸总量测定》中所采用的检测方法[4],但该法只适用于茶叶中游离氨基酸总量的测定,不能检测茶叶中各游离氨基酸组分的含量。氨基酸自动分析仪法应用于茶叶中氨基酸的检测已有多年历史[5-8],但存在设备价格及仪器局限性等问题[9,10]。经过多年发展,柱前衍生-高效液相色谱(HPLC)法已经取得了长足的进步,其测定精密度和准确性正向离子交换法逼近,加之HPLC具灵敏度高、仪器普及面广、能一机多用等优势,HPLC法测定茶叶中的氨基酸正式进入广泛应用阶段[11-13],但HPLC法的衍生化精确性及操作性等问题还有待更完善地解决[10,12]。因此,需寻求一种更准确、高效、快速、操作简便的方法来测定茶叶中的游离氨基酸。
液相色谱-质谱联用(LC-MS)结合了液相色谱的强大分离功能和质谱分析的高选择性、高特异性、高灵敏度、高稳定性;样品处理简单,分析通量高,易于自动化;分析复杂样品时干扰小,数据准确度高,可信度高,特别适于低含量样品的检测分析。随着串联质谱(MS/MS)和电喷雾离子(ESI)源的快速发展,使得LC-MS/MS法成为氨基酸检测的最热门分析手段之一。目前此方法在测定植物[14-17]、动物[18,19]体内的游离氨基酸已见较多应用,张磊等[20]应用气相色谱-质谱联用(GC-MS)与LC-MS分析筛选出茶氨酸、谷氨酸及其他与茶叶滋味密切相关的化学成分,但还未见应用LC-MS/MS法测定茶叶中各游离氨基酸组分的研究报道。
本文通过对质谱、色谱条件和提取方法的优化,在ESI源正离子扫描模式下检测,建立了超高效液相色谱-串联质谱(UHPLC-MS/MS)直接测定茶叶中游离氨基酸的方法。采用该方法检测了黄化品种绿茶(九凝飞黄)、白茶(白牡丹)和红茶(英德红茶)中游离氨基酸组分的含量,并与文献中茚三酮法和HPLC法的结果进行了对比和讨论。
1 实验部分
1.1 仪器及设备
UPLC/TSQ Quantum Access MAX超高效液相色谱-三重四极杆质谱联用仪(美国Thermo Fisher Scientific公司); ACE EXCEL 2U AQ色谱柱(150 mm×2.1 mm, 2 μm,广州菲罗门公司);分析天平(感量0.000 1 g,瑞士Mettler Toledo公司);超纯水系统(成都康宁实验专用纯水设备厂)。
1.2 试剂与材料
甲醇(色谱纯,美国Tedia公司);乙酸铵(色谱纯,美国Fluka公司);甲酸(色谱纯,德国Merck公司)。氨基酸标准品:L-天门冬氨酸(L-aspartic acid,简写为Asp,纯度99%,低金属含量)、L-脯氨酸(L-proline,简写为Pro,纯度99%)、L-缬氨酸(L-valine,简写为Val,纯度99%)、L-色氨酸(L-tryptophan,简写为Trp,纯度99%)、L-异亮氨酸(L-isoleucine,简写为Ile,纯度99%)、L-亮氨酸(L-leucine,简写为Leu,纯度99%)、L-半胱氨酸(L-cysteine,简写为Cys,纯度99%)、L-赖氨酸(L-lysine,简写为Lys,纯度98%)、L-酪氨酸(L-tyrosine,简写为Tyr,纯度99%)、L-谷氨酸(L-glutamic acid,简写为Glu,纯度99%)、L-丝氨酸(L-serine,简写为Ser,纯度99%)、L-苯丙氨酸(L-phenylalanine,简写为Phe,纯度99%)、L-蛋氨酸(L-methionine,简写为Met, 99%)、甘氨酸(glycine,简写为Gly,纯度99.5%)、L-丙氨酸(L-alanine,简写为Ala,纯度99%)、L-天冬酰胺(L-asparagine,简写为Asn,纯度99%)、L-谷氨酰胺(L-glutamine,简写为Gln,纯度99%)、L-组氨酸(L-histidine,简写为His,纯度98%)、L-精氨酸(L-arginine,简写为Arg,纯度99%)、L-苏氨酸(L-threonine,简写为Thr,纯度99%)、L-茶氨酸(L-theanine,简写为Thea,纯度99%)均购自上海百灵威化学技术有限公司。水为超纯水。
选用九凝飞黄(浙江紫凝黄茶有限公司)、白牡丹(福建白天鹅茶业有限公司)和英德红茶(英德英茶辉达电子商务有限公司),按照国标[21]制备成磨碎样品。
1.3 标准溶液的配制
氨基酸单体标准溶液配制:分别称取10.0 mg固体氨基酸单体标准物质,分别用0.2%(体积分数,下同)甲酸水溶液溶解,配制成质量浓度为100 mg/L的标准溶液,于4 ℃冰箱中避光保存。
氨基酸混合标准溶液配制:分别称取除Gly外的18种氨基酸及2种酰胺类标准品100.0 mg,置于同一烧瓶,用0.2%甲酸水溶液溶解,配制成各氨基酸质量浓度为1 000 mg/L的混合标准溶液,于4 ℃冰箱中避光保存。
1.4 氨基酸的提取条件
1.4.1提取溶剂
称取5份试样,每份取0.300 g,置于三角锥形瓶中,分别加入沸水、0.2%、0.4%、0.6%和1.0%甲酸水溶液各50 mL,在沸水浴中浸提45 min。称取3份试样,每份取0.300 g,置于三角锥形瓶中,分别加入0.2%甲酸水溶液、60%乙醇和85%乙醇各50 mL,在75 ℃水浴中浸提45 min。称取1份试样,每份取0.300 g,置于三角锥形瓶中,加入50 mL甲醇,在60 ℃水浴中浸提45 min。分别过滤并定容,过滤后的9份浸提液分别稀释200倍,记为A1~A9;过滤后的9份浸提液分别稀释600倍,记为B1~B9。将A1~A9和B1~B9分别用0.22 μm水相滤膜过滤,测定。
1.4.2提取茶水比
在1.4.1节的基础上,选取最佳提取溶剂,分别按茶水质量(g)体积(mL)比(简称茶水比)1∶50、1∶75、1∶100、1∶150、1∶200的比例浸提45 min,分别过滤并定容,过滤后的浸提液分别稀释200和600倍,再用0.22 μm水相滤膜过滤,测定。
1.4.3浸提时间
在1.4.1和1.4.2节的基础上,选取最佳提取溶剂和茶水比,分别提取10、20、30、45和60 min,分别过滤并定容,过滤后的浸提液分别稀释200倍和600倍,再用0.22 μm水相滤膜过滤,测定。
1.5 分析条件
1.5.1UHPLC条件
经优化后确定的条件为:ACE EXCEL 2U AQ色谱柱(150 mm×2.1 mm, 2 μm);流动相A为5 mmol/L乙酸铵水溶液(含0.2%甲酸),流动相B为甲醇;流速:0.3 mL/min;柱温:40 ℃;进样量:5.0 μL。梯度洗脱条件:0~4.0 min, 100%A; 4.0~4.1 min, 100%A~100%B; 4.1~7.0 min, 100%B; 7.0~10.0 min, 100%B~100%A; 10.0~15.0 min, 100%A。
1.5.2质谱条件
离子源为ESI,正离子模式;雾化气为氮气;离子喷雾电压为3 500 V;雾化室温度为120 ℃;离子源温度为350 ℃;碰撞气为氩气,压强为0.2 Pa;扫描模式为选择反应检测(SRM)。

表 1 20种氨基酸质谱参数
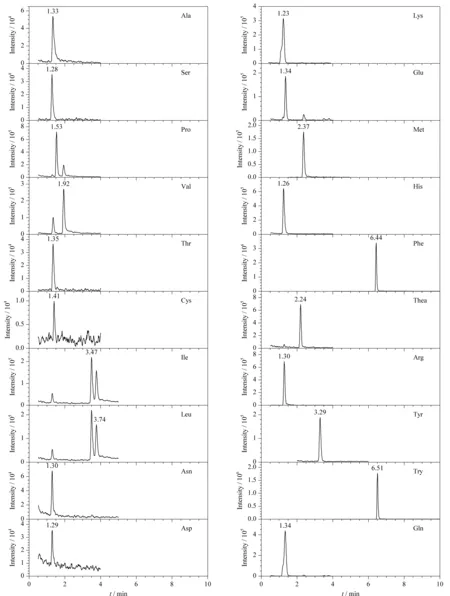
图 1 20种游离氨基酸的提取离子流色谱图Fig. 1 Extracted ion chromatogram of the 20 free amino acids
2 结果与讨论
2.1 质谱条件优化
质谱条件的优化主要包括选择各氨基酸组分的子离子、去簇电压、碰撞能量等。稀释各氨基酸标准溶液至1 mg/L后,用针泵进样的方式,进质谱仪器直接分析,通过母离子扫描,调节碰撞能量,获得稳定性好、信号强度高的碎片离子。共优化出除Gly之外的20种氨基酸参数,结果见表1。将氨基酸混合标准溶液进行检测,得提取离子流色谱图(见图1)。通过图1可知,20种氨基酸可以通过母离子、子离子和保留时间进行定性分析。
2.2 样品提取条件的优化
2.2.1提取溶剂的优化
由于各氨基酸的R基不同,各氨基酸在水中的溶解度不同,如Arg易溶于水,而Tyr几乎不溶于水。根据氨基酸溶于酸的特性及前人的提取研究情况[22]。选取沸水、不同浓度甲酸的水溶液、60%乙醇、85%乙醇和100%甲醇作为提取溶剂进行试验。根据各溶剂的沸点,设定沸水浴、75 ℃水浴和65 ℃水浴。

图 2 不同茶水比对游离氨基酸总量和主要氨基酸含量的影响Fig. 2 Effects of different tea-to-water ratios on the contents of total free amino acids and main amino acids

表 2 不同提取溶剂提取的游离氨基酸含量
ND: not detected.
从表2的结果可以看出,用不同的溶剂提取氨基酸,浸出氨基酸总量前3的溶剂顺序为:0.2%甲酸(75 ℃水浴)>0.2%甲酸(100 ℃水浴)>0.4%甲酸。添加甲酸的水溶液浸提率要略高于沸水浸提,要明显高于乙醇和甲醇溶液,浸出率最低的溶剂为100%甲醇,多个氨基酸组分未检出。从表2中也可以看出,用0.2%甲酸(75 ℃水浴)浸提时,主要氨基酸Thea、Arg、Asp浸出率也最高。因此,提取溶剂选择0.2%甲酸(75 ℃水浴)。
2.2.2茶水比的优化
按5个不同比例的茶水比,加入0.2%甲酸,在75 ℃水浴中浸提45 min。由图2可知,茶水比对氨基酸提取影响也较为明显,当茶水比增加时,测得的氨基酸总量随之上升,茶水比在1∶100时,氨基酸总量达到最高,随后逐渐降低。Thea、Glu、Asp、Gln和Asn等主要氨基酸含量提取趋势与总氨基酸含量相同。经过分析,确定提取茶水比为1∶100。
2.2.3提取时间的优化
确定提取溶剂为0.2%甲酸(75 ℃水浴)和茶水比为1∶100,在此基础上,将磨碎试样浸提10~60 min,共设5个参数,结果见图3。提取10 min时,氨基酸溶出率已较高,氨基酸总量可溶出87.4%。在10~45 min期间,总氨基酸含量随着提取时间增加而增加,在45 min时达到最高,随后降低。Thea变化趋势与氨基酸总量变化趋势基本一致,在45 min时达到最高,而Arg、Glu、Gln也在45 min时溶出率最高,因此,选择45 min为最终浸提时间。

图 3 不同提取时间对氨基酸总量和主要氨基酸含量的影响Fig. 3 Effects of different extract times on contents oftotal free amino acids and main amino acids
2.3 方法评价
2.3.1标准曲线、检出限和定量限
将7个不同质量浓度(1、10、50、100、250、500和1 000 μg/L)的混合氨基酸标准溶液分别进行检测,用各氨基酸的峰面积对其相应的质量浓度(单位μg/L)进行回归分析,以3倍信噪比为检出限(LOD),以10倍信噪比为定量限(LOQ)。由于茶叶中各氨基酸含量差异很大,Thea和Arg含量非常高。因此在测定茶样时,用稀释600倍后的提取液测定Thea和Arg,稀释200倍后的提取液测定其他氨基酸。根据稀释后茶样中各氨基酸的含量范围,确定20种氨基酸的线性范围、回归方程、相关系数、检出限和定量限。由表3可知,在茶叶中各氨基酸的含量范围内,各氨基酸的响应值与浓度呈良好的线性关系,其相关系数均可达0.99以上。LODs为0.001~0.011 mg/L, LOQs为0.010~0.053 mg/L。
2.3.2方法准确度和精密度
采用标准加入法,进行加标回收试验。分别称取0.50 g茶叶样品,加入适量的氨基酸混合标准溶液,根据各氨基酸定量限和茶叶中实际含有的各氨基酸浓度(Thea和Arg除外),配制成20和10 mg/L的添加水平。按照2.2节优化的样品提取方法进行提取,稀释200倍,相当于最终检测样中混合标准溶液的质量浓度为100和50 μg/L。根据各氨基酸在茶样中的含量水平,检测并计算各氨基酸的回收率(Thea和Arg除外),结果见表4。分别称取0.50 g茶叶样品,加入适量的混合标准溶液,配制成30 mg/L的添加水平,按照2.2节优化的样品提取方法,进行提取,稀释600倍,相当于最终检测样中混合标准溶液的浓度为50 μg/L,检测并计算Thea和Arg的回收率,结果见表4。由表4可知,样品溶液中20种氨基酸的回收率为92.3%~109.2%,方法具有较高的准确度。将10 μg/L的氨基酸混合标准溶液平行测定6次,其结果见表4,可知RSDs为2.00%~9.88%,方法具有较好的精密度。
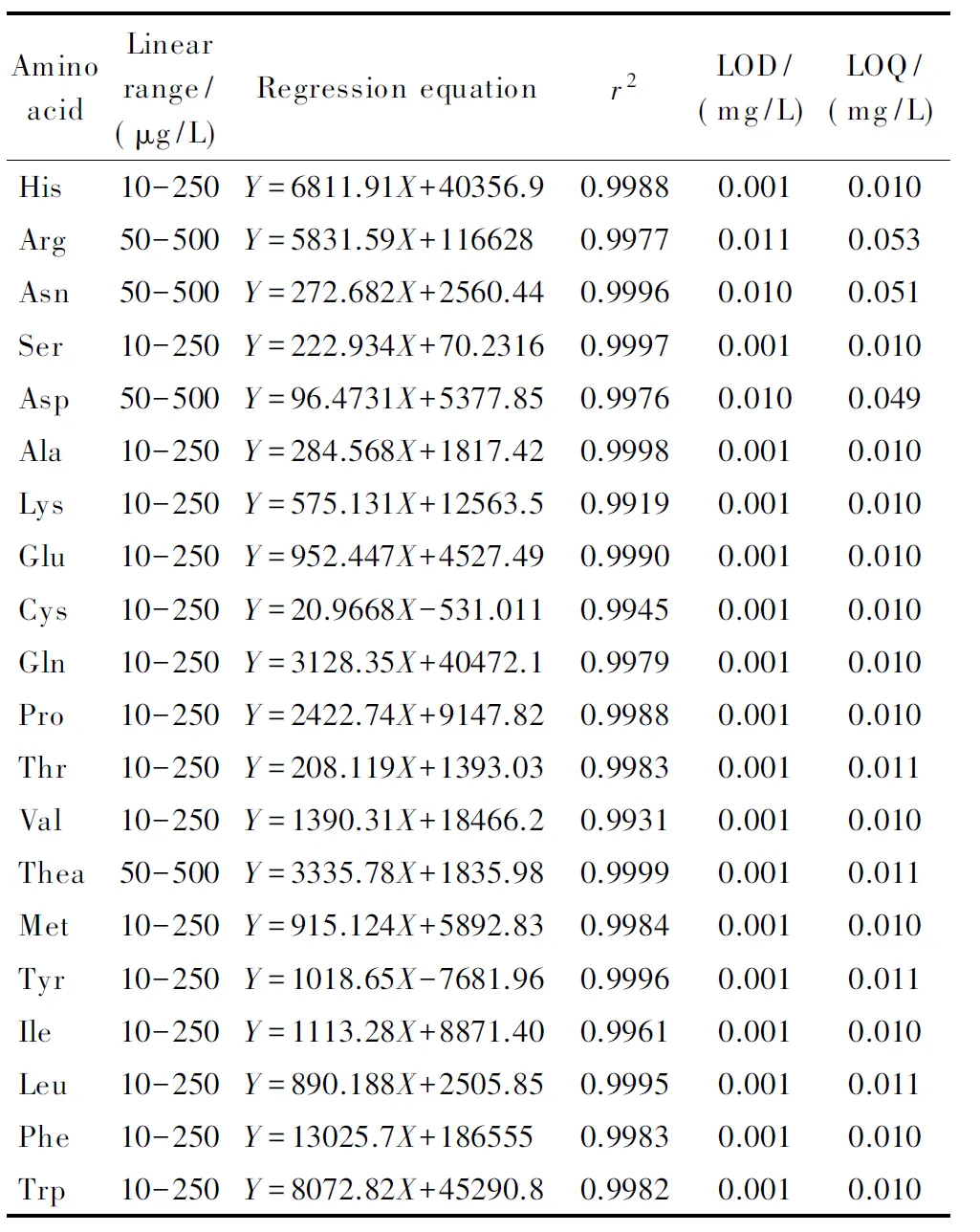
表 3 氨基酸的线性范围、回归方程、相关系数(r2)、检出限和定量限
Y: peak area;X: mass concentration, μg/L.
2.4 实际样品检测
如表5所示,采用上述方法检测黄化品种绿茶(九凝飞黄)、白茶(白牡丹)和红茶(英德红茶)中游离氨基酸组分的含量。数据显示,在九凝飞黄中,Thea、Arg、Asp、Asn、Glu和Ser的含量要明显高于白牡丹和英德红茶,白牡丹中主要氨基酸Thea、Arg、Asp、Ser等含量要明显高于英德红茶,氨基酸总量为九凝飞黄>白牡丹>英德红茶。之前的研究[23,24]表明,白化或黄化茶树品种加工的茶叶与其他茶叶相比,会具有较高的氨基酸含量。用茚三酮比色法[4]测定九凝飞黄氨基酸总量为6.26%,除去两个酰胺类物质的含量,此法检测的氨基酸总量略低于茚三酮比色法检测结果。用高效液相色谱(HPLC)法[25]检测九凝飞黄中的Thea,测得含量为2.26%。由表2可知,用沸水提取时,九凝飞黄中Thea的检测结果为2.240%,接近HPLC法检测结果。当应用此法中优化后的提取条件进行检测时,九凝飞黄中Thea含量为2.347%,略高于上两者,进一步验证了此法的准确性。

表 4 游离氨基酸在茶叶样品中的添加回收率和相对标准偏差(n=6)

表 5 不同种类茶中游离氨基酸含量
ND: not detected.
3 结论
本文通过对质谱、色谱条件和茶叶中氨基酸提取方法的优化,建立了UPLC-MS/MS直接测定茶叶中游离氨基酸的方法。与氨基酸自动分析仪法和HPLC法相比,该方法操作简单,不需要对茶样进行衍生化处理,分析时间短。该法具有较高的灵敏度和准确性,具有良好的重复性和稳定性,可有效检测出茶叶中的20种氨基酸,可用于检测茶叶中的游离氨基酸组分。