超声支气管镜引导下针吸活检淋巴结不同部位的对照研究*
2019-05-30陈思诗李长毅陈贵华
陈思诗,李长毅,陈 彬,陈贵华
(重庆医科大学附属第二医院呼吸内科 400010)
肺癌、肺结核、肺炎、肺结节病等肺部疾病常累及纵隔及肺门淋巴结,其中在肺癌的诊疗过程中,纵隔及肺门淋巴结精准的诊断和分期是决定其治疗和预后的关键[1]。超声支气管镜引导下针吸活检(endobronchial ultrasound-guided transbronchial needle aspiration,EBUS-TBNA)可以突破气道表面和管壁结构的限制,检查范围从支气管腔内扩展到腔外,从而获取标本用于免疫组织化学在内的组织活检及细胞学诊断,可以准确地了解肺门及纵隔内病变的性质和范围。因其高敏感性和高特异性,以及创伤小、操作简便安全、费用低、患者耐受性好[2-3],且良好的取材在一定程度上能满足基因检测的要求等优势[4-5],被美国国家综合癌症网络(NCCN)及美国胸科医师学会(ACCP)在2007年联合推荐为肺癌术前淋巴结分期的重要手段[6]。尽管如此,有研究指出EBUS-TBNA仍有接近约28%的恶性淋巴结疾病漏诊率[7],其原因受很多因素影响。国内外学者分别针对淋巴结的直径、位置、穿刺针数、是否采用负压抽吸、手术者技能熟练程度等方面进行了不同的研究[3-7]。结合淋巴结结构及恶性肿瘤区域淋巴结转移的特点,文献表明淋巴管最初引流到淋巴结的包膜下窦[8-9],早期肿瘤细胞可能集中在该区域,在包膜下区域(即淋巴结包膜下)针吸活检可能会获得更多恶性细胞,有助于提高诊断效率。目前尚少有系统的研究及文献报道,故本研究致力于探讨超声支气管镜引导下针吸活检术中,细针穿刺靶淋巴结的不同部位(包膜下或中心),两者阳性诊断率及标本质量的差异。
1 资料与方法
1.1一般资料 以2016年1月至2017年12月在本院就诊,行CT或正电子发射计算机断层显像CT(PET-CT)检查提示纵隔和(或)肺门淋巴结病变,确诊肺癌或疑似肺癌的78例患者为研究对象。纳入标准:(1)胸部CT扫描、PET-CT提示纵隔和(或)肺门淋巴结病变;(2)确诊肺癌或疑诊肺癌伴纵隔和(或)肺门淋巴结病变;(3)淋巴结直径大于或等于0.5 cm。排除标准:严重心肺功能不全、凝血障碍及不能耐受者。在术前将检查项目、目的、方法、穿刺过程以及可能出现的并发症和诊疗结果告知患者及家属。本研究符合人体试验伦理学标准,并得到医院伦理委员会的批准,入选患者均签授书面知情同意书。
1.2方法
1.2.1研究方式 所有纳入试验的患者由3名EBUS-TBNA经验丰富的呼吸内科介入医生操作完成。术前要求禁食8 h,禁饮1 h,完善血常规、凝血象、心电图、胸部CT 检查等。患者取仰卧位,给予2%利多卡因+阿托品0.5 mg术前雾化吸入,术中给予利多卡因及芬太尼0.05 mg+咪达唑仑5 mg镇静、阵痛麻醉。普通电子支气管镜经鼻腔探查气管及支气管情况,退出换eBUS探查病变淋巴结,选定靶淋巴结,测量其直径并记录。将21G的穿刺针迅速刺穿支气管壁,并超声观察证实细针已刺入靶淋巴结内,连接负压,如WALLACE等[10]的报道,在超声EBUS引导下分别在淋巴结包膜下及中心部位穿刺,每针抽吸10次后取出标本,见图1。
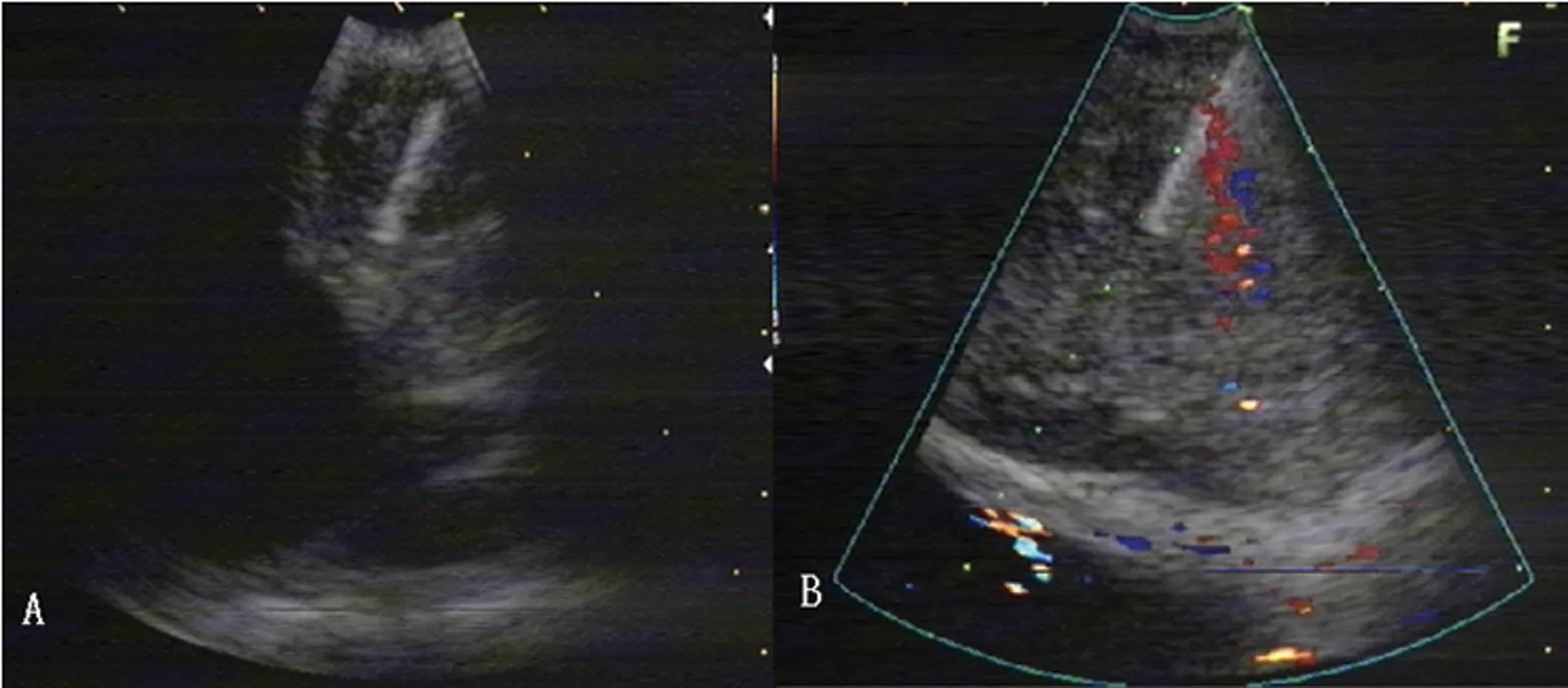
A:淋巴结包膜下部位取样;B:淋巴结中心部位取样
图1EBUS实时监测下于淋巴结不同部位穿刺截图
1.2.2分组 LEE等[11]研究表明单个淋巴结穿刺2针即可获取诊断所需标本量。增加标本量并不能提高阳性诊断率[12]。故本研究每组淋巴结穿刺2针,包膜下及中心各1针;根据穿刺顺序不同分为A、B两组。A组先于淋巴结中心部位穿刺1针,后于淋巴结包膜下穿刺1针;B组先于淋巴结包膜下穿刺1针,后于淋巴结中心部位穿刺1针。为了避免交叉污染干扰结果,前、后2针间需更换穿刺针。将取出的标本进行组织活检和(或)细胞石蜡包埋切片检查。
1.2.3评价标准 诊断标准:EBUS-TBNA病理检查诊断发现淋巴结癌转移为阳性结果,发现异形细胞或高度可疑癌细胞,经开胸活检术、纵隔镜、胸腔镜、CT引导活检、浅表肿大淋巴结活检等检查确诊为肺癌也认为是阳性结果;若EBUS-TBNA未发现恶性细胞,经上述检查确诊为肺癌,则认为是阴性结果;患者在6个月及更长时间后复查胸部CT等影像学检查,病灶未进一步增大,则认为是良性病变。淋巴结定位参照文献[13]。
病理标本质量由对实验单盲的有经验的同一名细胞病理学者进行分析。对同一淋巴结的A组标本及B组标本进行评分,根据MAIR等[14]标准(肿瘤细胞数、细胞退化程度、适当结构和组织的保留、背景血凝块)评价标本质量,总分0~2分:质量差,细胞病理学医师不能进行诊断;3~5分:质量一般,但细胞病理学医师可进行诊断;6~8分:质量优,细胞病理学医师可明确诊断,见表1。

2 结 果
2.1基本情况 共有78例病患参加此次研究,其中男61例,女17例,年龄34~87岁,总共96例淋巴结入组。取样成功率为100%。所有淋巴结穿刺2针,共192针(96×2),淋巴结定位记录为3R、4R、4L、7N、10N、11R、11L、12R、12L。根据穿刺淋巴结部位(包膜下或中心部位)先后顺序不同分为A组及B组,两组年龄、性别、淋巴结数、淋巴结直径大小差异无统计学意义,见表2。

表1 标本质量评价标准(分)

表2 入组患者及淋巴结特征
结合患者手术活检、纵隔镜检查、随访复查等,排除10例良性病变淋巴结,确诊恶性肿瘤的淋巴结有86例;根据EBUS-TBNA病理结果,确诊恶性肿瘤的淋巴结有79例,其中非小细胞肺癌33例(鳞癌12 例,腺癌18例,未明确分型3例),小细胞肺癌25例,未分型的肿瘤21例。
2.2标本质量的比较
排除良性病变,确诊恶性肿瘤的淋巴结86个,对172份标本进行质量评分,A、B组标本质量总评分分别为(6.15±1.79)、(5.62±1.89)分,差异无统计学意义(P=0.058);但其亚组分析发现A组与B组所取标本肿瘤细胞数评分分别为(1.36±0.75)、(1.06±0.83)分,差异有统计学意义(P=0.013)。再进行淋巴结直径亚组统计学分析:5~10 mm肿瘤细胞数评分,A组(1.33±0.77)分明显高于B组(0.67±0.69)分,差异有统计学意义(P=0.010);A、B组>10~15 mm肿瘤细胞数评分分别为(1.37±0.74)、(1.00±0.88)分,差异无统计学意义(P=0.100);A、B组直径大于15 mm肿瘤细胞数评分分别为(1.37±0.77)、(1.27±0.81)分,P=0.576,差异亦无统计学意义。另细胞蜕变程度比较,A组评分(1.56±0.59)分,B组评分(1.36±0.65)分,差异有统计学意义(P=0.038)。而在适当结构和组织的保留、背景凝血块评分中,两组差异均无统计学意义(P>0.05)。见图2、3,表3。
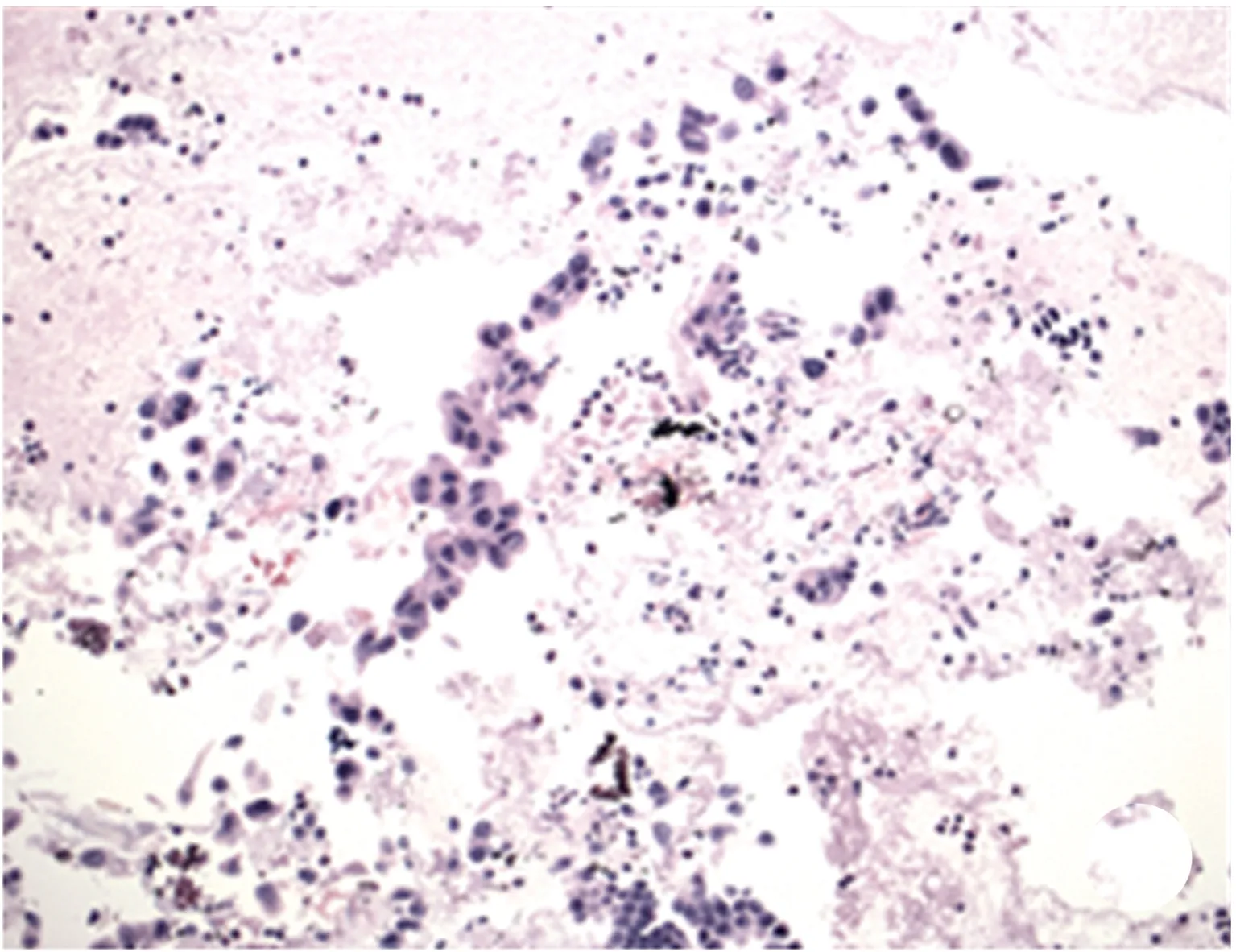
恶性细胞数较少,且破碎退化细胞多,退化程度较重,适当结构和组织保留较少,血凝块多
图2中心部位穿刺所取样本病理图片(HE×200)
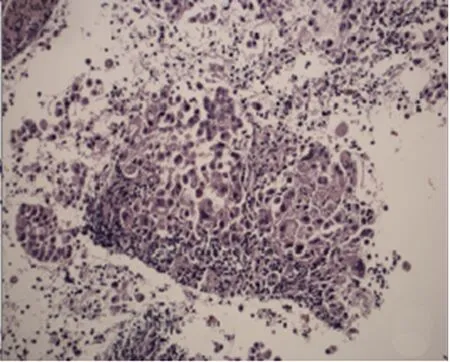
恶性细胞数较多,破碎退化细胞较少且退化程度较轻,适当结构和组织保留较多,血凝块少
图3包膜下部位穿刺所取样本病理图片(HE×200)
2.3病理检查阳性诊断率的比较 EBUS-TBNA病理结果阳性诊断率为91.9%(79/86),其中淋巴结包膜下组阳性诊断率为83.7%(72/86),淋巴结中心组68.6%(59/86),差异有统计学意义(P=0.019);两者结果一致性为68.6%(59/86),见表4。

表3 穿刺淋巴结包膜下及中心标本质量评分结果分)

表4 EBUS-TBNA淋巴结不同部位穿刺病理诊断结果(n)
3 讨 论
本项前瞻性研究共有78例患者进行EBUS-TBNA检查,对穿刺淋巴结不同部位(包膜下/中心)的阳性诊断率及标本质量进行比较。本研究EBUS-TBNA阳性诊断率为91.9%。HERTH等[15]报道502例纵隔及肺门淋巴结病变患者,经EBUS-TBNA穿刺共572例淋巴结,其阳性诊断率为94%;KINSEY等[16]的Meta分析表明EBUS-TBNA的灵敏度为92%。均与本次研究结果相近。
EBUS-TBNA在肺癌纵隔分期及诊断中的应用越来越被人们所接受,目前被认为是确认纵隔疾病的首选方法[17-18],甚至有部分研究指出其可能在一定程度上开始挑战纵隔镜“金标准”的地位[19-20],但这项技术目前因其阴性预测值较低[15],仍需进一步评估和完善,以提高诊断率。本研究着重从淋巴结不同穿刺部位(包膜下/中心)方面对EBUS-TBNA的阳性诊断率及标本质量进行评价。研究显示EBUS-TBNA淋巴结包膜下穿刺较中心部位穿刺可取得更高的阳性诊断率(分别是83.7%、68.6%),且两者差异有统计学意义(P=0.019)。对于EBUS-TBNA所取标本质量的对照分析显示淋巴结包膜下穿刺肿瘤细胞数评分高于中心部位穿刺评分,两者差异有统计学意义(P=0.013),这提示包膜下穿刺对比中心部位穿刺可获得更多肿瘤细胞(图2)。这可能与肿瘤细胞一般选择性于淋巴结的包膜下窦集中有关[8-9]。尤其在本研究结果中发现,5~10 mm组淋巴结包膜下针吸肿瘤细胞数评分明显高于中心部位(P=0.010),而在>10~15 mm组及大于15 mm组中二者评分均无显著性差异,提示临床操作中医生在术前CT或术中超声测量淋巴结大小位于5~10 mm时,选择性地在包膜下针吸可以获取更多的肿瘤细胞。这有助于病理医师在病理诊断的时候进行免疫组织化学等相关技术处理,便于进行准确的病理诊断和分型。更重要的是,足够数量的肿瘤细胞有助于更深入进行驱动基因检测和靶基因的筛选,为基因靶向治疗提供依据[4-5],这可能具有重要的临床意义。WALLACE等[11]的相关报道应用EBUS-TBNA对46例肿大淋巴结进行检查,淋巴结包膜下穿刺并没有提高诊断率。这可能与该研究淋巴结不仅限于肺癌转移的淋巴结,还包括腹部胰腺癌、胃癌等肿瘤转移淋巴结,且所有淋巴结直径均在10 mm以上;而本研究所选淋巴结直径大于或等于5 mm,随着淋巴结直径增大,肿瘤细胞会进一步充满整个淋巴结实质从而影响结果[8-9];另外其研究所选淋巴结仅46例,样本量较小。故推测本研究与其结果不同可能与肿瘤淋巴结转移来源、淋巴结直径、淋巴结数量差异有关。
从表4还可以看出,评估标本质量所有项目中,除肿瘤细胞数评分及细胞蜕变程度评分差异有统计学意义外,适当结构和组织的保留、背景血凝块两项评分差异均无统计学意义。但结合淋巴结中心髓质血管较淋巴结包膜下多且病变淋巴结的中心多为坏死组织等结构特点。TIAN等[21]的研究指出穿刺中心部位所取标本退化坏死细胞组织、血凝块可能较多,而本研究两组背景血凝块评分未见明显差异,与其结果不符,不排除本研究为单一中心等因素对标本质量的影响。
此研究有一定局限性,因既往相关研究少,未明确规定淋巴结包膜下及中心部位的界限,仅凭操作者经验进行定位,这可能对研究结果有一定影响。此外,本研究在单一的中心进行,手术者对整个操作过程是清楚的,不能做到双盲,在穿刺取样时可能出现偏颇。另外本研究没有进行现场细胞学快速评估,尽管有研究指出现场细胞学不能提高EBUS-TBNA的诊断率[22],但其对提高穿刺一次成功率及评估标本质量有一定帮助[23]。故仍需要进行多中心研究进一步论证。
综上所述,EBUS-TBNA在肺癌诊断及分期的过程中,穿刺淋巴结包膜下较穿刺淋巴结中心部位可取得更多肿瘤细胞,特别是淋巴结大小位于5~10 mm时;且所取标本退化程度较轻,从而提高EBUS-TBNA阳性诊断率。这些发现为评估和完善EBUS-TBNA技术提供了合理的依据,但仍需更多多中心的大型研究去证实。
