EZH2对神经干细胞增殖的调控及其机制研究*
2019-05-30黄昌钊王锐英
王 希,黄昌钊,高 峰,何 鹏,王锐英,高 燕
(1.桂林医学院附属医院四肢创伤骨外科,广西桂林 541001;2.桂林医学院附属医院护理学院,广西桂林 541001)
神经干细胞(neural stem cells,NSCs)是指存在于神经系统中,能分化为包括神经元细胞在内的多种细胞的一类细胞,能进行自我更新[1]。NSCs的发现和移植为解决脊髓损伤等疾病后神经元病理性减少及神经元间靶联中断提供了可能[2]。干细胞移植可通过减少二次级联细胞的损伤,增强体内内源性神经干细胞的自我更新(即增殖),从而补充功能受损的神经干细胞群[3]。因此,调控和提高NSCs的增殖至关重要。Zeste基因增强子同源物2(EZH2)是PcG基因家族的基因之一,能够调控基因的表达,EZH2被发现能够促进胚胎干细胞、肿瘤细胞的增殖和转移[4]。并且EZH2在增殖的NSCs中高度表达[5]。但EZH2基因在NSCs增殖中的作用尚不清楚。本研究通过在人神经干细胞(hNSCs)中过表达和敲降EZH2基因的表达,来探究EZH2基因和NSCs增殖之间的联系。
1 材料与方法
1.1材料 人神经元干细胞购自美国Sciencell公司。细胞培养基及胎牛血清购自美国Gibco公司;引物、EZH2敲降慢病毒和过表达慢病毒及其各自对照慢病毒购自上海汉恒生物科技有限公司;CCK8细胞增殖检测试剂盒和EdU检测试剂盒购自海门市碧云天公司;细胞周期及凋亡流式检测试剂盒购自日本东仁化学公司;胰蛋白酶、双抗、二甲基亚砜(DMSO)购自美国Sigma公司;EZH2、Cyclin D1、c-Myc鼠源单克隆抗体、辣根过氧化物酶(HRP)标记山羊抗小鼠IgG二抗购自美国Cell Signaling公司;甘油醛-3-磷酸脱氢酶(GAPDH)鼠源单克隆抗体购自美国Proteintech公司;生物安全柜及细胞培养箱购自美国Thermo Fisher公司;倒置荧光显微镜购自日本OLYMPUS公司;酶标仪购自美国bio-tek EL公司;流式细胞检测仪购自美国BD公司;凝胶电泳系统购自美国Bio-Rad公司。
1.2方法
1.2.1神经干细胞的培养 应用含10% 胎牛血清的DMEM/F12培养基,在37 ℃、5% CO2及饱和湿度条件下进行细胞培养,待细胞长至对数生长期时进行细胞传代。
1.2.24种神经干细胞稳转株构建 4种慢病毒(过表达对照慢病毒OV-Control,过表达慢病毒OV-EZH2;shRNA对照慢病毒sh-Control,shRNA干扰慢病毒sh-EZH2)转染前18~24 h,将贴壁细胞铺到细胞培养板中。待细胞贴壁且生长至50%左右融合度时用含有6 μg/mL polybrene的新鲜培养基替换原培养基,加入适量病毒悬液。37 ℃孵育。继续培养24 h,用新鲜培养基替换含有病毒的培养基。72 h后,加入2 μg/mL Puromycin,每隔2天重新换液加入药物,持续观察14 d左右,直至显微镜下观察荧光细胞比例为100%(比例=GFP阳性细胞数/总细胞数)。随后取一部分细胞用以收取蛋白和RNA,以检测过表达和敲降效率。
1.2.3实时荧光定量聚合酶链反应(qPCR)检测基因表达 每孔细胞加入TRIzol 1 mL。将样品在室温(15~30 ℃)放置5 min,使核酸蛋白复合物完全分离;每使用1 mL TRIzol加入0.2 mL氯仿,剧烈振荡15 s,室温放置3 min;2~8 ℃,10 000×g离心15 min。样品分为3层:底层为黄色有机相,上层为无色水相和一个中间层。RNA主要在水相中,水相体积约为所用TRIzol试剂的60%;把水相转移到新管中,用异丙醇沉淀水相中的RNA;每使用1 mL TRIzol加入0.5 mL异丙醇,室温放置10 min;2~8 ℃,10 000×g离心10 min,移去上清液;用75%乙醇洗涤RNA沉淀。每使用1 mL TRIzol至少加1 mL 75%乙醇。2~8 ℃,7 500×g转速以内,离心5 min,弃上清液;室温放置干燥RNA沉淀,加入25~200 μL无RNase的水,用枪头吸打几次,55~60 ℃放置10 min使RNA溶解,-80 ℃保存。反转录反应程序:37 ℃ 60 min,85 ℃ 5 min,4 ℃ 5 min,置于-20 ℃保存。将制备好的cDNA进行PCR扩增,扩增体系如下:SYBRGreen Mix 12.5 μL,上游引物(正向)0.5 μL,下游引物(反向)0.5 μL,双蒸水(ddH2O) 9.5 μL,cDNA模板 2.0 μL,总体积 25.0 μL。反应程序:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 45 s,循环40次;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s;数据采用仪器自带软件分析:ABI Prism 7300 SDS Software。引物序列,正向:AAT CAG AGT ACA TGC GAC TGA GA;反向:GCT GTA TCC TTC GCT GTT TCC。
1.2.4Western blot检测蛋白表达 细胞的培养、分组及处理同上。蛋白裂解液提取细胞总蛋白,用二辛酸硫酸铜(BCA)试剂盒测定蛋白浓度。随后进行蛋白定量和变性,应用10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,120 V恒定电压在分离胶中电泳60 min,在300 mA恒定电流下应用聚偏二氟乙烯(PVDF)膜进行转膜90 min,洗膜液(TBST)洗膜3遍后,使用5%牛奶封闭非特异性结合位点,封闭结束后,于4 ℃进行一抗(1∶1 000稀释)中孵育过夜,TBST洗3遍之后,加入HRP标记的山羊抗小鼠IgG二抗(1∶2 000稀释)室温中孵育2 h,TBST洗膜后,加入化学发光剂(ECL)反应并利用化学发光成像仪检测。
1.2.5CCK8检测细胞增殖 细胞培养于6孔板,按照基因干扰阴性对照组(sh-Control)、基因干扰组(sh-EZH2)、基因过表达对照组(OV-Control)、基因过表达组(OV-EZH2)分别对细胞进行对应慢病毒转染,慢病毒转染24 h后,直接配置含10% CCK8的培养基,以换液的形式加入。37 ℃孵育0.5 h,将孵育后的上清液转移至96孔板,酶标仪测定450 nm处吸光度;Hank′s平衡盐溶液(HBSS)润洗细胞3次,加入培养基继续培养至48、96 h,重复上述实验内容,绘制细胞生长曲线。
1.2.6EdU掺入法检测细胞增殖 用细胞培养基稀释EdU溶液(培养基:试剂A=1 000∶1),制备适量50 μmol/L的Edu培养基;每孔加入100 μL 50 μmol/L EdU培养基孵育1 h,弃培养基;磷酸盐缓冲液(PBS)清洗细胞2次,每次5 min;每孔加入100 μL 4%多聚甲醛细胞固定液,室温孵育30 min;每孔加入2 mg/mL甘氨酸,脱色摇床孵育5 min后,弃甘氨酸溶液;每孔加入100 μL PBS,脱色摇床清洗5 min,弃PBS;每孔加入100 μL渗透剂(0.5% Triton X-100的PBS)脱色摇床孵育10 min;PBS清洗1次,5 min;每孔加入100 μL的1 mg/mL 4′,6-二脒基-2-苯基吲哚(DAPI),避光、室温、脱色摇床孵育10 min,弃染色反应液;每孔每次加入100 μL PBS清洗1~3次;染色完成后,荧光显微镜拍照。
1.2.7流式检测细胞周期和凋亡 细胞接种于6孔板,按照基因敲降阴性对照组(sh-Control)、基因敲降组(sh-EZH2)、基因过表达对照组(OV-Control)、基因过表达组(OV-EZH2)4组细胞培养48 h后,0.25%胰酶消化收集细胞,并用1 mL PBS清洗剩余细胞1次,全部加入15 mL管中。800 r/min离心5 min,去除上清液,加5 mL PBS重悬细胞,再次离心弃上清液,重复2次,最后重悬细胞于0.1 mL PBS中,并转移到1.5 mL离心管中。对于细胞周期检测,按照1∶100加入碘化丙啶(PI)染液,置于垂直混合液上室温孵育1 h。对于细胞凋亡检测,每样品中分别加入5 μL PI染液和5 μL磷脂结合蛋白(Annexin-V-FITC)染液,置于垂直混合液上室温孵育30 min,1 500 r/min离心5 min,去除上清液,加1 mL PBS重悬细胞,再次800×g离心5 min,弃上清液,重复3次,最后将洗好的细胞重悬于0.2 mL PBS中。用锡箔纸包住避光,将细胞加入流式管中,在BD流式细胞仪上分析。
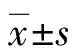
2 结 果
2.1过表达和敲降稳转株的构建及鉴定 4种慢病毒转染NSCs后,利用嘌呤霉素进行药物筛选,14 d后,细胞GFP阳性率达到100%(图1A)。同时,实验结果显示,相较于OV-Control组,OV-EZH2 mRNA EZH2的表达水平上调400%以上,且差异有统计学意义(P<0.05,图1B),相较于sh-Control组,sh-EZH2组EZH2 mRNA表达水平下调至30%以下,且差异有统计学意义(P<0.05,图1B)。Western blot得到一致的实验结果(图1C)。
A:细胞GFP荧光显微镜拍照(×40);B:EZH2基因mRNA表达水平鉴定(n=4);C:EZH2基因蛋白表达水平鉴定;a:P<0.05,与OV-Control组比较,b:P<0.05,与sh-Control组比较
图1EZH2基因过表达和敲降细胞稳转构建鉴定
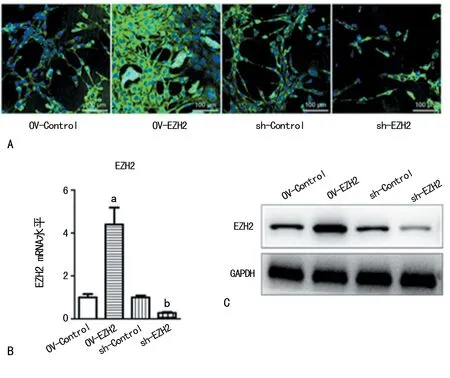
A:过表达和敲降细胞EZH2基因,CCK8检测细胞活力(n=4); B:试剂盒检测神经干细胞中EdU阳性率,激光共聚焦拍照(×40);C:神经干细胞中EdU阳性率统计图(n=4);a:P<0.05,与OV-Control组比较,b:P<0.05,与sh-Control组比较
图2敲降或过表达EZH2对神经干细胞增殖的影响
2.2过表达或敲降EZH2对NSCs增殖的影响 实验结果显示,对比OV-Control组,OV-EZH2组24、48、72 h时细胞增殖活力上调,差异有统计学意义(P<0.05,图2A)。OV-EZH2组EdU阳性率(69.21±9.86)%高于OV-Control组(37.00±2.70)%,差异有统计学意义(P<0.05,图2B、C)。相较于sh-Control组,sh-EZH2组24、48、72 h时细胞增殖活力显著下调(P<0.05,图2A),且sh-EZH2组细胞EdU阳性率(16.83±5.53)%比sh-Control组(43.52±5.99)%显著下调(P<0.05,图2B、C)。
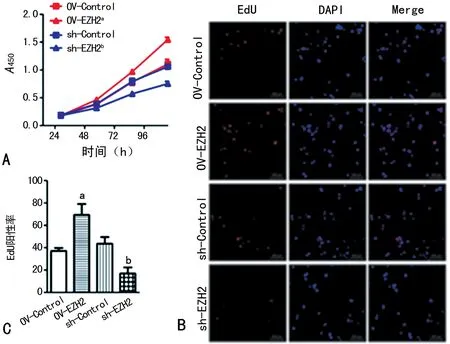
2.3过表EZH2或干扰EZH2表达对NSCs细胞周期的影响 实验结果显示,相较于基因敲降阴性对照组(sh-Control),EZH2干扰(sh-EZH2)组细胞处于G1期细胞比例显著上调(图3、表1,P<0.05),而S期和G2期细胞比例显著降低(图3、表1,P<0.05)。反过来,研究中利用慢病毒对EZH2基因进行过表达,相较于对照组(OV-Control),在NSCs中EZH2过表达后(OV-EZH2),G1期细胞比例显著下降(图3、表1,P<0.05),而S期和G2期细胞比例显著上升(图3、表1,P<0.05)。
2.4体外过表达EZH2或沉默EZH2表达对NSCs凋亡的影响 研究结果显示,EZH2干扰组和EZH2过表达组与其各自对照组相比,OV-Control组凋亡率为(5.97±0.15)%,OV-EZH2组凋亡率为(5.71±0.27)%,两者之间差异无统计学意义(P>0.05);sh-Control组凋亡率为(5.74±0.19)%,sh-EZH2组凋亡率为(5.41±0.31)%,且两组间差异无统计学意义(P>0.05),见图4。

表1 过表EZH2或干扰EZH2表达对神经干细胞细胞周期的影响
a:P<0.05,与OV-Control组比较;b:P<0.05,与sh-Control组比较
图3 过表EZH2或干扰EZH2表达对NSCs细胞周期的影响
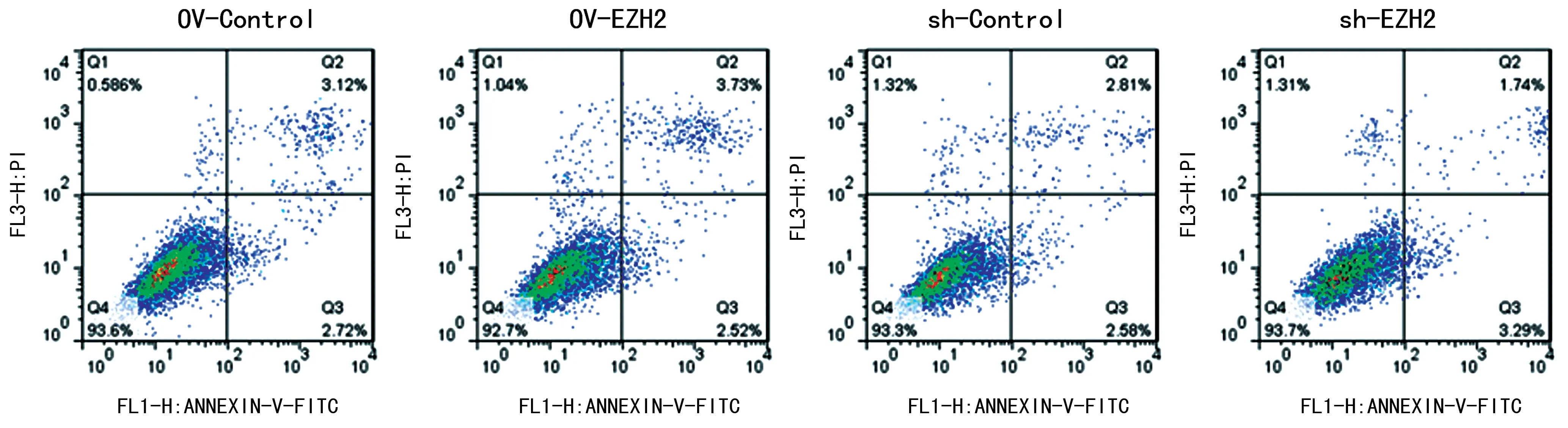
图4 体外过表达EZH2或沉默EZH2表达对NSCs凋亡的影响
2.5在NSCs中过表达EZH2能上调CyclinD1和c-Myc蛋白表达 通过Western blot发现,过表达EZH2基因(P<0.05)之后,Cyclin D1和c-Myc蛋白的表达水平也随之上调,且差异有统计学意义(P<0.05),见图5。
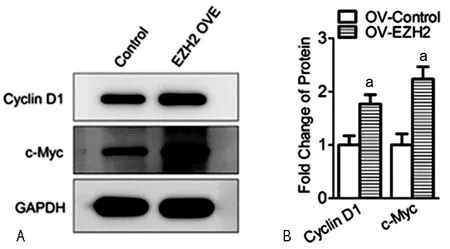
A:Western blot实验代表图;B:Western blot条带灰度统计分析图;a:P<0.05,与OV-Control组比较;n=4
图5EZH2基因过表达对CyclinD1和c-Myc蛋白表达水平的影响
3 讨 论
NSCs移植是临床上将NSCs移植到宿主体内,使NSCs向相关病变部位聚集并增殖存活,进而分化为神经功能细胞,达到神经系统疾病治疗目的的方法。近年来,NSCs研究成为治疗诸如脊髓损伤等神经系统疾病的热点手段[6]。但是,胚胎性NSCs可自动发生分化,具有无限增殖能力,移植至患者体内有致瘤的可能[7]。另外移植的环境可能与NSCs原本的生存条件不同,不利于NSCs的存活及分化[8]。因此如何控制NSCs的增殖,既能保证移植细胞的存活率和自我更新能力,又能控制其增殖速度和分化时间节点,是目前该治疗手段亟待解决的问题。因而本研究采取慢病毒手段,在NSCs中稳定过表达和敲降EZH2基因的表达,对其在NSCs增殖中的作用及其机制进行研究,意图寻找到调控NSCs移植中控制细胞增殖和分化的钥匙。
EZH2作为PCR2的催化亚基,能抑制转录,进而影响到下游重要的信号通路,在染色体水平调节基因活性,在干细胞的更新与维持中发挥重要作用[9-10]。有研究观察到,NSCs向不同方向增殖分化时,EZH2表达水平存在明显差异[11-12]:增殖的NSCs中高度表达,在NSCs向神经元细胞分化时,EZH2表达水平降低,在NSCs向星形胶质细胞分化时,EZH2表达完全停止,在NSCs向少突胶质细胞分化过程中,从少突胶质前体细胞分化到不成熟少突胶质细胞期间,EZH2维持高水平表达[13]。在本研究中,成功过表达和干扰EZH2基因的表达之后,分别能够促进和抑制NSCs的增殖,影响细胞进入细胞周期的速度,而对细胞凋亡水平并未见显著影响;因而设法调节移植NSCs中EZH2基因的表达可以起到调控NSCs增殖的作用。另外,进一步的研究还发现,过表达EZH2基因,能够促进增殖相关蛋白Cyclin D1和c-Myc的表达,这可能是其调控细胞增殖潜在的分子机制,而具体的信号途径还需要进一步的分析和研究。
本实验结果表明,EZH2能够在体外调控NSCs的增殖,为临床细胞学治疗脊髓损伤及相关疾病提供了实验依据。
