黔产毛蒟挥发油对油酸致大鼠急性肺损伤的影响及其机制
2019-05-30丁雁南
丁雁南,杨 艳,李 姣
1遵义医学院药学院,遵义 563099;2遵义医学院附属医院药剂科,遵义 563003
毛蒟Piperpuberulum(Benth.) Maxim是一种胡椒科胡椒属植物,具有芳香气味,其普遍含有挥发油[1]。有研究表明胡椒根挥发油在镇痛、抗炎和镇静中具有重要作用[2],然而目前关于黔产毛蒟挥发油的抗炎活性还缺乏相关研究。急性肺损伤主要是由于机体在受到严重创伤、感染、休克等打击后发生的肺毛细血管内皮细胞和肺泡上皮细胞损伤,导致肺泡和肺间质的水肿,进而发生进行性低氧血症或呼吸衰竭[3]。急性肺损伤后机体内的肺泡巨噬细胞脂肪含量会明显增加,同时血液中油酸水平也会发生明显升高[4-7]。在急性肺损伤模型中多采用油酸诱导的急性肺损伤[8]。有研究显示,p38MAPK信号通路在脂多糖、高氧以及油酸等诱导的动物肺损伤中起着重要作用[9]。p38MAPK 信号通路和炎症反应有着密切关系,炎症刺激可激活p38MAPK,而p38MAPK也可以调节 TNF-α、IL-1、IL-6 等致炎因子与 IL-12 等抗炎因子的生成,影响生物体内致炎与抗炎因素的平衡,从而决定炎症进程。故本实验采用油酸诱导大鼠急性肺损伤模型,观察炎性介质、肺血管通透性指标、p38MAPK信号通路等指标的变化以及采用黔产毛蒟挥发油干预后对其产生的影响,探讨黔产毛蒟挥发油对油酸致大鼠急性肺损伤的影响及其机制,并为临床上急性肺损伤的防治提供理论依据。
1 材料和方法
1.1 试验药物
黔产毛蒟由遵义医学院生药学教研室杨建文教授鉴别,黔产毛蒟挥发油由遵义医学院药剂学教研室自制。称取经粉碎的黔产毛蒟药材适量,置于圆底烧瓶中,按一定料液比(药材质量/去离子水体积,g/mL)加入去离子水和沸石若干,摇匀,浸泡一定的时间。连接好挥发油提取器及球形冷凝管,从冷凝管的上端加水至挥发油提取器中,直至充满蒸馏水并几乎溢流到圆底烧瓶为止。打开控温电热套进行加热,加热至第1 滴液滴从冷凝管管口滴下时开始计时,并始终保持微沸。微沸一定时间后停止加热,放置片刻,开启挥发油提取器下端的活塞,将水缓缓加入到油层下端至0 刻度线上5 mm处,再放置一段时间,继续放水使油层下降到下端与0 刻度线平行,准确读取挥发油的体积。收集该挥发油,用无水硫酸钠脱水,置于-18 ℃冰箱中保存,备用。计算挥发油的提取率。
挥发油提取率(%)=毛蒟挥发油体积(mL)/毛蒟质量(g)×100%
1.2 动物
清洁级雄性成年SD大鼠,由第三军医大学动物实验中心提供,体重为220±20 g,动物合格证号:002569。实验动物被安置在一个12 h的光线与黑暗循环交替的温度控制的环境,按实验室标准自由地随意饮食和水。实验由第三军医大学动物管理与使用委员会批准,并遵照实验动物管理与使用指南进行。
1.3 试剂
油酸购于Sigma-Aldrich(St.Louis,MO)(批号:1001154572);大鼠TNF-α酶联免疫法试剂盒(批号:206384725);考马斯亮蓝法蛋白测定试剂盒(批号:206393763)和Polink-2plus免疫组化检测试剂盒(批号:206374335)购自碧云天生物技术有限公司。兔抗p38MAPK(批号:109535);p-p38MAPK(批号:109243)和山羊抗GAPDH多克隆抗体(批号:109724)购自美国Abcam公司。
1.4 仪器
721型紫外-可见分光光度计(中国上海申化仪表自控公司);-80 °C低温冰柜(德国Forma Scientic公司);Milli QA纯水处理器(美国Millipore公司);3K30型高速冷冻离心机(德国Sigma公司);电子分析天平(中国北京赛多利斯电子天平有限公司)、凝胶成像仪(美国BioRad公司);转移槽(美国Bio-Rad公司);蛋白电泳槽(美国Bio-Rad公司)。
1.5 方法
1.5.1 动物模型和分组
将SD大鼠按照体重随机分为5组,每组为10只。对照组:经右侧颈静脉注入生理盐水(normal saline,NS) 0.2 mL/kg,30 min后再注射NS 0.2 mL/kg。油酸组:经右侧颈静脉注入油酸0.2 mL/kg,复制大鼠急性肺损伤模型,建模前30分钟从静脉注射NS(剂量与毛蒟挥发油组中的毛蒟挥发油的液体剂量一致)。毛蒟挥发油组(0.125、0.25、0.5 mL/kg):经右颈静脉注射油酸0.2 mL/kg建立急性肺损伤模型前30 min,根据不同分组从颈静脉注入毛蒟挥发油0.125、0.25、0.5 mL/kg。动物于实验8 h前禁食,4 h前禁水,3.5%水合氯醛溶液1 mL/100 g腹腔注射麻醉,麻醉成功后经右颈静脉注入油酸建模,3组实验动物均于建立模型后4 h颈动脉放血处死,采集血标本进行血气分析。
1.5.2 血气分析和呼吸频率测定
采用NOVA血气分析仪检测各组大鼠中动脉血血气分析值,包括pH、PaCO2和PaO2等。
1.5.3 右下肺湿干重比值和肺系数的测定
在处死大鼠后,取出肺脏并称重,肺系数=肺重量/体重×100%;然后将右下肺置于80 ℃的恒温烤箱烘烤3天后称重,右下肺湿干重比值=右下肺湿重/干重。
1.5.4 肺通透指数测定
在处死大鼠后,留取血清标本并测量其蛋白含量,然后收集支气管肺泡灌洗液,并采用考马斯亮蓝法测定其蛋白含量,肺通透指数=支气管肺泡灌洗液蛋白/血清蛋白。
1.5.5 支气管肺泡灌洗液中TNF-α、IL-6和IL-1β炎症因子含量的测定
采用ELISA法检测支气管肺泡灌洗液中TNF-α、IL-6和IL-1β炎症因子的水平,在收集各组支气管肺泡灌洗液后,使用ELISA试剂盒检测各炎症因子的浓度,并严格按照试剂盒使用说明书操作,并使用酶标仪检测于450 nm的吸光值,并根据标准曲线计算支气管肺泡灌洗液中TNF-α、IL-6和IL-1β的浓度。
1.5.6 病理学检测
将大鼠右肺上叶取出后,采用生理盐水漂洗,4%多聚甲醛固定,48 h后进行脱水、石蜡包埋、切片制成5 μm厚度切片,经脱蜡按照苏木精-伊红染色步骤染色后于光学显微镜下观察肺组织的病理学形态改变并拍照。
1.5.7 肺组织p-p38MAPK免疫组化测定
肺组织切片、3% H2O2孵育10分钟,PBS冲洗、加入兔抗p-p38MAPK一抗(1∶50),4 ℃过夜,加入HRP标记抗兔IgG二抗,37 ℃孵育20 min,DAB显色,然后采用苏木素复染、脱水、透明、封片。
1.5.8 Western blot
取肺组织100 mg,加入2 mL单去污剂细胞裂解液,离心后取上清。采用考马斯亮蓝法检测蛋白浓度后进行免疫印迹检测。兔抗p-p38MAPK和p38MAPK为一抗(1∶50)。采用Quantity one ChemiDocXRS系统进行图像采集和分析。
1.6 统计学处理
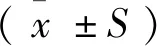
2 结果
2.1 血气分析和呼吸频率的测定
与对照组相比,油酸组大鼠呼吸频率增快,PaO2及氧合指数均降低(P<0.01);毛蒟挥发油组相比油酸组PaO2及氧合指数均明显升高(P<0.01)。这说明毛蒟挥发油组有明显的肺保护作用。详见表1。
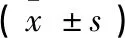
表1 各组大鼠RR,PaO2和PaO2/FiO2比较
注:与模型组比较**P<0.01 (下同)。
Note:Compare with volatile oil model group,**P< 0.01(similarly hereinafter).
2.2 右下肺湿干重比、肺系数和通透指数的比较
油酸组中右下肺湿干重比、肺系数和肺通透指数比对照组均明显增加(P<0.01)。毛蒟挥发油组相比油酸组右下肺湿干重比、肺系数和肺通透指数均明显减少(P<0.01)(见表2)。
2.3 支气管肺泡灌洗液中炎症因子含量的比较
油酸组支气管肺泡灌洗液中TNF-α、IL-6和IL-1β炎症因子含量较对照组明显升高(P<0.01);毛蒟挥发油组相比油酸组肺泡灌洗液中TNF-α、IL-6和IL-1β炎症因子含量明显下降(P<0.01)(见表3)。
2.4 肺组织病理学改变
与对照组比较,油酸组光镜下可见明显肺泡和肺间质水肿、中性粒细胞浸润和肺组织结构破坏,然而在毛蒟挥发油组(0.125 mL/kg)中可见其肺泡和肺间质水肿、中性粒细胞浸润和肺组织结构破坏均明显减轻(见图1)。

表2 各组大鼠右下肺湿干重比值和肺系数的比较
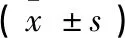
表3 各组大鼠BALF中TNF-α、IL-6和IL-1β含量的比较
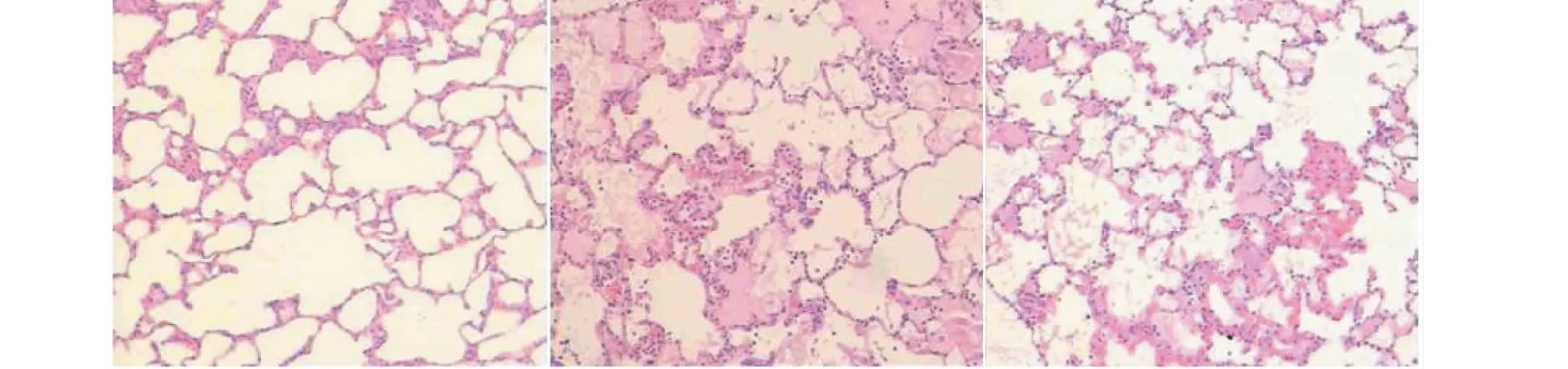
图1 肺组织病理改变(HE×100)Fig.1 Histopathological changes of lung tissue in three groups(HE×100),注:A为对照组,B为油酸组,C为毛蒟挥发油组(0.125 mL/kg)。Note:(A)Control group,(B)Oleic acid model group,(C) volatile oil group(0.125 mL/kg).
2.5 肺组织p-p38MAPK免疫组化改变
p-p38MAPK蛋白阳性反应在细胞胞核和胞浆中均有染色。在对照组中主要分布在气道粘膜上皮和肺泡上皮细胞且阳性细胞少,详见图2A和2B;在油酸组中主要分布在气道粘膜上皮、肺泡上皮细胞、炎症细胞、内皮血管细胞等且阳性细胞多,详见图2C和2D;在毛蒟挥发油组(0.125 mL/kg)中阳性细胞较油酸组则明显减少(见图2E和2F)。
2.6 Western blot测定肺组织p38MAPK蛋白表达
油酸组p-p38MAPK蛋白相对表达量较对照组明显升高(P<0.01);毛蒟挥发油组相比油酸组p-p38MAPK蛋白相对表达量明显下降(P<0.01);各组间p38MAPK蛋白相对表达量无明显差异(P>0.05)(见表4,图3)。
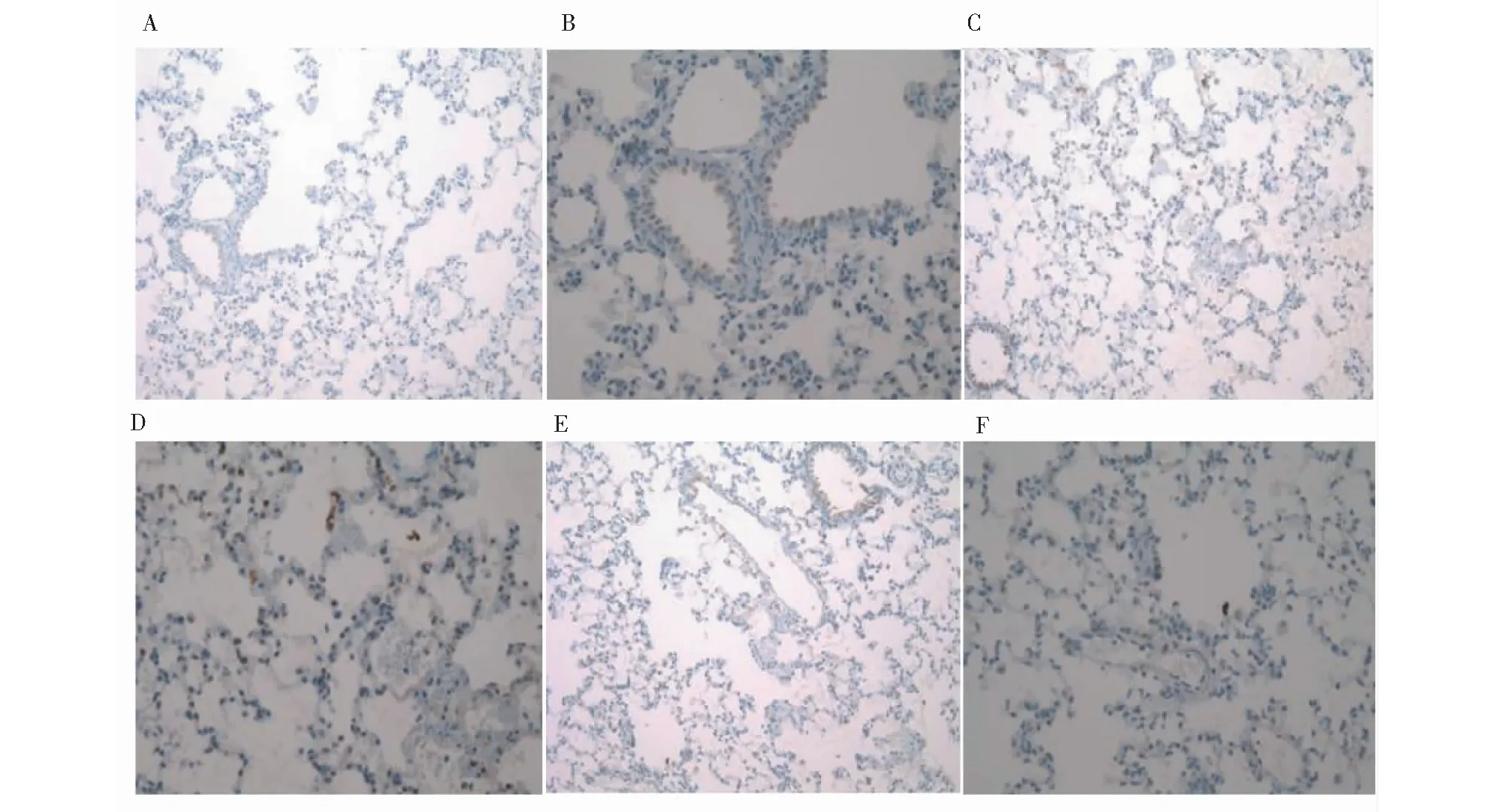
图2 肺组织p-p38MAPK免疫组化改变(A、C、E:IHC×200;B、D、F:IHC×400)Fig.2 Immunohistochemistry of lung tissue in three groups (A,C,E:IHC×200;B,D,F:IHC×400),注:A和B为对照组,C和D为油酸组,E和F为毛蒟挥发油组(0.125 mL/kg)。Note:(A and B) Control group,(C and D) Oleic acid model group (E and F),volatile oil group (0.125 mL/kg).

表4 各组大鼠肺组织p-P38MAPK相对含量比较

图3 各组大鼠肺组织p-p38MAPK相对含量比较(p-p38MAPK/p38MAPK)Fig.3 The protein level of p38MAPK and p-p38MAPK in lung tissues
3 讨论
油酸模型是急性肺损伤的经典模型,能够在病因上模拟肺损伤情况[10]。本研究结果中,与对照组相比,大鼠颈静脉注入油酸后出现了一系列病理变化,包括呼吸频率明显增快以及光镜下显微结构的明显改变,在血气分析方面,油酸组PaO2明显下降,肺湿干重比值则明显升高,以上结果与文献报道[11]相符,说明成功建立油酸诱导急性肺损伤动物模型。
急性肺损伤在早期变化主要是肺泡上皮细胞和肺血管内皮细胞的损伤导致对蛋白和液体的通透性增强,从而发生肺泡内外液体失衡。有研究显示这种通透性增强和肺血管内皮细胞的损伤密切相关。肺通透指数作为评价急性肺损伤肺泡水肿和肺损伤的重要指标[12]。在本研究中油酸模型组肺通透指数、肺湿干重比值和肺系数较对照组有明显升高,这能够体现油酸能够增加肺血管通透性和肺水肿情况。
急性肺损伤中的炎症反应和肺功能以及内皮细胞损伤密切相关。在致炎因素的刺激下,机体中炎症细胞被激活,并促进TNF-α、IL-6和IL-1β等炎症因子的释放。TNF-α能够介导中性粒细胞活化,并进一步促进炎症反应导致肺组织损伤[13]。在本研究中油酸组支气管肺泡灌洗液中TNF-α、IL-6和IL-1β炎症因子含量较对照组明显升高;毛蒟挥发油组相比油酸组肺泡灌洗液中TNF-α、IL-6和IL-1β炎症因子含量明显下降。这说明毛蒟挥发油能够通过减少炎症因子的释放发挥肺损伤保护作用。
急性肺损伤和机体内多种信号通路的传导有关,其中p38MAPK通路作为重要的炎症通路在急性肺损伤中也发挥着重要作用[14]。研究显示p38MAPK能够被多种炎症因子、脂多糖、油酸、蛋白合成抑制剂、应激刺激和细菌病原体等激活,然后参与细胞的炎症反应、免疫调节和细胞凋亡[15]。Liu[16]等研究表明SB203580能够通过NF-κB通路减轻了脂多糖诱导的动物肺损伤。
本研究中免疫组化结果显示油酸组中p-p38MAPK蛋白阳性反应主要分布在气道粘膜上皮、肺泡上皮细胞、炎症细胞、内皮血管细胞等且阳性细胞多, 在毛蒟挥发油组中阳性细胞较油酸组则明显减少。同时免疫印迹结果发现油酸组p-p38MAPK蛋白相对表达量较对照组明显升高;毛蒟挥发油组相比油酸组p-p38MAPK蛋白相对表达量明显下降。同时毛蒟挥发油组相比油酸组右下肺湿干重比、肺系数和肺通透指数均明显减少。这说明黔产毛蒟挥发油对油酸型急性肺损伤有较好的肺保护作用;黔产毛蒟挥发油明显减少油酸型急性肺损伤大鼠肺组织中的TNF-α、IL-6和IL-1β水平,表明油酸型急性肺损伤中,p38MAPK磷酸化参与了炎症因子的表达,促进了肺损伤。
在外界因素的刺激下MAPKKK-MAPKK -MAPK能够启动细胞内信号传导,介导ERK、蛋白酪氨酸激酶和p38丝裂原活化蛋白激酶的活化,进而促进TNF-α、IL-6和IL-1β等多种炎症因子的释放[17]。在本研究中油酸能够激活肺损伤中肺细胞p38MAPK信号通路,然后促进多种炎症因子释放,而黔产毛蒟挥发油能够通过阻滞p38MAPK信号通路进而减少炎症因子释放并发挥肺损伤保护作用。
总之,在油酸型急性肺损伤中,p38MAPK磷酸化明显增加,采用黔产毛蒟挥发油治疗后能够明显抑制p38MAPK的磷酸化,抑制肺损伤组织的炎症因子TNF-α、IL-6和IL-1β的释放,减轻肺血管内皮细胞的损伤,对油酸型急性肺损伤有显著的肺保护作用,表明黔产毛蒟挥发油通过抑制p38MAPK通路发挥作用。
