建立矮膜苞芹HPLC指纹图谱
2019-05-30胡江兰朱金芳帕尔哈提多力坤
胡江兰,朱金芳,2,帕尔哈提·多力坤
(1.新疆农业大学食品科学与药学学院,乌鲁木齐 830052;2.中国科学院新疆理化技术研究所,乌鲁木齐 830011)
0 引 言
【研究意义】矮膜苞芹(HymenoleanananaRupr.),又名膜苞棱子芹、天山棱子芹,俗名库鲁木提,为伞形科(Umbelliferae)棱子芹属(Pleurospermum)高山膜苞芹亚属(HymenoleanaDC)多年生草本植物[1,2]。主要分布于中国新疆塔什库尔干、和田及天山地区,中亚也有分布[3,4]。矮膜苞芹富含多种对人体有益的成分,防治高血压[5]、糖尿病[6]、冠心病、脑血栓等疾病。研究其指纹图谱,对进一步开发利用矮膜苞芹药材资源有实际意义。【前人研究进展】中药指纹图谱因其能够全面直观的反应中药材活性成分的种类及数量,宏观、系统的反应中药材的内在质量,目前是国际公认的控制中药材质量有效手段。近年来,研究发现矮膜苞芹含有黄酮、挥发油、甾体、强心苷、三萜类、皂苷、酚类、糖类、香豆素等成分[7]。【本研究切入点】矮膜苞芹为生长在海拔4 000 m以上的珍稀药材,目前关于矮膜苞芹研究的相关文献较少,对于其指纹图谱的研究在国内尚未见报道。指纹图谱的建立对药材人工繁育、筛选优良种质资源、全面控制药材质量显得尤为重要。目前,尚未见其指纹图谱方面的研究报道。研究建立矮膜苞芹HPLC指纹图谱。【拟解决的关键问题】采用高效液相色谱法(HPLC),通过梯度洗脱,研究10批药材的HPLC图,运用2012.1A版中药色谱指纹相似度评价系统软件分析相似度、SPSS19.0软件进行聚类分析及SIMCA14.0软件进行主成分(PCA)与偏最小二乘法-判别分析(PLS-DA),建立矮膜苞芹的HPLC指纹图谱,为矮膜苞芹药材的全面质量控制奠定基础。
1 材料与方法
1.1 材 料
1.1.1 材料
木犀草素(批号:130610,购于上海融禾医药科技发展有限公司,纯度≥98%)、黄芩苷(批号:21967,购于成都曼斯特生物科技有限公司,纯度≥ 98%),乙腈为色谱纯,甲酸、甲醇均为分析纯,水为纯净水。矮膜苞芹(采自新疆塔什库尔干塔吉克自治县)经新疆医科大学中医学院盛萍教授鉴定为伞形科植物矮膜苞芹的干燥地上部分。10批药材均为生长在高原高寒干旱-半干旱气候的塔什库尔干野生品种,采集时间分别为S1(20150922),S2(20160730),S3(20170325),S4(20170622),S5(20171110),S6(20180312),S7(20180405),S8(20180512),S9(20180809),S10(20180824),其中S3(20170325)和S4(20170622)采自慕士塔格峰,海拔为6 000 m,其他批次均采自塔什库尔干塔吉克自治县,海拔为4 500 m。
1.1.2 仪器
LC-20A高效液相色谱仪(日本岛津公司);AL 104型精密电子天平(梅特勒-托利多仪器上海有限公司);TG16-W微量高速离心机;HH-S型电热恒温水浴锅(江苏省金坛市医疗仪器厂)。
1.1.3 色谱条件
采用WondaCract ODS-2 C18色谱柱(4.6 mm×250 mm,5 μm),流动相乙腈(A): 0.1%甲酸水(B)梯度洗脱(0~30 min,15%~30% A;30~45 min,30%~70% A;45~55 min,70% A;55~65 min,70%~15% A);流速1.0 mL/min,柱温30℃,检测波长283 nm,进样量10 μL。
1.2 方 法
1.2.1 供试品溶液制备
取矮膜苞芹药材粉末约1 g,精密称定,加入20 mL甲醇称定重量,于70℃加热回流2 h,用甲醇补足损失的重量,滤过,取续滤液,即得。
1.2.2 对照品溶液制备
分别精密称取各对照品适量,分别置于不同的5 mL容量瓶中,加甲醇溶解定容,作为对照品贮备液,于4℃冰箱保存备用。
1.2.3 精密度试验
取S1药材粉末,按1.2.1方法制备供试品溶液,在其色谱条件下连续测定6次,共有峰相对保留时间RSD<0.5%,相对峰面积RSD<1.8%,仪器精密度良好。
1.2.4 稳定性试验
取S1药材粉末,按1.2.1方法制备供试品溶液,分别在溶液制备后的0、2、4、8、12、24 h进样测定。共有峰相对保留时间RSD< 0.9%,相对峰面积RSD< 2.0%,供试品溶液在室温下24 h内稳定。
1.2.5 重复性试验
取S1药材粉末6份,分别按1.2.1方法制备供试品溶液,在其色谱条件下分别进样分析。共有峰相对保留时间RSD< 1.0%,相对峰面积RSD< 1.8% ,该方法重复性好。
1.3 数据处理
应用《中药色谱指纹图谱相似度评价系统》(2012.1A)分析和绘制HPLC指纹图谱,运用SPSS19.0和SIMCA14.0进行聚类分析、主成分分析和偏最小二乘法-判别分析指纹图谱相关数据。
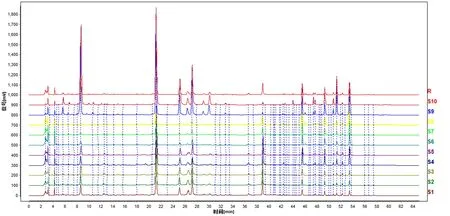
图1 10批矮膜苞芹药材的HPLC指纹谱
Fig.1 HPLC fingerprint of 10 batches ofHymenoleananana
2 结果与分析
2.1 指纹图谱采集
取10批矮膜苞芹药材,分别按1.2.1方法制备供试品溶液,按1.1.3色谱条件进样检测,得到各批次矮膜苞芹药材的HPLC图谱,以新采集的药材(S10)的指纹图谱为参照图谱,采用平均数相关系数法对各指纹图谱色谱峰进行多点校正和自动匹配,生成对照指纹图谱R,并建立10批矮膜苞芹药材的指纹图谱。图1
2.2 共有峰标定
根据10批药材指纹图谱的检测结果,利用中药色谱指纹图谱相似度评价系统的数据匹配功能,在对照指纹图谱上标定出共有色谱峰13个。经与对照品比对,确定5号峰和7号峰分别为黄芩苷和木犀草素。其中2号峰最高,且对称性和分离度均较好,故选择其作为参照峰(S),分别计算其他共有色谱峰的相对保留时间和相对峰面积。表1 ,表2
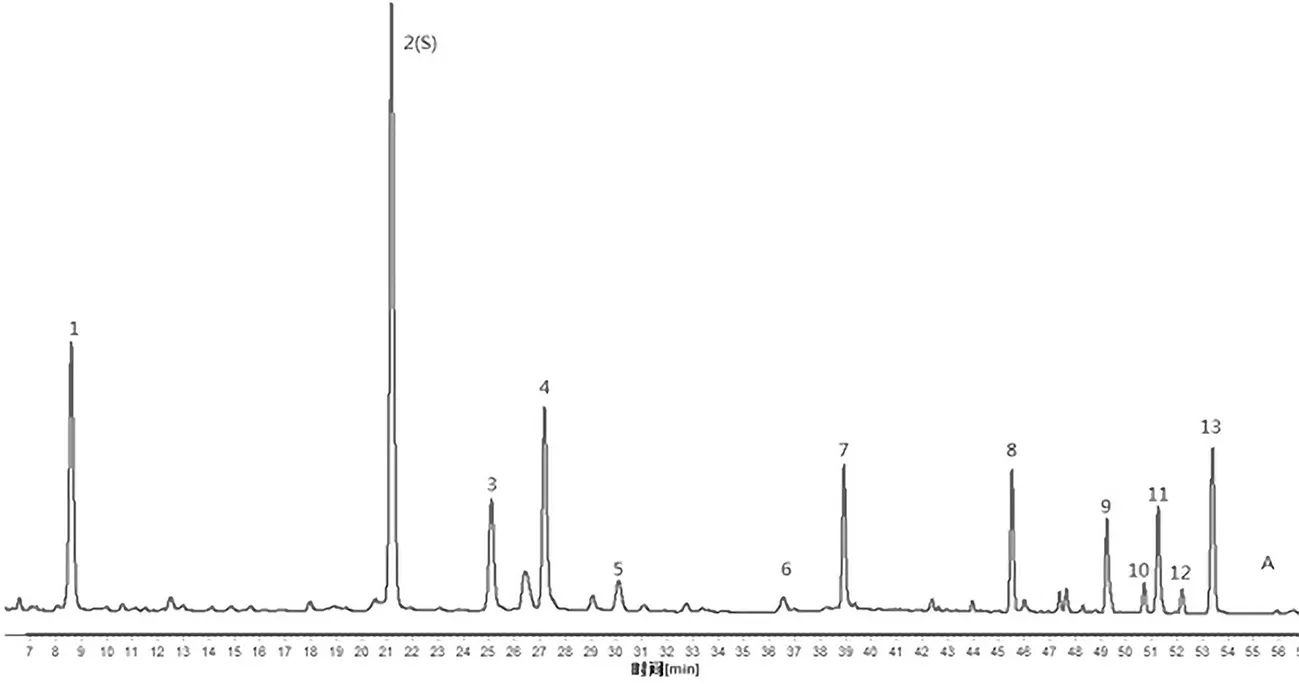
注:5.黄芩苷;7.木犀草素
Note: 5.Baicalin; 7.Luteolin
图2 矮膜苞芹药材对照特征谱(A)及混合对照品的特征谱(B)
Fig.2 Control characteristic chromatogram ofHymenoleananana(A) and characteristic chromatogram of mixed reference (B)表1 10批矮膜苞芹指纹图谱共有峰相对保留时间
Table 1 10 batches ofHymenoleanananafingerprint shared peak relative retention time
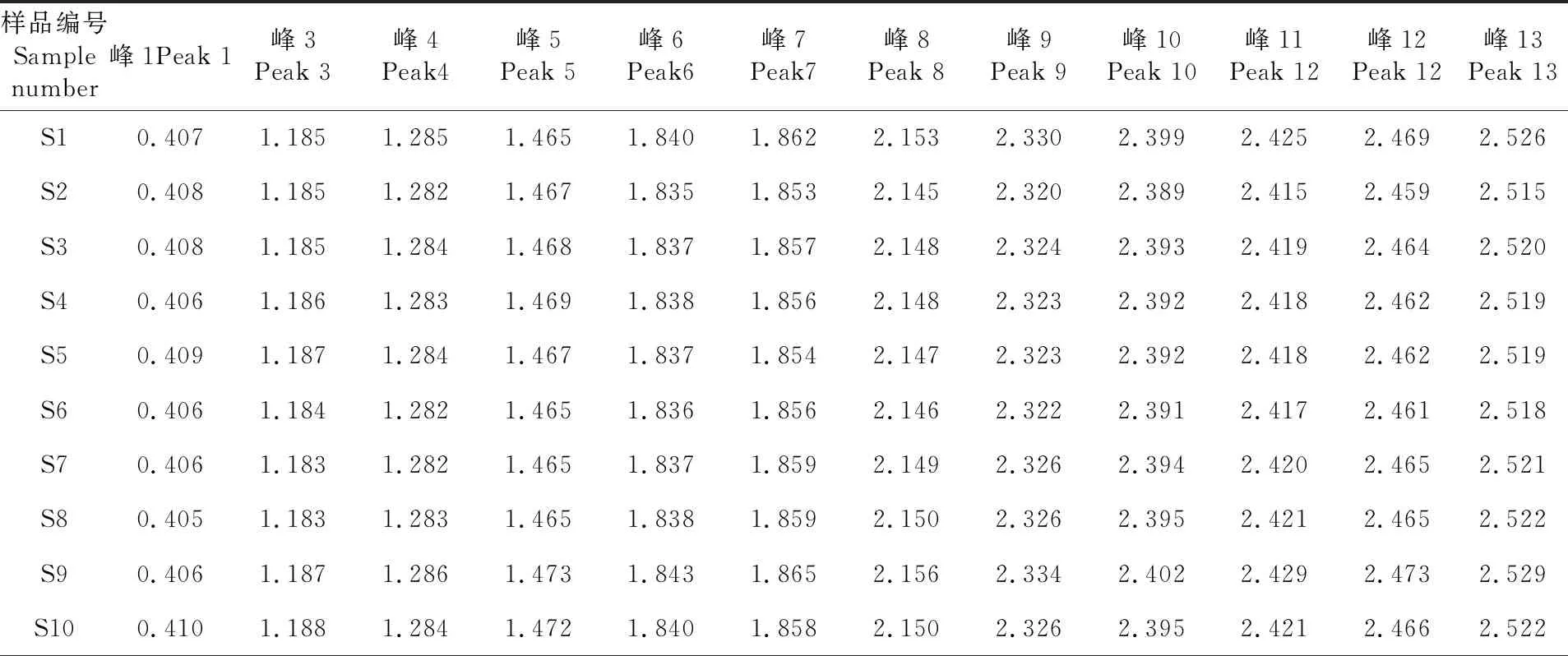
样品编号Sample number峰1Peak 1峰3Peak 3峰4Peak4峰5Peak 5峰6Peak6峰7Peak7峰8Peak 8峰9Peak 9峰10Peak 10峰11Peak 12峰12Peak 12峰13Peak 13S10.4071.1851.2851.4651.8401.8622.1532.3302.3992.4252.4692.526S20.4081.1851.2821.4671.8351.8532.1452.3202.3892.4152.4592.515S30.4081.1851.2841.4681.8371.8572.1482.3242.3932.4192.4642.520S40.4061.1861.2831.4691.8381.8562.1482.3232.3922.4182.4622.519S50.4091.1871.2841.4671.8371.8542.1472.3232.3922.4182.4622.519S60.4061.1841.2821.4651.8361.8562.1462.3222.3912.4172.4612.518S70.4061.1831.2821.4651.8371.8592.1492.3262.3942.4202.4652.521S80.4051.1831.2831.4651.8381.8592.1502.3262.3952.4212.4652.522S90.4061.1871.2861.4731.8431.8652.1562.3342.4022.4292.4732.529S100.4101.1881.2841.4721.8401.8582.1502.3262.3952.4212.4662.522
注:2号峰(S)均为1.000,表3同
Note: Peak 2 (S) is 1.000, the same as Table 3
表2 10批矮膜苞芹指纹图谱共有峰相对峰面积
Table 2 The relative peak area of the common peaks of 10 batches ofHymenoleananana
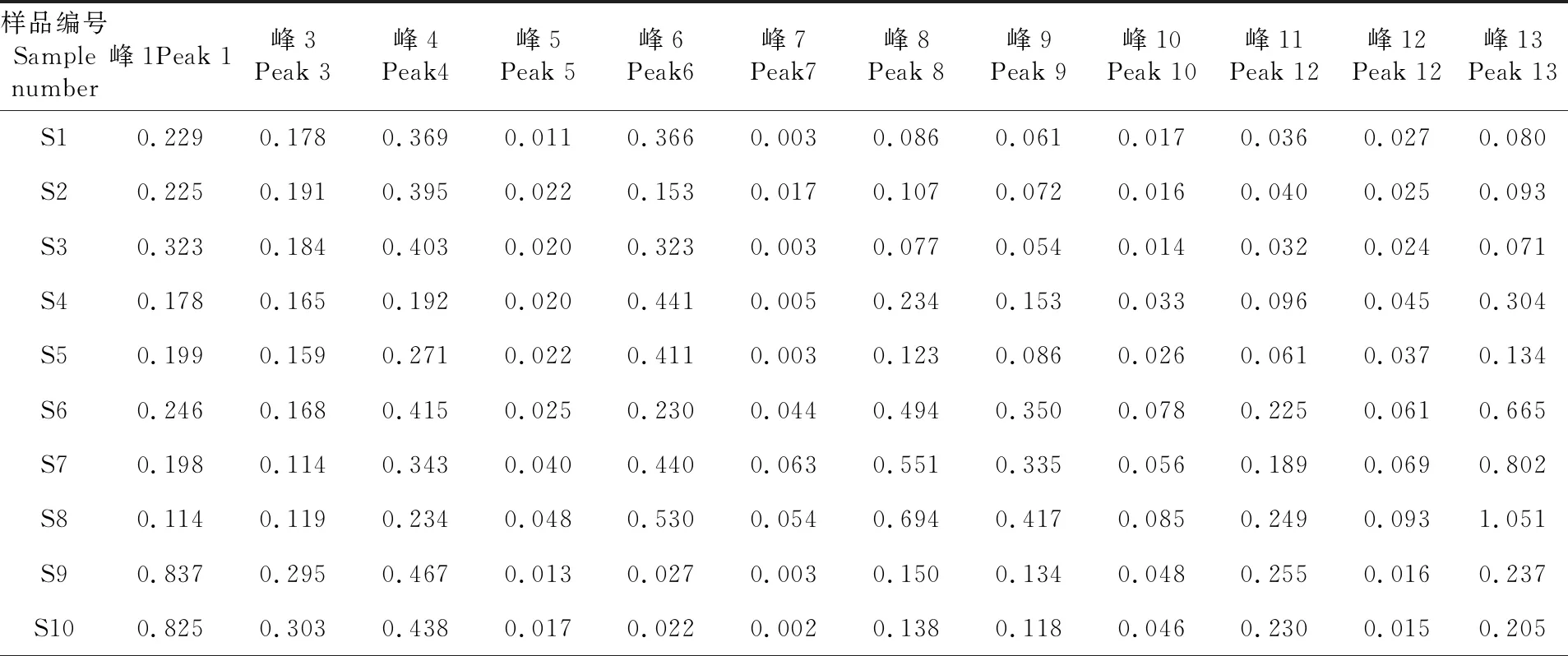
样品编号Sample number峰1Peak 1峰3Peak 3峰4Peak4峰5Peak 5峰6Peak6峰7Peak7峰8Peak 8峰9Peak 9峰10Peak 10峰11Peak 12峰12Peak 12峰13Peak 13S10.2290.1780.3690.0110.3660.0030.0860.0610.0170.0360.0270.080S20.2250.1910.3950.0220.1530.0170.1070.0720.0160.0400.0250.093S30.3230.1840.4030.0200.3230.0030.0770.0540.0140.0320.0240.071S40.1780.1650.1920.0200.4410.0050.2340.1530.0330.0960.0450.304S50.1990.1590.2710.0220.4110.0030.1230.0860.0260.0610.0370.134S60.2460.1680.4150.0250.2300.0440.4940.3500.0780.2250.0610.665S70.1980.1140.3430.0400.4400.0630.5510.3350.0560.1890.0690.802S80.1140.1190.2340.0480.5300.0540.6940.4170.0850.2490.0931.051S90.8370.2950.4670.0130.0270.0030.1500.1340.0480.2550.0160.237S100.8250.3030.4380.0170.0220.0020.1380.1180.0460.2300.0150.205
2.3 相似度评价
研究表明,相似度分析结果大致可以分为三类,第1类为S8,其相似度< 0.8;第2类为S6、S7,其相似度在0.8 ~ 0.9;第3类为S1、S2、S3、S4、S5、S9、S10,其相似度均>0.9。相似度结果表明,10批矮膜苞芹药材成分相似度较高,但S8的相似度较差。不同批次矮膜苞芹所含化学成分存在不同程度的差异,综合指纹图谱中各批次药材主要峰群,其峰形基本一致,只是成分含量略有不同。各批药材间相似度差异可能受采收时间、海拔、样品本身差异等多种因素影响。表3
表3 10批矮膜苞芹相似度评价
Table 3 Evaluation of similarity of 10 batches ofHymenoleananana
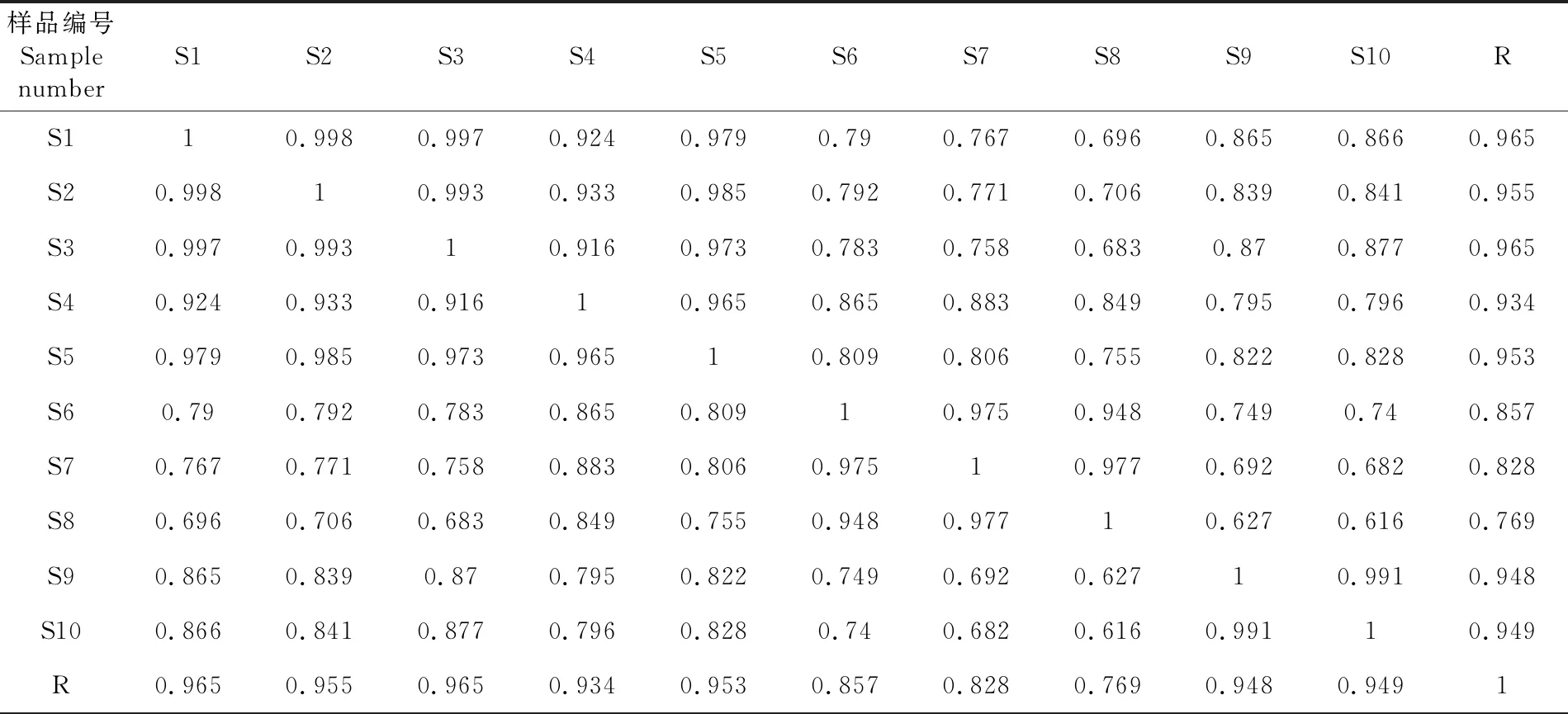
样品编号Sample numberS1S2S3S4S5S6S7S8S9S10RS110.9980.9970.9240.9790.790.7670.6960.8650.8660.965S20.99810.9930.9330.9850.7920.7710.7060.8390.8410.955S30.9970.99310.9160.9730.7830.7580.6830.870.8770.965S40.9240.9330.91610.9650.8650.8830.8490.7950.7960.934S50.9790.9850.9730.96510.8090.8060.7550.8220.8280.953S60.790.7920.7830.8650.80910.9750.9480.7490.740.857S70.7670.7710.7580.8830.8060.97510.9770.6920.6820.828S80.6960.7060.6830.8490.7550.9480.97710.6270.6160.769S90.8650.8390.870.7950.8220.7490.6920.62710.9910.948S100.8660.8410.8770.7960.8280.740.6820.6160.99110.949R0.9650.9550.9650.9340.9530.8570.8280.7690.9480.9491
2.4 药材指纹图谱聚类
研究表明,10批样品在距离25时被聚为1类。距离20 ~ 5时,聚为2类,其中S9、S10与其他批次分隔开,表明这两个批次差异性较大。距离5 ~ 0时,药材被依次分开。最终聚为3类,即S1、S2、S3、S4、S5聚为一类,S6、S7、S8聚为一类,S9、S10聚为一类。从药材来源分析,S1、S2、S3、S4和S5采集时间最早,储存时间最长;S9、S10为最近采集,储存时间最短;而S6、S7、S8采集时间较早,储存时间相对较长,矮膜苞芹药材质量可能受采收时间、储存条件等影响,需进一步研究。图3

图3 10批矮膜苞芹药材聚类分析树状图
Fig.3 10 batch ofHymenoleanananasquid cluster analysis tree diagram relationship
2.5 药材指纹图谱PCA及PLS-DA分析
研究表明,前2个主成分的特征值均大于1,说明前2个因子在药材共有成分的相互关系中起主导作用。其中,第一主成分方差贡献率为 64.95%;第二主成分方差贡献率为17.28%,累计方差贡献率为82.23%。表明前2个主成分能够客观得反映10批矮膜苞芹指纹图谱的信息,PCA得分分布。表明S9和S10与其他批次明显区分,但其他批次间无明显区分。PLS-DA模型的主成分回归系数Q2Y=0.598>0.5,说明模型的预测能力较强;R2Y=0.851 9,即模型对因变量变异贡献的百分比为85.19%,说明模型拟合度较好。PLS-DA分析结果,表明10批药材被明显区分为三类,即S1、S2、S3、S4、S5为一类,S6、S7、S8为一类,S9、S10为一类,与药材聚类分析结果吻合。图4,图5
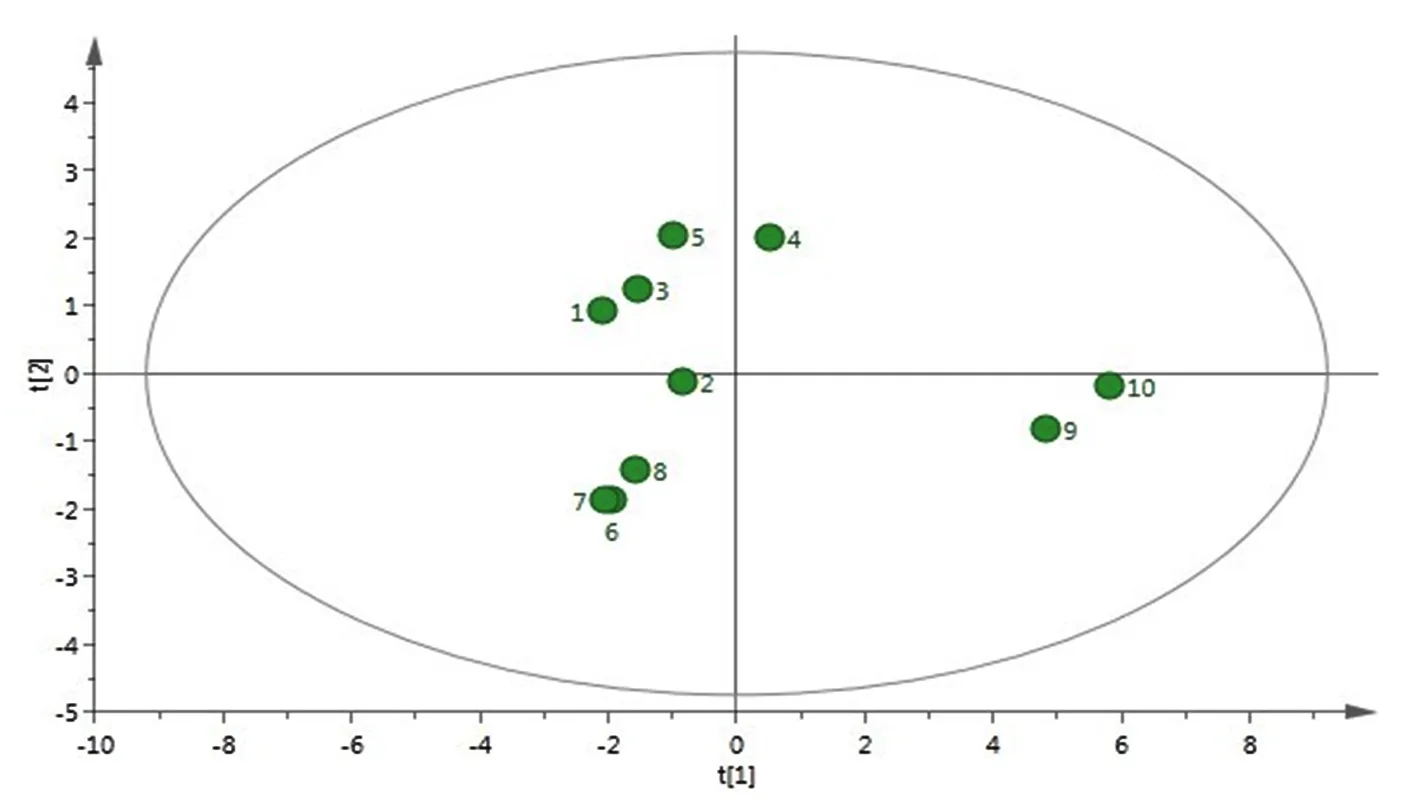
图4 PCA得分分布
Fig.4 Score plot of PCA

图5 PLS-DA得分分布
Fig.5 Score plot of PLS-DA
提取PLS-DA模型中13个变量的重要性投影(VIP)值,研究表明,对13个共有峰面积VIP值大小进行排列,VIP值越大说明该共有峰对分类的贡献越大[8]。选择VIP值大于1的共有峰,结果显示,峰2(VIP值:1.829),峰1(VIP值:1.487),峰13(VIP值:1.308),峰6(VIP值:1.194)和峰4(VIP值:1.111)VIP值均大于1,说明以上化学成分对不同批次矮膜苞芹药材分类具有显著影响,这些成分是引起不同批次药材差异的主要标志性成分。其余色谱峰VIP值小于1,对样品的区分影响较小。图6
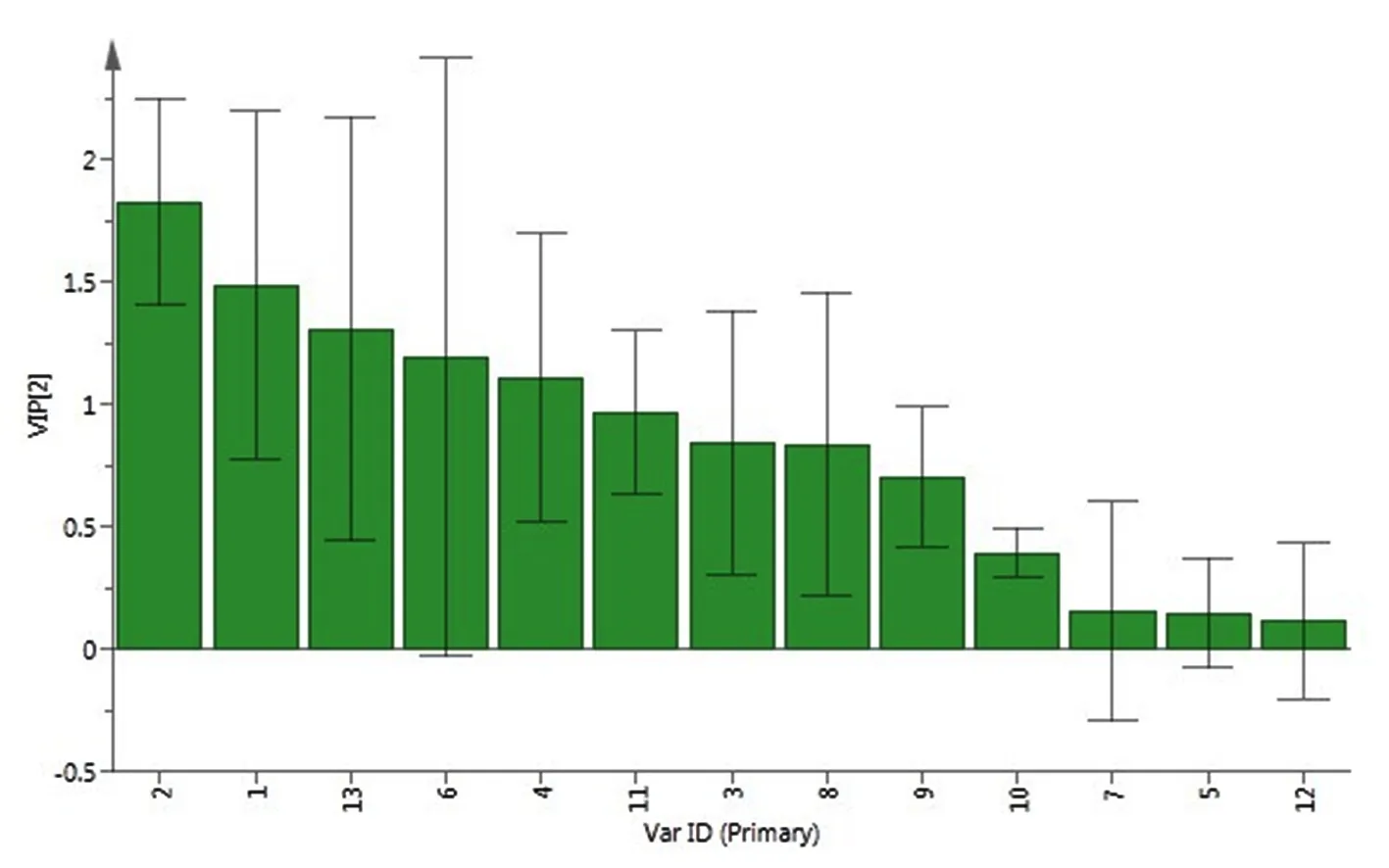
图6 各共有峰对药材分组VIP值
Fig.6 VIP value of each common peak grouped with herbs
3 讨 论
3.1 色谱条件选择
由于矮膜苞芹药材成分较为复杂,研究了甲醇-0.05%甲酸水、乙腈-0.05%甲酸水、乙腈-0.1%甲酸水等溶剂系统进行梯度洗脱[9-11],筛选最佳流动相;并对进样量5、10、20 μL进行了考察;应用二极管阵列检测器同时比较了254、283、340、350 nm不同波长下的色谱图信息[12-14],结果表明,以乙腈:0.1%甲酸水为流动相梯度洗脱,进样量为10 μL,在283 nm波长下,色谱图的色谱峰较多,分离度较好,各色谱峰对称性及拖尾因子均符合要求。
3.2 建立质量标准及其指纹图谱
建立的矮膜苞芹HPLC指纹图谱方法精密度、稳定性、重复性好。将指纹图谱数据与相似度评价、聚类分析及主成分分析相结合,结果表明不同批次的矮膜苞芹HPLC指纹图谱既有共性又有差异。各批次药材的色谱峰整体图谱相似,但峰面积又有所差异,表明不同因素对药材成分的含量有影响。研究表明,中药材主要活性成分含量测定,因其地域、品系、采样时期、加工方式、贮存时间等因素均会对试验结果有影响[15]。因此,各批次色谱峰峰面积有所差异分析可能原因是因气候、海拔、采收时间、储存时间、样品本身差异、采收方式等不同所导致。
4 结 论
建立了矮膜苞芹药材的HPLC指纹图谱,确定了13个共有峰。通过精密度、稳定性、重复性试验证明,该方法符合建立指纹图谱各项要求。运用相似度评价对建立的指纹图谱进行分析,发现不同批次药材质量相似性较好,采用聚类分析、主成分分析及偏最小二乘法-判别分析弥补了单纯应用相似度评价指纹图谱的不足,能够反映药材多成分的特点,整体控制矮膜苞芹药材的质量。
