3种虾肝肠胞虫PCR检测方法的应用比较分析
2019-05-30施礼科章秋虎郭水荣
叶 键,许 婷,施礼科,陈 凡,王 力,陈 喆,章秋虎,郭水荣
(1.杭州市水产技术推广总站,浙江 杭州 310017; 2.绍兴文理学院,浙江 绍兴 312000 )
虾肝肠胞虫(Enterocytozoonhepatopenaei)属微孢子虫科、肠胞虫属,是一种可感染多种真核生物的专性细胞内寄生虫。该病原最早于2004年作为一种未知微孢子虫在泰国生长缓慢的斑节对虾(Penaeusmonodon)肝胰腺小管上皮细胞内被发现[1],2009年在斑节对虾的肝胰腺内也发现了这种微孢子虫[2]。虾肝肠胞虫对世界各地的对虾养殖已造成不同程度的损害,泰国、越南、印度、印度尼西亚和马来西亚等地区养殖的斑节对虾、红额角对虾(P.stylirostris)和凡纳滨对虾(Litopenaeusvannamei)均有该寄生虫病发生的报道[2-8],我国广西[9]、浙江[10-11]、江苏[12]、天津[13]、辽宁[14]等地亦有该寄生虫检出的报道。目前普遍认为,养殖对虾生长迟缓与虾肝肠胞虫相关[13-16],但患病对虾并未停止摄食,空耗饲料、水电和人工等,由此造成的损失远大于对虾死亡。除垂直传播外,虾肝肠胞虫还可水平传播,包括经口摄食传播[7],或直接通过养殖水体在对虾中进行传播[17]。因其生物学特性,至今尚未找到能杀灭或是控制其发展的有效药物。因此,快速检测及诊断技术的建立,是从源头防控该病原感染的关键。
虾肝肠胞虫虫体较小,光学显微镜常规镜检难以发现,使用分子生物学技术手段是目前可行的且具备灵敏、特异、快速等特点的检测方法。针对虾肝肠胞虫检测的PCR方法主要有18S-PCR法[5]、SSU-PCR法[2]和SWP-PCR法[20],其中后两种检测方法为套式PCR方法,目前业内对使用哪种方法尚无定论,考虑到特异性,诸多学者更倾向于使用SWP-PCR法。为比较3种方法在生产中的检测效果,笔者采集不同来源的36个凡纳滨对虾苗种样本、5个卤虫(Artemia)样本及12个水体样本,分别进行检测验证,旨在为虾肝肠胞虫的实际检测提供参考。
1 材料与方法
1.1 材料
Premix ExTaq,PCR产物纯化试剂盒购自TaKaRa公司(日本),DNA抽提试剂盒购自Qiagen公司(德国);引物合成于上海生工,具体序列见表1。36个凡纳滨对虾苗种样本采集于杭州地区24个凡纳滨对虾淡化苗种场不同生产批次,标记为样本1~36,5个卤虫样本采集于杭州市凡纳滨对虾主养区5位养殖户所购商品化冰冻成体卤虫,标记为样本L1~L5,12个水样采集于杭州市凡纳滨对虾主养区外荡河道12个地理位点,标记为样本S1~S12。
1.2 DNA的提取
凡纳滨对虾苗种取全虾,卤虫取全虫,水样经10 000 r/min离心1 min后取沉淀,按Qiagen试剂盒操作方法提取DNA,用50 μL灭菌双蒸水洗脱。

表1 引物列表
1.3 PCR检测
于PCR反应管中,加入2×Premix Ex Taq 25 μL,灭菌双蒸水19 μL,DNA模板4 μL,和上下游引物(浓度25 μmol/L)各1 μL,混匀离心后置于PCR仪上,参照文献[2,5,20]中描述的方法分别对目的片段进行扩增。
1.4 产物测序
用1.5%琼脂糖凝胶电泳观察扩增结果,切取阳性片段,用PCR产物纯化试剂盒回收后,交TaKaRa公司克隆测序,将所得序列通过美国国立生物技术信息中心的BLAST检索系统进行同源性分析。
2 结 果
2.1 扩增结果
36个凡纳滨对虾苗种样本检测结果见图1,5个卤虫样本及12个水样检测结果见图2。18S-PCR检测阳性样本为5和L5;SSU-PCR第一步扩增阳性样本为L5,第二步扩增阳性样本为1、2、3、4、5、7、15、24、29、30、33、34、35、L3、L4、L5、S1、S2、S3、S6、S7和S11;SWP-PCR第一步扩增阳性样本为L5,第二步扩增阳性样本为1、2、5、15、29、33、35、L5、S2和S11。
2.2 阳性产物测序结果
阳性产物测序所获得序列长度及BLAST结果见表2。18S-PCR及SWP-PCR阳性产物测序结果均正确。SSU-PCR在凡纳滨对虾样本检测中获得的阳性产物测序结果正确;L3号卤虫样本阳性产物序列长度为167 bp,BLAST匹配结果为一种非虾肝肠胞虫的微孢子虫,S1和S3号水样阳性产物序列长度为175 bp,BLAST匹配结果为一种非虾肝肠胞虫的微孢子虫,其余阳性产物测序结果均正确。

图1 36个凡纳滨对虾苗种样本检测结果a:18S-PCR;b:SSU-PCR第一步扩增;c:SSU-PCR第二步扩增;d:SWP-PCR 第一步扩增;e:SWP-PCR第二步扩增;N:阴性对照;P:阳性对照;M: DNA marker.
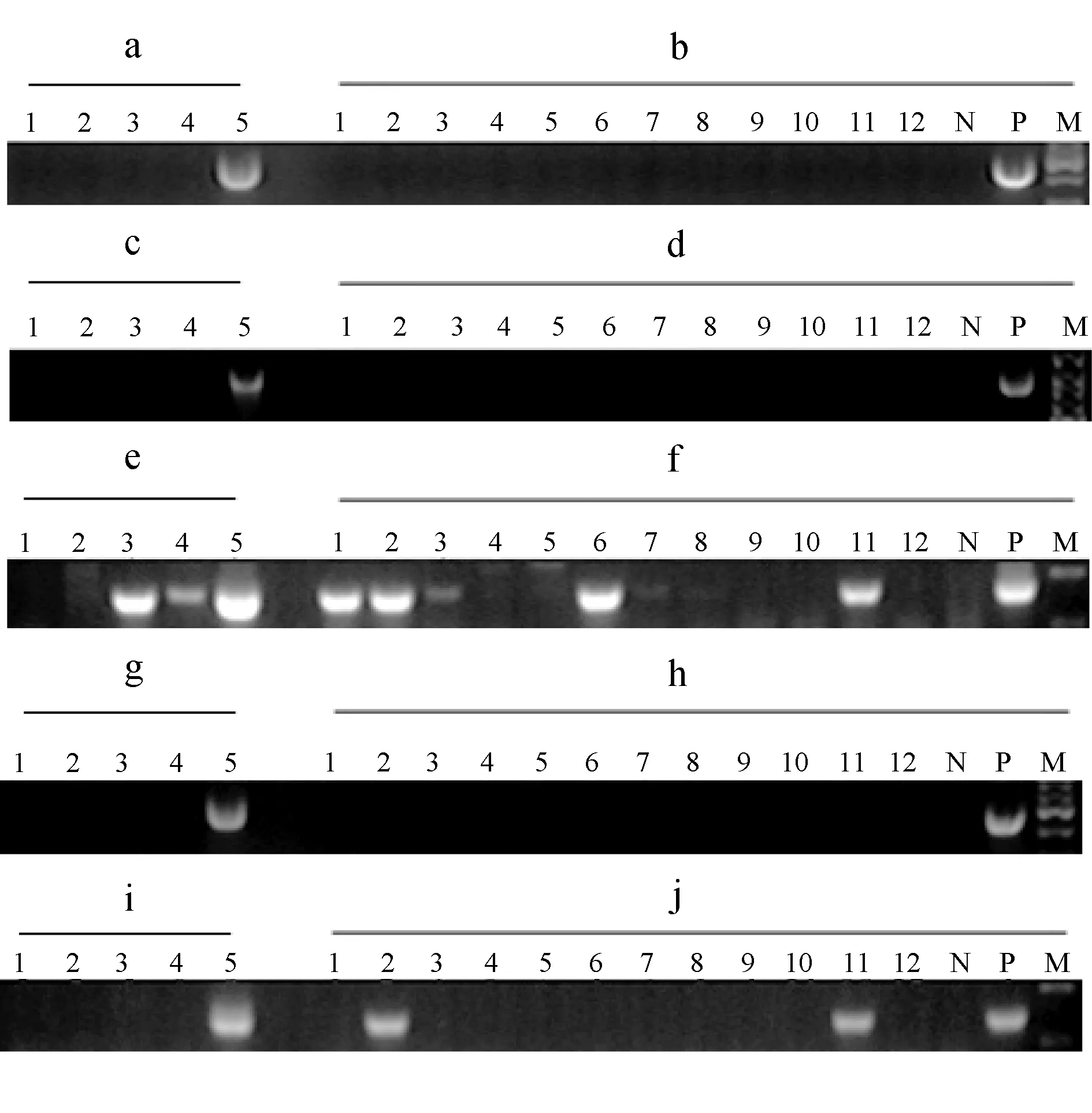
图2 5个卤虫样本及12个水样检测结果a:L1~L5号卤虫样本18S-PCR;b:S1~S12号水样18S-PCR;c:L1~L5号卤虫样本SSU-PCR第一步扩增;d:S1~S12号水样SSU-PCR第一步扩增;e: L1~L5号卤虫样本SSU-PCR第二步扩增;f:S1~S12号水样SSU-PCR第二步扩增;g:L1~L5号卤虫样本SWP-PCR第一步扩增;h:S1~S12号水样SWP-PCR第一步扩增; i:L1~L5号卤虫样本SWP-PCR第二步扩增;j:S1~S12号水样SWP-PCR第二步扩增;N:阴性对照;P:阳性对照;M:DNA marker.
2.3 检测结果比较
综合以上结果,针对这52个样本的虾肝肠胞虫检测,18S-PCR检测的阳性率为3.77%,SSU-PCR检测的阳性率为32.7%,SWP-PCR检测的阳性率为18.86%。18S-PCR在一步扩增的灵敏度最好,在凡纳滨对虾苗种5号样本中获得阳性条带,而其他两种方法均未见条带。在第二步扩增上,SSU-PCR的灵敏度显著高于SWP-PCR,但在检测卤虫样本时会出现167 bp的假阳性条带,在检测水样时会出现175 bp的假阳性条带;在灵敏度不及SSU-PCR的情况下,SWP-PCR扩增的特异性较好,未出现假阳性条带。
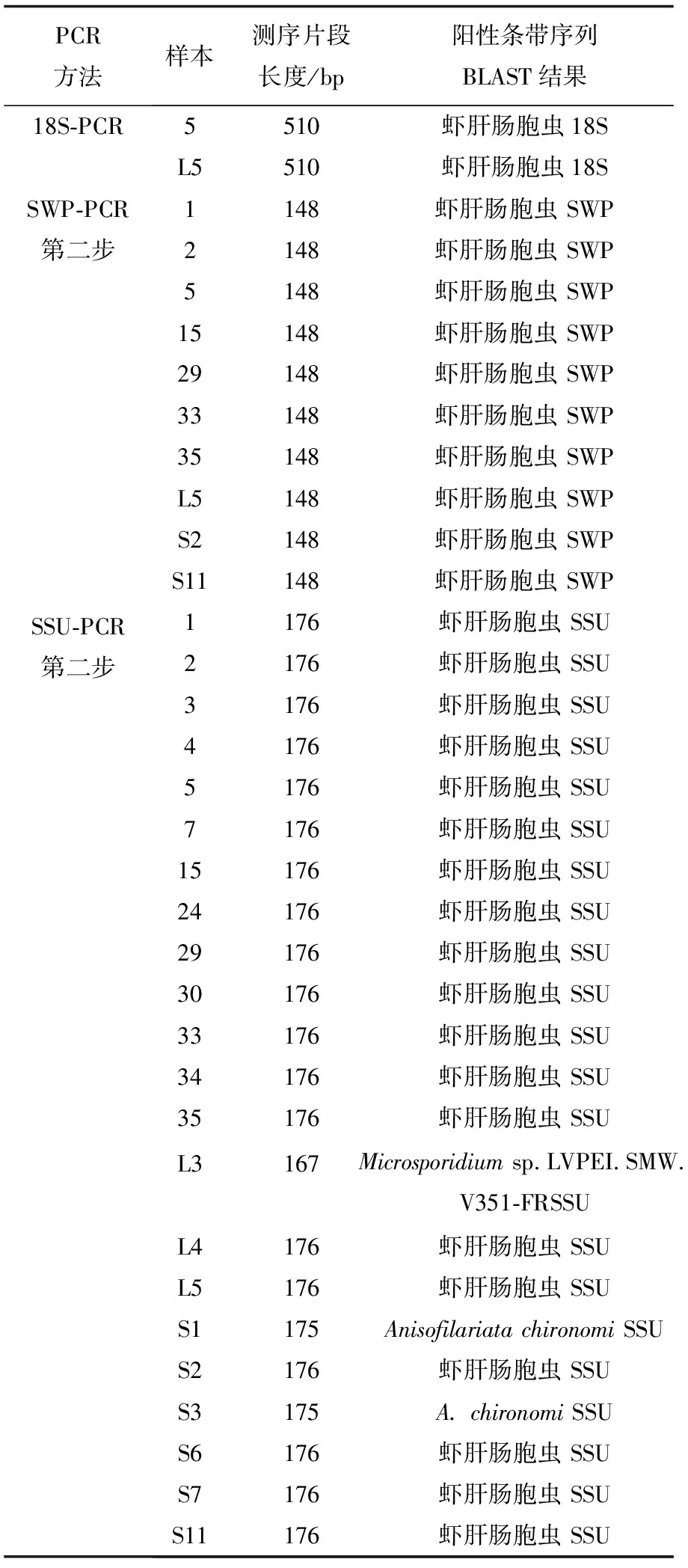
表2 阳性条带测序长度及BLAST比对结果
3 讨 论
3.1 不同检测方法的灵敏度差异
在凡纳滨对虾苗种的检测中,能否最大限度辨别出阳性苗种最为关键,也最受关注,直接影响到养殖生产的成败。目前已报道的检测方法主要包括显微观察法、普通PCR检测法、实时荧光定量PCR法[10,15]、地高辛标记核酸探针原位杂交法[5]和LAMP法[18]。不同的检测方法在灵敏度上存在着一定的差异。LAMP法和TaqMan实时荧光定量PCR法[10]灵敏度为套式PCR的10倍。SYBR Green实时荧光定量PCR法[15]灵敏度为套式PCR的4倍。在套式PCR检测到虾肝肠胞虫的样品中,只有第一步PCR反应呈阳性的样品,才能在肝胰腺组织中用光学显微镜观察到可辨识的孢子[6]。考虑到检测时限、高通量检测成本、水产养殖基层实验室设备、结果可靠性等因素,普通PCR方法仍然是目前生产领域最为实用的检测技术。
Jaroenlak等[19]根据孢壁蛋白SWP序列设计引物,建立了套式SWP-PCR检测技术,发现SWP-PCR的第一步扩增灵敏度比SSU-PCR高100倍,在第二步扩增上,两者的灵敏度无显著差异。但通过实际检测发现,在未知样本的检测上,SSU-PCR第二步扩增的灵敏度要显著高于SWP-PCR,并且只有SSU-PCR第二步扩增条带相对较亮的样本,SWP-PCR第二步扩增才能获得相应条带。可能产生这种结果的原因为,其以标准阳性质粒为模板进行了比对试验,在实际检测中,还存在目的序列的基因丰度差异,这种差异往往直接影响了实际检测的灵敏度。由于凡纳滨对虾苗种中虾肝肠胞虫的携带量较低,往往要依靠套式PCR的第二步扩增才能检出,因此SSU-PCR更适合苗种中虾肝肠胞虫的检测。
3.2 SSU-PCR假阳性条带对实际检测的影响
已有报道表明,SSU-PCR应用于鱼粉等原料的检测时,会出现假阳性反应,同时在检测蟹类样品时,也会出现假阳性反应,并且假阳性条带的位置与目的条带的位置不易区分[19]。笔者在检测中也发现,SSU-PCR在第二步扩增上确实存在着一些假阳性现象,卤虫中检出的假阳性物种为其他种的微孢子虫,水中检出的假阳性条带为一种寄生摇蚊的微孢子虫[20]。由于目前未报道养殖对虾可被这些产生交叉反应的物种感染,因此针对对虾的虾肝肠胞虫检测,SSU-PCR仍是可信任的方法。
凡纳滨对虾取样时,往往体表会留有一定量的水,这些水中可能存在的上述假阳性物种是否会对检测结果有干扰,笔者认为其可能性也不大。由于在检测的过程中对水样进行检测时首先要进行离心,可以视为一定程度上的浓缩,才能在套式PCR的第二步扩增中观察到条带,而凡纳滨对虾苗种取样后,一般会加一定量的95%乙醇保存,这是对残留水的一次稀释,之后实际检测中会剔除这部分乙醇,这又是一次稀释,即便是未能完全剔除,其含量也可忽略不计,通过套式PCR的方法也已检测不到。有鉴于此,在针对凡纳滨对虾苗种进行虾肝肠胞虫的检测时,推荐采用灵敏度更高SSU-PCR的方法;在针对饵料生物、环境样本等进行虾肝肠胞虫的检测时,推荐采用特异性更好的SWP-PCR方法。
3.3 虾肝肠胞虫的多种携带渠道值得引起高度重视
已有研究表明,在海水[9]、感染塘池水及冰冻卤虫[5]中均能不同程度检测到虾肝肠胞虫的存在;通过检测也发现,市售商品化冰冻卤虫和凡纳滨对虾主养区周边水域中均能检测到虾肝肠胞虫,这与已有的报道吻合。卤虫为凡纳滨对虾养殖过程中的重要动物性饵料,而对虾的养殖用水大多取自周边的主要河道,同时凡纳滨对虾苗种阶段虾肝肠胞虫的携带率又较高,种种因素表明,凡纳滨对虾的养殖暴露在虾肝肠胞虫存在的大环境下,面临着较大的系统性风险,对其防控存在着较大难度,相关从业者要引起高度重视,从生产的各个环节严格把控,以确保养殖生产的成功。
