中华鳖IRF4基因克隆及免疫功能研究
2019-05-30付建平陈丹婷
付建平,陈丹婷,赵 昕,刘 毅
(江西师范大学 生命科学学院,江西 南昌 330022 )
干扰素(IFN)是一类具有抗病毒、抗肿瘤及免疫调节等功能的多效细胞因子,其分泌受干扰素调节因子(IRF)家族调节[1-3]。研究发现,干扰素调节因子家族有11个成员,即IRF1~IRF11。根据其系统进化分析显示IRF家族可以分为4个亚家族,即IRF1、IRF3、IRF4和IRF5亚家族,其中IRF4、IRF8、IRF9、IRF10基因隶属IRF4亚家族[4]。
IRF4基因仅表达于免疫相关细胞如淋巴细胞、巨噬细胞、B细胞和树突状细胞,在先天性免疫和特异性免疫中发挥重要作用[5-6]。其本身与DNA的亲和力弱,当与其他转录因子形成复合物后,其结合效率显著增强。IRF4与转录因子PU.1形成异源二聚体与免疫球蛋白G基因的增强子结合后,能激活B细胞中免疫球蛋白轻链的表达;IRF4可促进B淋巴细胞向浆细胞分化,在B细胞和T细胞成熟及树突状细胞发育过程中扮演着十分重要的角色。IRF4基因不表达或者功能缺陷将导致免疫缺陷,机体无法产生抗体。IRF4还与许多淋巴样恶性肿瘤疾病、自身免疫相关疾病等相关[7-8]。在鱼类中,IRF4可被细菌、细菌模拟物脂多糖、病毒和病毒模拟物聚肌胞苷酸诱导,暗示着IRF4在抗细菌、病毒等先天性免疫反应中起重要作用[9-12]。然而爬行动物中IRF4基因的功能仍不清楚。笔者通过研究中华鳖(Pelodiscussinensis)IRF4基因的表达规律及构建过表达质粒,初步探讨其免疫功能,为了解IRF4免疫应答机理奠定基础。
1 材料与方法
1.1 动物、细胞系与病毒
中华鳖(体质量约100 g)购自江西南昌向塘中华鳖养殖场,在实验室内暂养7 d,水温(28±1) ℃,投喂商品颗粒饲料2次/d;鲤鱼表皮瘤细胞系和中华鳖肌肉来源细胞[13]分别用含10%胎牛血清的199、DMEM/F12培养基(Gibco)进行传代培养(28 ℃);中华鳖虹彩病毒(Soft-shelledturtleiridovirus, STIV)源自深圳出入境检验检疫局。
1.2 中华鳖IRF4基因序列获取、分析及真核表达载体构建
取中华鳖脾脏于1 mL Trizol(Invitrogen)中,参照说明书提取总RNA。取1 μg总RNA用去除DNA污染的逆转录试剂盒(Takara)制备cDNA模板。反应步骤如下:先将RNA用基因组DNA消化酶于42 ℃消化2 min去除基因组(反应体系为:基因组DNA消化酶1 μL,5×基因组DNA消化酶缓冲液2 μL,RNA 1 μg,H2O补齐到10 μL),然后加入反转录混合物(PrimeScript RT Enzyme Mix 1,1 μL,RT Primer Mix,1 μL,5×PrimeScript Buffer,4 μL,H2O,4 μL)于37 ℃逆转录15 min后85 ℃失活5 s,最后4 ℃保存备用。根据GenBank中中华鳖IRF4基因序列信息,用Primer 5.0软件设计并合成特异性引物IRF4-F和IRF4-R(全文所用引物信息见表1)以扩增IRF4基因编码区,其扩增体系(50 μL)为:H2O,40 μL;10×Blend Taq polymerase buffer,5 μL;上下游引物(10 μmol/L)各1 μL;2.5 mmol/L dNTPs,2 μL;Blend Taq polymerase,0.5 μL;上述cDNA模板,0.5 μL。PCR循环参数为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸10 min。扩增的PCR产物进行琼脂糖凝胶电泳,目的片段经回收后连入pMD18-T载体,转化至大肠杆菌(Escherichiacoli)(Top10)感受态细胞,阳性克隆pMD18T-IRF4送生工生物工程(上海)股份有限公司测序并分析。通过美国国立生物技术信息中心上同源搜索IRF4基因序列,利用Clustal X 2.1进行多序列比对分析其保守位点及结构等分析。以pMD18T-IRF4为模板,用引物IRF4-F-NotⅠ和IRF4-R-BglⅡ进行PCR扩增,将回收的目的片段和质粒p3xflag-CMV14分别用NotⅠ和BglⅡ双酶切,连接,转化至大肠杆菌感受态细胞,挑取阳性克隆,将其命名为p3xflag-IRF4,送生工生物工程(上海)股份有限公司进行测序。所有转染用的质粒用去内毒素质粒小提试剂盒(Omega)提取,用微量紫外—可见分光光度计(Nanodrop 2000)测定含量。

表1 中华鳖IRF4基因克隆和表达分析所用引物
1.3 中华鳖IRF4基因组织分布
为了研究IRF4基因在健康中华鳖组织及器官中的分布,分别取3只中华鳖的脾、肾、肝、肠、心、肌肉、肺、血液于1 mL Trizol中,提取RNA,同上述方法制备cDNA模板。设计荧光定量引物IRF4-rqF/IRF4-rqR,用SYBR®Premix TaqTMⅡ(TliRNaseH Plus)(Takara)在ABI7500仪器上进行荧光定量。其反应体系为:Premix Ex Taq Ⅱ(2×),6 μL,正向和反向引物各0.4 μmol/L,cDNA模板,0.5 μL,Rox Reference Dye(50×),0.24 μL,用H2O补齐至12 μL;反应程序为:95 ℃预变性10 min,然后95 ℃ 15 s,60 ℃ 1 min,共45个循环,反应结束后确认其扩增曲线和溶解曲线。试验结束后,以β-actin做内参,参照2-△△Ct方法[14]分析IRF4基因在不同组织及器官中的相对表达分布。
1.4 中华鳖外周血淋巴细胞中IRF4基因诱导表达
分别自3只中华鳖颈静脉采抗凝血2 mL,用RPMI1640(含2%胎牛血清,青霉素100 U/mL,链霉素0.1 mg/mL)(Gibco)稀释5倍,加入到含有5 mL Ficoll plus 1.083(Solarbio)分离液上方,室温,1200 r/min,离心15 min,收集淋巴细胞。用培养基洗涤细胞2次后,用RPMI1640(含10% FBS,青霉素100 U/mL,链霉素0.1 mg/mL)重悬,以每孔4×106细胞量(接种量2 mL)接种于12孔细胞培养板中(NEST)。28 ℃,5% CO2培养箱中预培养2 h后,分别加入PBS(对照组),100 μg/mL脂多糖(L2880,Sigma),100 μg/mL聚肌胞苷酸(P3350,Sigma),12、24 h后收集细胞。同上述方法制备cDNA模板,荧光定量检测其表达变化。用独立样本t检验分析其差异是否显著,P<0.05表示差异显著。
1.5 IRF4影响中华鳖肌肉来源细胞对中华鳖虹彩病毒的敏感性
将中华鳖肌肉来源细胞以每孔0.5×104细胞量接种于96孔细胞培养板中(NEST),48 h后,用脂质体2000(Invitrogen)分别将0.1 μg p3xflag-cmv14和p3xflag-IRF4质粒转染到每孔细胞中。48 h后感染中华鳖虹彩病毒,计算半数细胞培养物感染量(TCID50)。方法如下:用不含血清的DMEM/F12按2倍稀释8个梯度,接种于上述转染后细胞,每孔100 μL,每个梯度接种6孔,吸附1 h后换成含2%胎牛血清的DMEM/F12维持液,于培养箱观察并记录细胞病变情况,当细胞病变不再发展时,用Reed-Munch方法[15]计算半数细胞培养物感染量。试验设3次重复,用独立样本t检验分析试验组与对照组之间是否存在差异,P<0.05表示差异显著。为了确保融合蛋白IRF4-flag在中华鳖肌肉来源细胞中表达,同时将1×105细胞量的中华鳖肌肉来源细胞接种于直径为30 mm的细胞培养皿中(NEST),48 h后用脂质体2000分别将2 μg的p3xflag-cmv14和p3xflag-IRF4质粒转染到细胞中。继续培养48 h后用50 μL的RIPA裂解液裂解细胞,用Flag标签抗体(小鼠单抗,碧云天,AF519)通过蛋白质印迹法检测其表达。
1.6 IRF4对干扰素信号通路及NF-κB信号通路的影响
为了探讨过表达IRF4能否调节干扰素信号通路及NF-κB信号通路,将鲤鱼(Cyprinuscarpio)表皮瘤细胞以每孔0.5×105细胞量种于24孔细胞培养板中(NEST),24 h后用脂质体2000分别将p3xflag-cmv14/p3xflag-IRF4(0.25 μg)、pIFNpro-Luc/pNF-κB-Luc(0.25 μg)、pRLTK(0.025 μg)质粒共转染至每孔细胞中。48 h后用PBS洗涤细胞1次,加入新鲜配制的1×被动裂解液(100 μL/孔),室温裂解细胞15 min,将裂解液转入干净的离心管短暂离心,取20 μL上清液用来检测萤火虫荧光素酶和海肾荧光素酶活力,计算其比值。所用试剂盒为双荧光素酶报告基因检测试剂盒(Promega),仪器为Glomax 2020。每个样品3个重复,用独立样本t检验分析试验组与对照组之间是否存在差异,P<0.05表示差异显著。另外,收集转染上述不同质粒细胞,同上述方法用蛋白质印迹法检测融合蛋白IRF4-flag表达。
2 结 果
2.1 IRF4基因的扩增及序列分析
以中华鳖脾脏cDNA为模板进行PCR扩增,获得片段大小约1600 bp。将此特异性基因片段克隆入pMD18-T载体并进行测序鉴定,其和GenBank中预测的中华鳖IRF4基因的开放读码框一致性达到100%。开放读码框长为1341 bp,编码446个氨基酸,预测其蛋白分子量为51.25 ku。和其他脊椎动物IRF4基因一样,中华鳖IRF4基因含有1个DNA结合结构域(DBD)和1个IRF相关结构域(IAD),其中DNA结构域中含有5个保守的色氨酸残基,中华鳖IRF4和鸡的相似性最高,达96%(图1)。
2.2 中华鳖IRF4基因在各组织及器官中表达
荧光定量结果显示,IRF4基因泛表达于所检测的组织及器官中,其中血液中表达最高,肝和脾次之(图2)。
2.3 脂多糖和聚肌胞苷酸诱导外周血淋巴细胞中IRF4表达
荧光定量结果显示,脂多糖和聚肌胞苷酸均能诱导外周血淋巴细胞中IRF4基因上调表达,其中IRF4基因的表达在脂多糖诱导12、24 h后分别上调6.9倍和10.6倍,聚肌胞苷酸诱导后上调10.6倍和25.3倍(图3)。
2.4 过表达IRF4降低中华鳖肌肉来源细胞对中华鳖虹彩病毒敏感性
为了检验其是否具有抗病毒功能,测定了中华鳖虹彩病毒对转染p3xflagcmv14或p3xflagIRF4质粒后中华鳖肌肉来源细胞的半数细胞培养物感染量,结果显示,中华鳖肌肉来源细胞中过表达IRF4基因后其半数细胞培养物感染量为2-5.1/0.1 mL,是对照组的4.8倍(2-7.33/0.1 mL)(图4a)。同时蛋白质印迹法结果确定融合蛋白IRF4-flag(54.7 ku,其中标签约3.4 ku)成功表达于中华鳖肌肉来源细胞中(图4b)。
2.5 过表达IRF4对干扰素、NF-κB通路影响
利用荧光素酶报告系统检测其对干扰素启动子、NF-κB启动子活性的作用,结果显示,中华鳖IRF4显著诱导干扰素启动子活性的作用,与对照组相比,其启动子被激活2.6倍(图5a)。过表达IRF4后,其能显著抑制NF-κB启动子活性(图5b)。同时,蛋白质印迹法结果确定IRF4-flag融合蛋白成功表达于鲤鱼表皮瘤细胞中(图5c)。

图1 IRF4基因氨基酸序列多重比对通过Clustal X 2.1进行多重比对分析,相同(*)和相似(.或:)氨基酸在序列下方标示,保守的色氨酸位点用灰色突出显示,DNA结合结构域,IRF相关结构域在序列上方标出.

图2 中华鳖IRF4基因在组织/器官中相对表达量数据用平准值±标准差表示(n=3).下同.
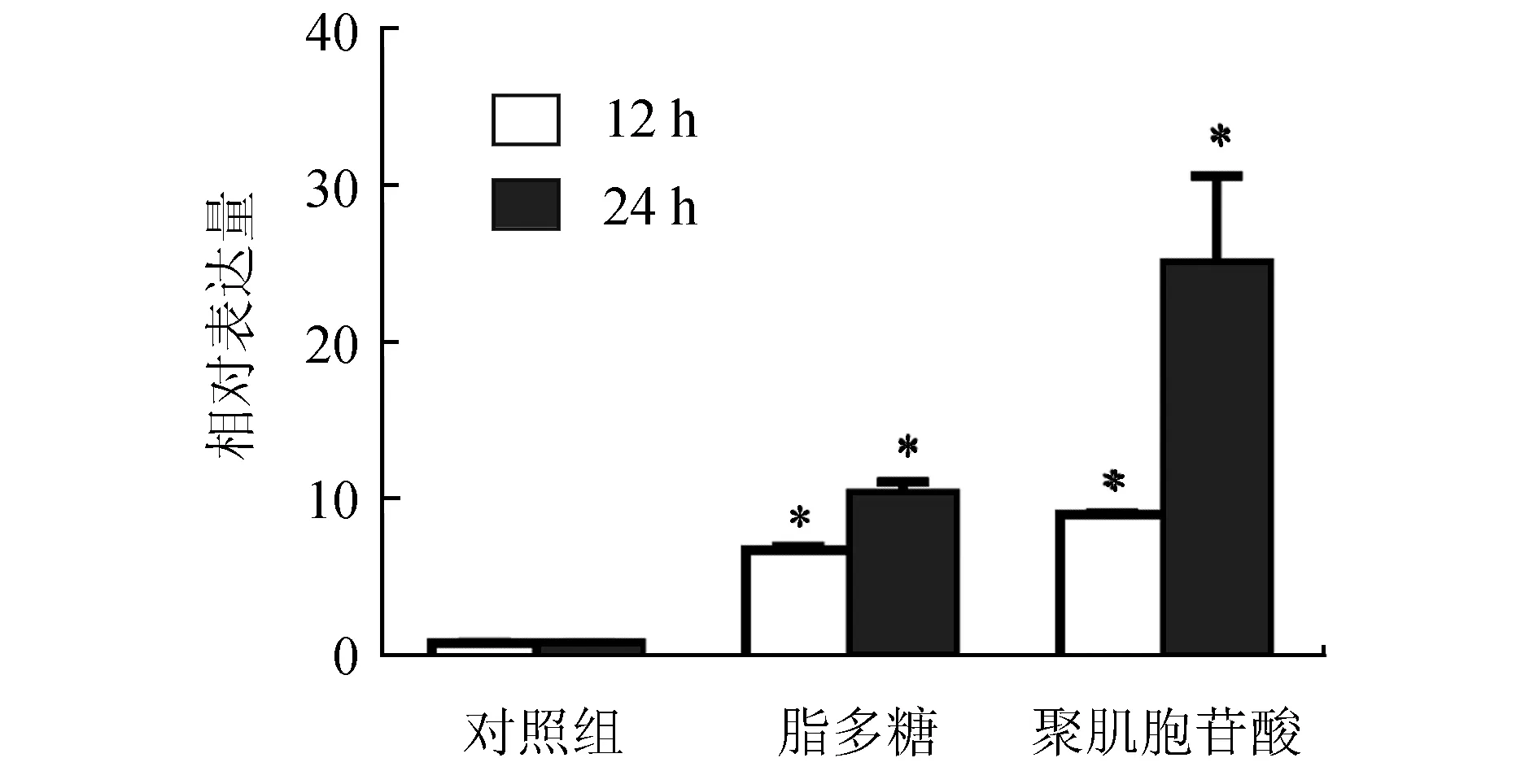
图3 脂多糖、聚肌胞苷酸诱导后外周血淋巴细胞中IRF4表达分析*示试验组和对照组在相同采样时间点差异显著(P<0.05).下同.
3 讨 论
3.1 表达分析
IRF4基因仅在免疫细胞中表达,可被不同丝裂原刺激物、抗原受体、脂多糖和白介素4等刺激诱导表达[16-17]。荧光定量结果显示,中华鳖IRF4基因在所检测组织及器官中表达,其中在血液、肝和脾中表达较高,这可能与血液、肝和脾中富含免疫细胞相关[18]。鱼类IRF4基因主要在富含淋巴样组织或黏膜组织中表达,如IRF4在黄鳝(Monopterusalbus)的肠、头肾、体肾中表达量较高[19],在褐牙鲆(Paralichthysolivaceus)的脾、头肾、鳃、肾中表达量较高[20],在大黄鱼(Pseudosciaenacrocea)的心脏和肾中表达较高[21]。在某些鱼类如斑马鱼(Daniorerio)、鳜鱼(Sinipercachuatsi)中,IRF4有2个同源基因即IRF4a和IRF4b,分别参与早期、晚期抗病毒反应[10,12]。此外,罗凯等[22]在草鱼(Ctenopharyngodonidella)中发现,除IRF4a

图4 过表达IRF4降低中华鳖肌肉来源细胞对中华鳖虹彩病毒敏感性a.过表达IRF4降低中华鳖肌肉来源细胞对中华鳖虹彩病毒敏感性;b.蛋白质印迹法检测IRF4-flag融合蛋白在中华鳖肌肉来源细胞中表达.

图5 过表达IRF4对干扰素、NF-κB启动子活性影响鲤鱼表皮瘤细胞分别共转染干扰素启动子(a)和NF-κB启动子(b),pRLTK,p3xflagcmv14或p3xflagIRF4, 48 h后收集细胞,检测其荧光素酶活性; c.蛋白质印迹法检测IRF4-flag融合蛋白在鲤鱼表皮瘤细胞中表达.
和IRF4b基因外,还存在另一个成员IRF4-like基因,其中IRF4a和IRF4b基因在鳃中表达较高,IRF4-like基因在脾脏中表达最高;通过草鱼呼肠孤病毒(Grasscarpreovirus,GCRV)攻毒发现IRF4a、IRF4b和IRF4-like基因均在病毒感染前期和前中期发挥作用。细菌模拟物脂多糖和病毒模拟物聚肌胞苷酸均能诱导中华鳖外周血淋巴细胞中IRF4基因表达,但是聚肌胞苷酸具有更强的诱导能力,揭示其可能主要在抗病毒免疫中发挥重要作用。Xu等[19]发现无论是脂多糖、聚肌胞苷酸,或是嗜水气单胞菌均能诱导黄鳝IRF4基因在脾、头肾和鳃中表达。Liu等[20]发现,聚肌胞苷酸和淋巴囊肿病毒(Lymphocystisdiseasevirus,LCDV)诱导后,褐牙鲆IRF4b基因在淋巴样组织中显著表达,揭示其在抗DNA和RNA病毒免疫中发挥重要作用。
3.2 IRF4基因与抗病毒
和其他干扰素调节因子一样,IRF4含有DNA结合结构域和IRF相关结构域[23]。其中DNA结合结构域主要负责与干扰素或者干扰素诱导基因的启动子中的干扰素激活反应元件序列结合[24-26],IRF相关结构域主要促进干扰素调节因子家族成员之间形成同源或异源二聚体,调节蛋白之间的作用。IRF4本身与DNA亲和力弱,当与其他转录因子如PU.1或SPIB形成复合物后,其结合效率显著增强,活化基因表达。然而,这种激活作用可被IRF8竞争性抑制[27]。EPC中过表达后,IRF4具有显著诱导干扰素启动子活性的作用,揭示其可能通过调节Ⅰ型干扰素的表达发挥抗病毒功能。中华鳖虹彩病毒是中华鳖重要的病毒性病原之一,严重制约着中华鳖养殖业的发展[28-30]。在体外抗病毒研究中,中华鳖STA细胞过表达IRF4基因能显著抑制中华鳖虹彩病毒的增殖,其半数致死剂量为对照组的4.8倍(图4)。可见,中华鳖IRF4基因参与抗病毒过程。另外,IRF4对干扰素启动子及NF-κB启动子的活性可被IRF8抑制(结果未显示),笔者将进一步研究IRF4和IRF8对基因的调控机理。
3.3 IRF4与NF-κB
NF-κB是一类广泛存在于无脊椎、脊椎动物中的重要转录调节因子,可通过调控不同靶基因的表达在炎症、免疫、应激、细胞增殖或凋亡等过程中起重要作用,NF-κB家族包括RelA(p65)、c-Rel、RelB、NF-κB1和NF-κB2,各成员之间以同源或异源二聚体形式行使其功能[31]。
IRF4基因的转录激活主要受转录因子STAT6、c-Rel调控。转录因子STAT6主要通过与IRF4启动子中的TT(N)4-6AA特异序列结合来调控IRF4基因的转录激活;转录因子c-Rel隶属NF-κB家族,通过与IRF4启动子中的GGGA(N)1-2TTCC特异序列相结合来调控IRF4基因的转录激活[16-17]。IRF4对其表达还有自身调节作用,Li等[32]发现,在斑马鱼中,过表达STAT1和c-Rel能显著诱导IRF4启动子活性,且IRF4a通过直接与STAT1、c-Rel结合负反馈调控其表达。本试验结果表明,过表达IRF4后,其能抑制NF-κB启动子活性,推测其可能是通过抑制NF-κB信号通路防止机体产生过度免疫应答而保护机体的。
本研究克隆了中华鳖IRF4基因,对其表达规律、免疫功能进行了初步研究,为进一步了解爬行动物IRF的网络调节功能提供理论基础。
