饥饿及恢复喂食对日本医蛭肠道菌群多样性的影响
2019-05-29鲁增辉游华建贺元川张德利邢康康陈仕江
石 萍 鲁增辉 游华建 贺元川 张德利 邢康康 陈仕江
(重庆市中药研究院, 重庆 400065)
动物肠道内栖息了数量庞大的微生物群落, 这些微生物群在宿主肠道构成了复杂的微生态系统,在营养物质消化吸收、宿主免疫功能调节、有害微生物侵害防御等方面具有重要作用[1—3]。研究表明, 动物肠道微生物菌群组成及变化, 可能受到多种因素的影响, 如饲料[4]、日龄[5,6]、免疫状态[7]、环境因素[8]、抗生素治疗[9]和应激[10]等。因此, 研究动物肠道微生物菌群及在特定情况下的变动, 对于阐明肠道微生物促进动物体的消化吸收、生长发育、免疫防御等方面具有重要意义, 对于补充诠释宿主-肠道菌群互作机制也具有重要价值。
医学蛭类如欧洲医蛭(Hirudo medicinalis)、侧纹医蛭(Hirudo verbana)等体内含有大量抗凝、抗血栓等生物活性成分, 而被广泛研究。医蛭体内的肠道微生物与宿主的共生关系以及对宿主的有益效果, 也是科学界研究的重点。日本医蛭(Hirudo nipponiaWhitman, 1886)隶属于环节动物门蛭纲无吻蛭目医蛭属[11], 是中国药典(2015年版)收载的唯一吸食动物血液的水蛭药材种类[12]。临床研究表明, 水蛭在治疗动脉粥样硬化[13]、高脂血症[14]、抗血栓[15]、抗肿瘤[16]、抗炎症[17]等方面有较好的疗效。日本医蛭药用史最早可追溯至《神农本草经》, 由于其体内含有世界上最强的天然抗凝血酶类物质—水蛭素, 因此具有极强的抗凝血酶活性和抗血小板聚集作用[18]。以日本医蛭为原料的脉血康胶囊在治疗心脑血管疾病方面具有极好的市场反应, 产品供不应求[19]。受环境污染、人为过度捕捞、栖息地急剧萎缩等因素的影响, 日本医蛭野外种群量急剧下降, 曾经遍布全国的日本医蛭, 现在难寻其踪。本课题组开展了多年日本医蛭人工养殖研究及实践。在人工养殖过程中, 课题组发现日本医蛭能够在饥饿状态下维持生命体征长达半年以上, 处于饥饿状态的医蛭在喂食血液后, 能够急剧生长。推测是存在于日本医蛭体内的肠道微生物菌群发挥了极其重要的作用。
现阶段关于日本医蛭肠道微生物菌群、饥饿及恢复摄食对日本医蛭肠道微生物菌群影响等方面的研究, 还未见任何报道。为此本课题组利用不依赖于传统培养的高通量测序技术, 对饥饿及恢复摄食状态下的日本医蛭肠道微生物菌群进行了研究。以期揭示日本医蛭肠道微生物菌群组成、肠道微生物菌群对日本医蛭不同摄食状态的反应以及可能发挥的作用, 为日本医蛭人工养殖产业化、肠道微生物菌群对日本医蛭有益作用机制研究等奠定基础, 也为其他宿主-肠道微生物互作机制研究提供参考。
1 材料与方法
1.1 实验材料
本研究所用日本医蛭均来源于重庆市中药研究院水蛭养殖基地。各选取100尾健康无病、表面无伤痕、个体大小相近的日本医蛭正常个体, 分别暂养于4个相同的养殖网箱。其中1个网箱饥饿处理30d (JE), 1个为正常饲养对照组(DZ), 另外2组均饥饿30d后喂食1次, 投喂结束后第7、第14天取样,分别记作F7、F14。整个养殖期间, 水温20—22℃,溶氧≥5 mg/L, pH=7.0±0.2, 饲料为新鲜健康猪血。各组分别设置三个生物学重复, 每个重复选取10尾日本医蛭。
1.2 肠道菌群收集
实验日本医蛭用75%酒精体表消毒, 于无菌条件下, 1.5 mL离心管收集肠道及其内容物, 做好标记后液氮冻存。
1.3 基因组抽提
采用CTAB/SDS方法对样本的基因组DNA进行提取, 利用1%琼脂糖凝胶电泳检测DNA的浓度和纯度, 使用无菌水将DNA浓度稀释至1 ng/μL。
1.4 16S rRNA基因序列的扩增
以稀释后的基因组DNA为模板, 选取细菌基因组16S区域中V4区作为扩增区域, 用Phusion®High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR。扩增V4区引物以515F (5′-GTGCC AGCMGCCGCGGTAA-3′)及806R (5′-GGACTA CHVGGGTWTCTAAT-3′)上加有接头和测序引物序列, 同时反向引物上另接有12个不同碱基的标签(Barcode)序列以区分不同样品[20]。扩增产物采用Qiangen胶回收试剂盒(Qiagen Gel Extraction Kit,Qiagen, Germany)进行琼脂糖凝胶电泳回收纯化。
1.5 16S rRNA文库构建
按照TruSeq®DNA PCR-Free Sample Preparation Kit (Illumina, USA)说明手册进行文库构建。文库质检采用Qubit@ 2.0 Fluorometer (Thermo Scientific)和Agilent Bioanalyzer 2100 system。在Illumina HiSeq2500测序平台进行上机测序。测序服务由北京诺禾致源生物公司完成。
1.6 数据分析
根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样品数据, 截去Barcode和引物序列后使用FLASH (Version 1.2.7)[21]对每个样品的reads进行拼接, 获得Tags数据(Raw Tags); 参照Qiime (Version 1.7.0)[22]的Tags质量控制流程, 过滤去除低质量、短长度及嵌合体后得到高质量、用于分析的Tags数据(Effective Tags)。
利用Uparse软件(Version7.0.1001)[23]对所有样品的全部Effective Tags进行聚类, 以97%的一致性(Identity)将序列聚类成为OTUs (Operational Taxonomic Units)。选取OTUs的代表性序列, 进行注释分析, 利用Mothur方法与SILVA[24]的SSUrRNA数据库[25]进行物种注释分析(设定阈值为0.8—1), 获得分类学信息并分别在各个分类水平: phylum (门)、class (纲)、order (目)、family (科)、genus (属)、species (种)统计各样本的群落组成。
使用Qiime软件(Version 1.7.0)计算Observedspecies, Chao1, Shannon, ACE等指数, 使用R软件(Version 2.15.3)绘制稀释曲线以及Venn图, 并使用R软件进行Alpha多样性指数组间差异分析, 通过多变量统计学方法主成分分析(PCA, Principal Component Analysis)、主坐标分析(PCoA, Principal Coordinates Analysis)、 无度量多维标定法(NMDS,Non-Metric Multi-Dimensional Scaling)等方法, 从中发现不同样品(组)间的差异。
2 结果
2.1 16S rRNA基因PCR扩增及测序数据合理性分析
分别抽提日本医蛭(F7、F14、JE、DZ四组样品)肠道细菌基因组DNA, 以基因组DNA为模板,PCR扩增16S rRNA目的基因后, 经琼脂糖凝胶电泳检测, PCR产物目的条带大小正确, 总量满足2次或者2次以上建库需要, 可进行后续建库试验。
Coverage指数是对测序样品覆盖率的描述, 根据表1可见, 4组样品覆盖率均很高(≥99.8%), 说明样本序列中未被检测出的概率很低。稀疏曲线可直接反映测序数据量的合理性。从稀释曲线(图1A)可见, 在小于约5000条序列时, OTU数量随着样品的序列数增加而迅速增加; 在5000—30000条序列时, OTU数量增加缓慢, 之后则趋向平坦。本研究的4个样品均处于平台期(图1A), 说明测序数据量合理。测序原始数据提交至NCBI (Accession num-ber: SRP 126606)。
2.2 日本医蛭肠道菌群多样性分析
采用α和β多样性分析, 对日本医蛭摄食前后肠道菌群的整体结构组成变化进行描述和评价。结果显示, 4组样品获得最终用于分析的有效序列平均条数分别为59791±13967 (F7)、49140±15751(F14)、53379±10679 (JE)和62692±4529 (DZ),OTU数目变化中, F7组最高(表1)。Ace和Chao1指数对菌群物种总数评估发现, F7>F14>DZ>JE。
Venn图(图1B)结果显示, 4组样品共有111个OTU, 4组样品独有OTU分别为F7∶F14∶DZ∶JE=333∶112∶30∶26。PCA主成分分析和PCoA主坐标分析结果(图1C、1D)显示, 4组样品菌群结构有一定的差异。β多样性结果也显示四组样品组间有一定的差异(图1E)。
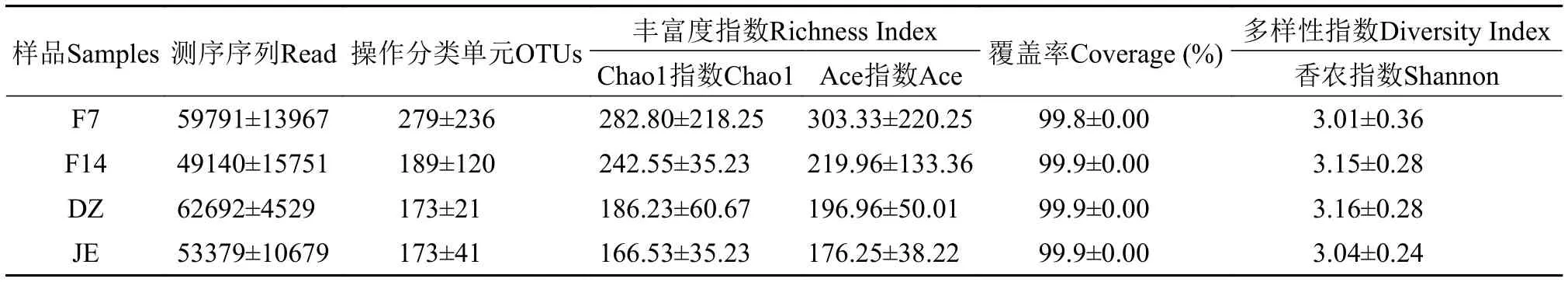
表1 四组样品α多样性分析结果Tab. 1 Alpha Diversity of four sets of samples

图1 稀释曲线(A)、样品维恩图(B)、PCA分析图(C)、PCoA分析图(D)和NMDS分析图(E)Fig. 1 Rarefaction curves (A); Venn diagram of OTU in the four groups (B); PCA analysis (C); PCoA analysis (D); NMDS analysis (E)
2.3 日本医蛭肠道菌群丰度变化
在所有实验日本医蛭肠道中, 变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)以及厚壁菌门(Firmicutes)均占据了95%以上(图2A、2B)。同时, 在所有样品中均检测出气单胞菌属(Aeromonas)、Mucinivorans属以及丹毒丝菌属(Erysipelothrix)(图2C), 3种菌属丰度之和在4组样品中均超过了60%(表2), 拟杆菌属(Bacteroides)丰度仅次于上述菌属。但无论是组内还是组间都存在一定的差异,说明饥饿及恢复摄食对日本医蛭肠道菌群的构成存在一定影响。同时也表明气单胞菌属、Mucinivorans属、拟杆菌属以及丹毒丝菌属等是日本医蛭核心肠道微生物群。
门分类水平下肠道菌群丰度的变化门水平肠道丰度的变化详见表2和图3。在饥饿及恢复摄食状态下日本医蛭肠道菌群的变化, 在门水平表现为: 变形菌门在对照组最高, 拟杆菌门在恢复摄食14d后丰度最高。厚壁菌门在饥饿组丰度值最高。
属分类水平下肠道菌群丰度的变化变形菌门的气单胞菌属、拟杆菌门的拟杆菌属、厚壁菌门的漫游球菌属(Vagococcus)均是在饥饿后恢复摄食7d时, 达到最高。Mucinivorans在饥饿后恢复摄食14d组达到最高, 丹毒丝菌属在饥饿状态下丰度最高(图3和表2)。
差异类群LEfSe分析通过LEfSe (Linear Discriminate Analysis Effect Size)分析发现, 饥饿后恢复喂食7d组日本医蛭肠道菌群中科和属分类水平上存在差异菌群, 如拟杆菌科、拟杆菌属(图4)。

图2 各样品肠道菌群组成结构Fig. 2 Gut microbial community structure of samples
表2 四组样品肠道菌群相对丰度分布表Tab. 2 The relative abundance of H.nipponia gut microbiota in four groups (n=3, )
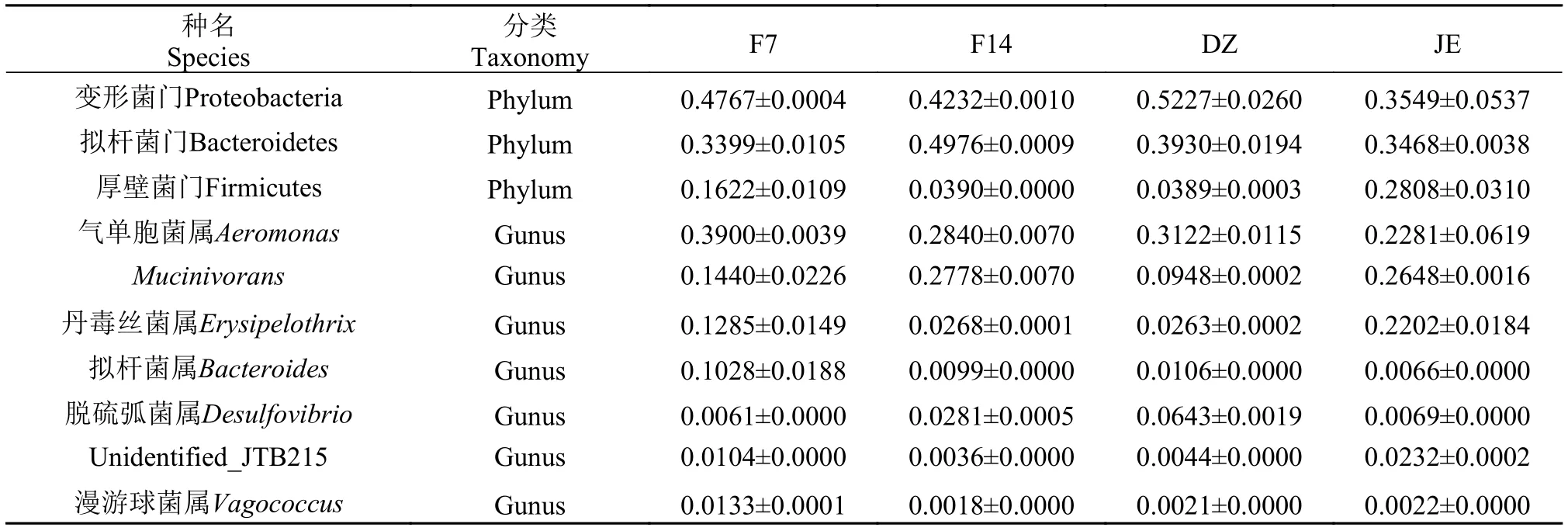
表2 四组样品肠道菌群相对丰度分布表Tab. 2 The relative abundance of H.nipponia gut microbiota in four groups (n=3, )
种名Species分类Taxonomy F7 F14 DZ JE变形菌门Proteobacteria Phylum 0.4767±0.0004 0.4232±0.0010 0.5227±0.0260 0.3549±0.0537拟杆菌门Bacteroidetes Phylum 0.3399±0.0105 0.4976±0.0009 0.3930±0.0194 0.3468±0.0038厚壁菌门Firmicutes Phylum 0.1622±0.0109 0.0390±0.0000 0.0389±0.0003 0.2808±0.0310气单胞菌属Aeromonas Gunus 0.3900±0.0039 0.2840±0.0070 0.3122±0.0115 0.2281±0.0619 Mucinivorans Gunus 0.1440±0.0226 0.2778±0.0070 0.0948±0.0002 0.2648±0.0016丹毒丝菌属Erysipelothrix Gunus 0.1285±0.0149 0.0268±0.0001 0.0263±0.0002 0.2202±0.0184拟杆菌属Bacteroides Gunus 0.1028±0.0188 0.0099±0.0000 0.0106±0.0000 0.0066±0.0000脱硫弧菌属Desulfovibrio Gunus 0.0061±0.0000 0.0281±0.0005 0.0643±0.0019 0.0069±0.0000 Unidentified_JTB215 Gunus 0.0104±0.0000 0.0036±0.0000 0.0044±0.0000 0.0232±0.0002漫游球菌属Vagococcus Gunus 0.0133±0.0001 0.0018±0.0000 0.0021±0.0000 0.0022±0.0000
3 讨论
3.1 饥饿后恢复摄食对日本医蛭肠道菌群多样性的影响
动物体内的微生物群落在宿主营养代谢及免疫调节方面发挥着重要作用[26]。研究表明, 饵料的恢复投喂一方面增加了能量来源并使得微生物数量增加, 另一方面使得肠道微生物种间竞争加剧,加速形成“优势种”并导致各微生物种类和丰度的分化[27—29]。本研究利用高通量测序技术分析了饥饿及恢复摄食对日本医蛭肠道菌群组成及多样性特征的影响。结果发现, 饥饿后恢复投喂, 日本医蛭肠道微生物多样性依次为F7>F14>DZ>JE, 与相关研究结果相符[27—29]。具体表现为, 喂食7d组肠道微生物多样性最高, 饥饿组最低。OTU数据显示与此一致的规律。
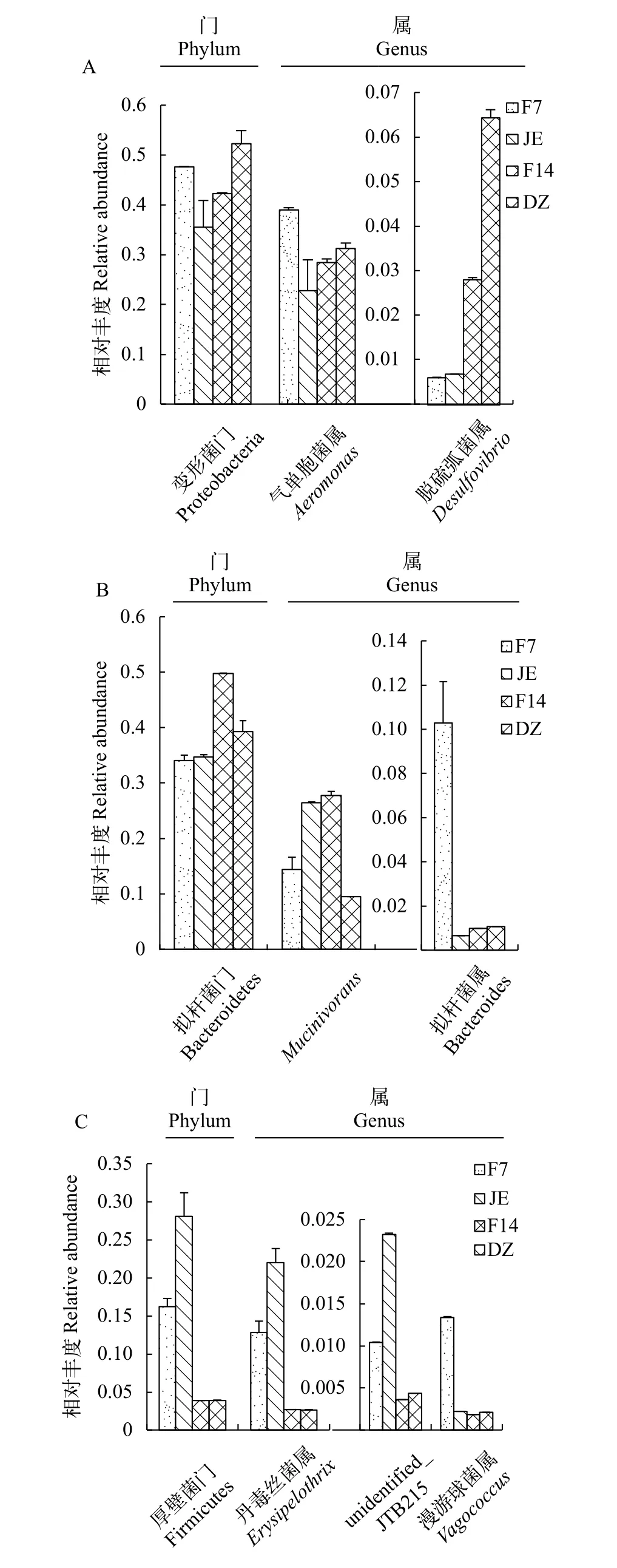
图3 四组样品肠道菌群相对丰度分布图Fig. 3 Relative abundance of H. nipponia gut microbiota in four groups
3.2 饥饿后恢复喂食对日本医蛭肠道菌群丰度及种类的影响
由于所处的宿主肠道生长环境与周围环境紧密相关, 水生动物肠道微生物菌群平衡更容易受到水体环境变化、饵料变换等因素的影响。对饥饿及恢复摄食状态下日本医蛭肠道菌群丰度变化研究发现: 在门水平, 变形菌门、拟杆菌门及厚壁菌门在正常组、饥饿组以及恢复摄食组均占据了95%以上, 为优势菌门。与同属于医蛭属的东方医蛭优势肠道菌群类似[30,31], 与鱼类优势肠道菌群也有共同之处[32,33]。这表明在饥饿后恢复摄食影响了日本医蛭优势菌门的丰度, 但未影响优势菌门的种类。与现有鱼类及其他脊椎动物研究的结果略为不同, 饥饿及恢复摄食对鱼类等脊椎动物优势菌群丰度和种类均可能产生一定的影响[27,34,35], 但在本研究中日本医蛭优势菌门种类却几乎未变, 究其原因可能与鱼类及其他陆生脊椎动物喂食的饲料,本身就含有较多的外源微生物, 而本研究中日本医蛭系人工饲养, 以消毒的肠衣填充新鲜健康猪血投喂, 因而所含的外源微生物较少有关。
在属分类水平, 以气单胞菌属、Mucinivorans属、拟杆菌属以及丹毒丝菌属等组成了日本医蛭核心肠道微生物群, 这一发现与已有欧洲医蛭[36]、侧纹医蛭[37]、东方医蛭[38]以及北美医蛭[39]研究结果基本一致。气单胞菌属具有溶解血细胞的溶血素功能[40], 可参与消化医蛭摄食的血液[41]。在本研究中, 日本医蛭在饥饿恢复摄食后, 气单胞菌属数量迅速上升, 可能与食物消化等功能相关。Mucinivorans为理岩菌科新属[42,43], 该菌参与厌氧代谢, 并利用碳水化合物作为能量来源[44], 将葡萄糖、乳糖、甘露糖和蜜二糖等代谢为醇类、乙酸、丙酸、甲酸和琥珀酸[42], 还可以代谢水蛭肠细胞分泌的黏液, 为肠道微生物菌群定植提供有利条件[40]。本研究中饥饿的日本医蛭在摄食后,Mucinivorans出现不同水平的回升, 与已有研究结果一致[45,46]。可能是由于日本医蛭吸食血液后,Mucinivorans参与食物中碳水化合物代谢, 为机体提供能量有关[46]。脱硫弧菌属、拟杆菌属均在饥饿摄食后水平有所回升, 可能与日本医蛭的消化、营养吸收等功能也较为相关。此外, 丹毒丝菌属在饥饿状态下水平达到最高, 其具体功能及作用还有待进一步研究。

图4 组间差异显著物种分析图Fig. 4 Difference in dominant microorganisms between groups
