AmoA、AmoE和AmoF蛋白在嗜水气单胞菌铁载体合成中的作用研究
2019-05-29冯宇晴张倩倩章晋勇张兰梨马丽娜冯东岳吴振兵郝静文王姝懿李爱华
冯宇晴 张倩倩 章晋勇 张兰梨 马丽娜 冯东岳 吴振兵 郝静文 王姝懿 李爱华
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049;3. 吉林大学药学院, 长春 130000; 4. 全国水产技术推广总站, 北京 100125)
嗜水气单胞菌(Aeromonas hydrophila)隶属于气单胞菌科气单胞菌属, 革兰氏阴性短杆菌, 广泛分布于水体环境中[1,2], 是一种典型的人、畜、鱼共患病病原菌[3], 该致病菌对淡水养殖鱼类危害很大, 给水产养殖业造成了严重的经济损失[4]。嗜水气单胞菌致病机制十分复杂, 涉及到分泌系统、胞外产物、黏附因子、群体感应系统及铁螯合系统等多种毒力因子[5]。
铁作为重要的微量元素, 在生物体的光合作用、呼吸作用、三羧酸循环、氧转运、基因调控、DNA生物合成等生物过程中发挥重要的作用[6]。然而, 环境中可直接利用的铁浓度很低, 在有氧和中性pH条件下, 铁高度不溶, 通常以三价铁氧化物水合物的形式存在[7], 在动物体内, 铁与转铁蛋白、乳铁蛋白、铁蛋白和血红素蛋白等蛋白紧密结合[8]。因此, 细菌进化出多种复杂的机制从环境和宿主体内摄取铁, 其中一条主要的途径是分泌出一种低分子量且结构多样的铁螯合剂——铁载体[9]。铁载体能够有效的从三价铁复合物和铁结合蛋白中摄取铁, 然后通过细菌外膜铁载体受体、周质结合蛋白、ABC转运系统将三价铁转运至胞内, 以维持细菌的正常生长[10]。有研究表明, 嗜水气单胞菌可同时利用2种机制摄取铁, 一种是依赖铁载体的机制, 另一种则是从含有血红素的蛋白中摄取铁[11]。
1982年, 国外研究者Andrus等首次报道嗜水气单胞菌能够产生儿茶酚类铁载体, 随着研究的推进,十几年后铁载体的四种结构得到确证, 每种结构中都包含2,3-二羟基苯甲酸和赖氨酸, 苯丙氨酸、色氨酸和甘氨酸的存在与否决定了铁载体的4种不同结构[12]。嗜水气单胞菌ATCC 7966全基因组测序完成, 通过基因组比对方法推测出铁载体合成基因簇AHA2473-AHA2479, 共包含7个基因[13]。Barghouthi等[14]通过转座子插入失活的方法证实了amoC基因(原文献中名为amoA, 现命名为amoC)参与铁载体的合成, 该基因转录翻译为异分支酸合成酶, 参与合成途径的第一步, 使得分支酸转变为异分支酸。2016年,amoG、amoH也被证实与铁载体的合成相关, 其中amoG基因失活导致铁载体合成缺陷,amoH基因缺失株只能合成2种结构的铁载体[15]。铁载体的合成过程十分复杂, 通常需要一套完整的专用基因来编码所需的生物合成酶。本研究首先用RT-PCR初步了解amoA、amoE, 以及amoF基因在富铁和低铁条件下的转录水平, 再利用融合PCR和基因同源重组原理, 以自杀性质粒pRE112为载体构建基因缺失株ΔamoA、ΔamoE和ΔamoF, 确认这3个蛋白在嗜水气单胞菌铁载体合成途径中的作用。
1 材料与方法
1.1 菌株及质粒
嗜水气单胞菌4LNC202由本实验室于2008年6月在患病鲢鱼肝脏中分离保存[16], 具有氨苄青霉素抗性(表1); 大肠杆菌S17-1λpir及pRE112质粒均由中国科学院水生生物研究所谢海侠老师馈赠[17]。

表1 本试验中使用的菌种和质粒Tab. 1 Strains and plasmids used in this study
1.2 培养基
TSB培养基、10×MM9培养基和CM9培养基。10×MM9培养基和CM9培养基制备方法如下:10×MM9培养基: KH2PO43 g、NaCl 5 g、NH4Cl 10 g、ddH2O 100 mL, 121℃高压灭菌20min; CM9培养基: Na2HPO46 g、KH2PO43 g、NaCl 0.5 g、NH4Cl 1 g、ddH2O 1000 mL、调节pH=7.4、121℃高压灭菌20min, 待液体冷却后依次加入以下无菌物质: 20%葡萄糖10 mL、1 mol/L MgSO42 mL、1 mol/L CaCl20.1 mL、10%去铁水解酪蛋白20 mL。
1.3 主要的试剂及仪器
DNA Marker购自北京擎科新业生物技术有限公司, 2×Taq MasterMix购自北京康为世纪生物科技有限公司; 细菌基因组提取试剂盒、质粒提取试剂盒购于OMEGA公司; 细菌RNA提取试剂盒购自QIAGEN公司, 一步法无缝克隆试剂盒购自南京诺唯赞生物科技有限公司; 限制性内切酶购自Fermentas公司; PrimeSTAR Max DNA Polymerase、反转录试剂盒购自大连TaKaRa公司; 蔗糖、氯霉素、氨苄青霉素购自Sigma公司。PCR仪购于Thermo公司; 核酸电泳仪购于Bio-Rad公司。
1.4 引物的设计与合成
采用生物软件Primer 5.0设计实时荧光定量PCR引物对(表2)和构建基因缺失株所用引物对(表3), 引物均由北京擎科新业生物技术有限公司合成。

表2 实时荧光定量PCR引物Tab. 2 Primers used in Real-time quantitative PCR
1.5 在富铁、低铁条件下amoA、amoE、amoF基因转录水平检测
嗜水气单胞菌4LNC202划线接种于TSA平板,28℃培养过夜。挑单菌落分别接种于TSB培养基和CM9培养基中, 在28℃、180 r/min条件下培养至对数期。参照QIAGEN RNA提取试剂盒说明书抽提细菌RNA, 1%琼脂糖凝胶电泳检测RNA质量, 超微量分光光度计NanoDrop2000测定RNA浓度。取1 μg RNA进行反转录, 具体步骤参考试剂盒说明书, 反转录后的cDNA于-20℃保存备用。
选取稳定表达的16S rRNA基因作内参, RTPCR检测amoA、amoE、amoF基因在富铁和低铁条件下表达量的变化。
20 μL PCR反应体系如下: SYBR GreenⅠMix 10 μL, 上、下游引物(10 μmol/L)各0.8 μL, 模板cDNA 1 μL, ddH2O 7.4 μL。
PCR反应条件为: 95℃预变性2min; 95℃变性10s, 58℃退火30s, 72℃延伸20s, 39个循环。

表3 构建基因缺失突变株所用引物Tab. 3 The primers used to construct the gene deletion mutant strain
1.6 基因缺失突变株的构建与鉴定
根据Ho等[18]的方法构建基因缺失株。 以菌株4LNC202全基因组DNA为模板, 用引物P1/P2 和P3/P4 分别扩增目的基因上、下游同源臂。通过融合PCR的方法, 以上、下游同源臂为模板, 使用P1/P4 引物, 融合上下游同源臂。
用限制性内切酶XbaⅠ和NdeⅠ将pRE112线性化, 根据一步法无缝克隆试剂盒说明书将线性化pRE112质粒与融合上下游同源臂进行连接。方法简述如下: 20 μL反应体系包含5×CE Ⅱ Buffer 4 μL、Exnase Ⅱ 2 μL、线性化PRE112 1 μL、融合上下游同源臂1 μL、ddH2O 12 μL。37℃条件下反应30min, 反应结束后立即将离心管置于冰上。取上述10 μL连接产物转化至大肠杆菌S17-1λpir感受态细胞中, 将培养物涂布TSA+Cm平板上, 筛选阳性克隆并进行菌落PCR鉴定。鉴定后的阳性质粒送北京擎科新业生物技术有限公司测序。
将含有重组质粒的大肠杆菌S17-1λpir作为供体菌, 以嗜水气单胞菌4LNC202 为受体菌, 通过接合转移的方式将重组质粒从大肠杆菌S17-1λpir转移到嗜水气单胞菌4LNC202 中, 经2次同源重组得到基因缺失突变株。具体操作如下:
(1)接合。供体菌S17-1λpir和受体菌4LNC202分别培养至OD600达到0.5, S17-1λpir和4LNC202按照2∶1比例混匀, 取100 μL转移至新鲜湿润的TSA平板中央, 28℃ 静置培养24h; 用PBS冲洗TSA平板,取200 μL菌液涂布于TSA+Cm+AmP平板, 28℃培养24—48h。以P1/P4为引物做菌落PCR筛选接合成功的重组子, 此时重组质粒已整合到嗜水气单胞菌4LNC202 基因组上。
(2)二次交换及缺失株筛选。选取成功结合的重组子, 接种至 5 mL TSB液体培养基中, 28℃静置培养24h, 进行二次交换。然后将菌液梯度稀释涂布于TSA+Amp+10%蔗糖的平板上, 28℃培养至长出单个菌落, 挑取单克隆同时划线接种于TSA+Cm+Amp、TSA+Amp两类平板, 28℃培养 24h。选择只在TSA+Amp平板生长的单克隆, 划线接种于TSA+Cm平板, 如若不生长, 则可能是突变株或是恢复到野生型的菌株。以P1/P4为引物PCR检测,选择产生正确目的条带的单克隆保种。
1.7 RT-PCR鉴定基因缺失突变株
RNA与cDNA的制备方法、RT-PCR的反应体系和反应条件同1.5, PCR反应结束后, 取5 μL扩增产物经1%琼脂糖凝胶电泳检测, 凝胶成像系统记录结果并照相。预期如下: 用短引物对扩增疑似基因缺失突变株ΔamoA、ΔamoE和ΔamoF不能扩增出任何条带, 而扩增野生株WT获得的条带大小分别约为164、141和180 bp。
经上述PCR、RT-PCR筛选到的阳性基因缺失株送北京擎科新业生物技术有限公司测序, 确认嗜水气单胞菌突变株ΔamoA、ΔamoE和ΔamoF序列是否正确。
1.8 生长特性
不同浓度2,2-联吡啶作用下野生株与突变株在CM9培养基中的生长实验嗜水气单胞菌野生株与突变株菌液划线接种于TSA平板上, 在28℃恒温培养箱中过夜培养。挑单菌落接种于TSB液体培养基中, 28℃、180 r/min摇床培养至对数期,PBS洗涤3次后重悬, 调整OD600为0.5, 按照1∶1000(v/v)的比例将菌液接种于含有不同浓度铁螯合剂2,2-联吡啶的CM9培养基中, 28℃、180 r/min摇床培养18h, 在600 nm波长下测吸光值, 作为后续实验2,2-联吡啶添加浓度的依据。
细菌在富铁、低铁培养基中的生长实验根据上述方法调整野生株突变株OD600为0.5, 按1∶100(v/v)的比例将上述菌液接种于50 mLCM9培养基(2,2-联吡啶: 50 μmol/L)中, 28℃ 180 r/min振荡培养, 每种菌体设置3个重复, 每隔1h用分光光度计检测一次菌液吸光值(OD600), 连续6h, 记录数据并绘制曲线。
1.9 铁载体的检测
微生物铁载体根据其螯合基团的化学特性进行分类, 一般分为三大类, 即异羟肟酸类铁载体、儿茶酚类载体、羟基羧酸盐类铁载体。Arnow[19]在1937年提出儿茶酚类铁载体的检测方法, Arnow法检测铁载体的实验原理是: 含有苯环或者羟基的化合物在酸性条件下与亚硝酸钠钼酸钠溶液混合可以生成一种红色的物质, 并在510 nm处有最大光吸收值。铁载体活性检测采用CAS固体平板检测,该方法由Schwyn等[20]于1987年提出, CAS实验检测铁载体的原理: 铁载体能够与Fe3+形成更稳定的鳌合物, 伴随着Fe3+从其结合紧密CAS-Fe3+-HTDMA蓝色络合物转移到铁载体中发生颜色变化。
Arnow实验根据1.8的方法调整野生株突变株OD600为0.5, 按1∶1000(v/v)的比例接种于CM9培养基(2,2-联吡啶: 50 μmol/L), 28℃、180 r/min摇床培养24h, 4000 r/min 4℃离心10min, 吸取上清液用0.22 μm的过滤器进行过滤, 滤液于-20℃冰箱保存, Arnow实验参照文献[19]方法检测。
CAS固体平板检测挑单菌落接种于TSB液体培养基中, 28℃、180 r/min摇床过夜培养, 吸取5 μL菌液接种于CAS固体平板上, 28℃培养箱静置培养24h。CAS平板制备方法如下:
CAS-HDTMA溶液配制: (1)取6.0 mL十六烷基三甲基溴化铵(HDTMA)溶液(10 mmol/L)加入100 mL容量瓶中; (2) 1.5 mL FeCl3溶液(1 mmol/L, 10 mmol/L盐酸作溶剂)和7.5 mL铬天青溶液(2 mol/L)混匀后沿玻璃棒加入容量瓶中; (3) 4.307 g无水双甲胺溶于30 mL ddH2O, 小心加入6.25 mL浓盐酸, 所得溶液加入上述容量瓶中, 最后用双蒸水定容至100 mL。
在1 L锥形瓶中依次加入NaOH 6.0 g、ddH2O 750 mL、PIPES 30.24 g、10×MM9培养基100 mL、琼脂20 g, 调节pH=6.8, 121℃高压灭菌20min, 待溶液冷却至50℃左右依次加入下列无菌试剂: 10%去铁水解酪蛋白30 mL、20%葡萄糖10 mL、1 mol/L MgCl21 mL、1 mol/L CaCl20.1 mL, 然后缓慢加入100 mL CAS-HDTMA溶液, 混匀后倒平板。
1.10 数据统计分析
实验结果图通过GraphPad Prism 7绘制, 采用双尾T检验方法。显著性差异定义为:*P<0.05,**P<0.01,***P<0.001。
2 结果与分析
2.1 在富铁、低铁条件下amoA、amoE、amoF基因转录水平检测结果
嗜水气单胞菌4LNC202分别在富铁培养基TSB及低铁培养基CM9中培养至对数期, 提取细菌RNA, 通过RT-PCR实验检测amoA、amoE、amoF基因在富铁及低铁条件下的转录水平。由图1可知, 在低铁条件下,amoA、amoE、amoF基因极显著上调, 实验结果表明amoAEF基因的表达受到铁的调控。

图1 amoA、amoE、amoF表达量变化Fig. 1 amoA, amoE, amoF gene expression level
2.2 基因缺失突变株菌落PCR鉴定
重组缺失质粒送北京擎科新业生物技术有限公司测序后, 通过NCBI的BLAST功能在线比对确认序列正确无误。
分别用目的基因上下游同源臂引物P1/P4, 对缺失株进行PCR验证, 实际片段大小与理论大小相符合, 结果表明成功构建基因缺失株ΔamoA、ΔamoE、ΔamoF。AMA-upF-P1/AMA-doR-P4、AME-upF-P1/AME-doR-P4、AMF-upF-P1/AMF-doR-P4对野生株基因组模板进行PCR扩增产物大小分别1459、2442、3806 bp, 对各自对应基因缺失株基因组模板进行PCR扩增产物大小分别为727、837、783 bp (图2)。
2.3 基因缺失突变株RT-PCR鉴定
进一步采用RT-PCR在RNA水平上验证基因缺失突变株ΔamoA、ΔamoE和ΔamoF, 提取RNA、反转录后用引物对QAMA-F/R、QAME-F/R和QAMF-F/R分别对嗜水气单胞菌基因缺失突变株ΔamoA、ΔamoE和ΔamoF与野生株WT进行PCR扩增。结果显示突变株ΔamoA、ΔamoE和ΔamoF均未扩增出条带, 而对野生菌株扩增分别得到164、141 和180 bp大小的条带。RT-PCR结果进一步证实基因缺失突变株ΔamoA、ΔamoE和ΔamoF构建成功(图3)。
2.4 生长能力测定
不同浓度2,2-联吡啶作用下野生株与突变株在CM9培养基中的生长实验嗜水气单胞菌野生株与突变株分别在2,2-联吡啶终浓度为50、75、100 μmol/L的CM9培养基中培养18h后, 测600 nm波长下的吸光度值(表4)。

表4 细菌在不同浓度2,2-联吡啶下的生长实验Tab. 4 Growth experiment of bacteria under 2,2-dipyridine at different concentrations
在不同浓度下, 野生株与突变株ΔamoA、ΔamoE和ΔamoF生长均存在极显著性差异。当2,2-联吡啶终浓度为50 μmol/L时, 突变株ΔamoA、ΔamoE和ΔamoF相较于嗜水气单胞菌野生株WT生长缓慢; 当浓度大于75 μmol/L时, 突变株ΔamoA、ΔamoE和ΔamoF基本停止生长。以本实验为依据,后续实验中2,2-联吡啶终浓度均为50 μmol/L。
细菌在富铁、低铁培养基中的生长实验嗜水气单胞菌野生株与突变株分别在富铁培养基TSB和低铁培养基CM9(2,2-联吡啶终浓度为50 μmol/L)中培养6h, 每隔1h在波长600 nm下测吸光值。结果如下, 在TSB培养基培养时, 野生株WT与突变株ΔamoA、ΔamoE和ΔamoF生长无差异(P>0.05, 图4A)。而用CM9(2,2-联吡啶终浓度为50 μmol/L)培养基培养时, 野生株WT与突变株ΔamoA、ΔamoE和ΔamoF生长均存在显著性差异(P<0.05), 突变株ΔamoA、ΔamoE和ΔamoF之间生长不存在显著性差异(P>0.05, 图4B)。
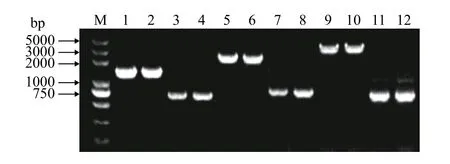
图2 基因缺失株ΔamoA、ΔamoE、ΔamoF菌落PCR鉴定Fig. 2 PCR identification of gene deletion strains ΔamoA, ΔamoE and ΔamoF
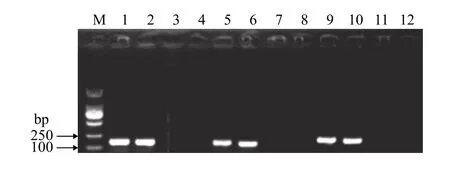
图3 基因缺失株ΔamoA、ΔamoE、ΔamoF RT-PCR鉴定Fig. 3 RT-PCR identification of gene deletion strains ΔamoA,ΔamoE and ΔamoF
2.5 铁载体的检测
Arnow实验为了比较野生株与突变株铁载体合成差异, 采用Arnow法进行检测。野生株WT在波长510 nm的吸光值为0.14±0.03, 突变株ΔamoA为0.006±0.008, 突变株ΔamoE为0.277±0.013,突变株ΔamoF为0.279±0.019。野生株WT与突变株ΔamoA、ΔamoE和ΔamoF存在极显著差异。ΔamoA相较于野生株WT极显著降低, ΔamoE和ΔamoF相较于野生株WT极显著升高(图5)。
CAS固体平板实验为了比较野生株与突变株铁载体合成情况, 采用CAS固体平板方法进行检测。野生株WT形成的黄色晕圈直径为(12.907±0.381) mm, 突变株ΔamoA、ΔamoE和ΔamoF均不产生黄色的晕圈, 野生株WT与突变株ΔamoA、ΔamoE和ΔamoF存在极显著差异(P<0.001)。实验结果表明基因缺失突变株ΔamoA、ΔamoE和ΔamoF铁载体合成缺陷(图6)。
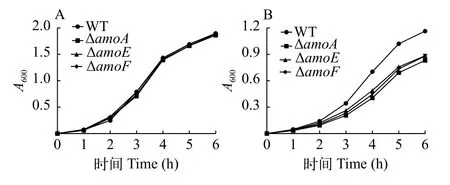
图4 细菌在TSB (A)和CM9 (B)培养基中的生长实验Fig. 4 Growth experiment of bacteria in TSB (A) and CM9 (B)

图5 Arnow实验Fig. 5 Arnow assays
3 讨论
虽然嗜水气单胞菌铁载体的生物化学结构在30年前已经阐释得十分清楚, 但关于其合成途径的相关研究信息却相对贫乏。1989年研究人员提出嗜水气单胞菌铁载体的合成分为两步, 第一步合成2,3-二羟基苯甲酸(DHBA), 第二步以DHBA为前体,在此基础上加以组装加工[21]。Seshadri等[22]通过基因组比对后发现, 霍乱弧菌与嗜水气单胞菌关于铁载体的合成途径十分相似, 推测出嗜水气单胞菌铁载体合成基因簇amoCEBFAGH, 这个基因簇与弧菌的vibCEBFADH基因簇相对应。vibABC主要参与DHBA的合成[23], 而vibBDEFH在组装加工过程中发挥作用。张从刚[24]详述了DHBA的合成过程:分支酸在异分支酸酶合成酶VibC的作用下转变为异分支酸, 异分支酸在异分支酸酶VibB的作用下转化为2,3-二羟-2,3二羟基苯甲酸, 接着2,3-二羟-2,3二羟基苯甲酸在2,3-二羟-2,3二羟基苯甲酸脱氢酶的作用下脱氢转变为2,3-二羟基苯甲酸(DHBA)。本研究对野生株WT与基因缺失突变株ΔamoA、ΔamoE和ΔamoF进行Arnow实验时, 实验结果显示,amoA基因缺失后所测得的A510极显著降低, 而amoE、amoF基因缺失后使得A510值极显著升高, 但CAS检测实验结果显示基因缺失突变株ΔamoA、ΔamoE和ΔamoF都存在铁载体合成缺陷。由此可以推断, 基因缺失突变株ΔamoA不能合成前体2,3-二羟基苯甲酸, 而基因缺失突变株ΔamoE和ΔamoF仍然可以正常合成DHBA, 但不能对DHBA正常装配, 导致DHBA胞外大量堆积, 从而使得A510值显著性升高。因此,amoA基因参与铁载体合成第一步-2,3-二羟基苯甲酸的合成,amoE、amoF参与铁载体合成第二步, 本研究结果与张从刚结论一致。对于amoE、amoF是参与铁载体的组装加工具体机制还有待更进一步的研究。
在生长实验中, 野生株WT与突变株ΔamoA、ΔamoE和ΔamoF在TSB培养基中长势基本一致, 说明在富铁条件下,amoA、amoE、amoF基因的缺失不影响细菌的生长; 用CM9培养基培养时, 突变株ΔamoA、ΔamoE和ΔamoF的生长能力相较于野生株WT变弱, 说明在低铁条件下,amoA、amoE、amoF基因的缺失使得细菌的生长受到抑制。
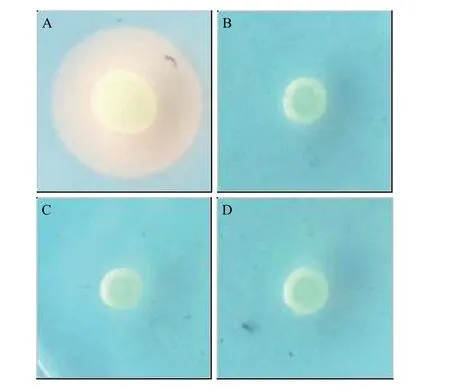
图6 CAS固体平板实验Fig. 6 CAS plate assays
目前, 气单胞菌属不仅是鱼类和蛙类的重要病原菌, 同时也被认为是引起免疫缺陷人群感染各种并发症的致病菌[25]。铁离子的获取是病原菌感染过程中的重要步骤, 能够显著影响细菌的毒力, 而微生物从环境中摄取铁离子的主要机制是合成分泌铁载体。鼠疫杆菌基因突变株Δirp2铁载体合成缺陷, 且不能在无铁培养基中生长, 当给小鼠皮下接种时, 鼠疫杆菌野生株LD50为1.3×102, 突变株Δirp2为1.3×106, 突变株Δirp2毒力极显著降低[26]。Heesemann等[27]、Abdelhamed等[28]、Oh等[29]、Takase等[30]研究表明铁离子的摄取与细菌的毒性显著相关。Zywno等[31]也曾提出铁载体的合成与否可以作为毒性嗜水气单胞菌的判定依据。未来可以通过进一步的攻毒实验来比较野生株与嗜水气单胞菌铁载体合成缺陷株毒力的差异, 阐明铁载体在嗜水气单胞菌致病中的作用, 为重组弱毒疫苗的研制奠定理论基础。此外, 对于这几个基因在铁载体合成中的具体分工协作机制还需进一步阐明。
本研究利用同源重组成功构建了嗜水气单胞菌基因缺失突变株ΔamoA、ΔamoE和ΔamoF, 发现amoA、amoE和amoF基因是嗜水气单胞菌铁载体合成的关键基因, 其缺失会导致细菌在低铁环境中的生长能力受到抑制。
