基于凝胶过滤色谱的β2微球蛋白标准品单体定量检测方法
2019-05-29暴晓博王玉凤贾凌云
暴晓博,任 军,王玉凤,贾凌云*
(1. 大连理工大学生物工程学院, 辽宁 大连 116023;2. 康元医疗科技(大连)有限公司, 辽宁 大连 116000)
肾脏病是严重危害人类健康的重大慢性疾病。相关流行病学资料显示,我国人群中慢性肾脏病(CKD)的发生率约为11%~13%[1]。透析相关淀粉样变是经过长期透析治疗的肾病患者常见的并发症。该症主要表现为关节和关节周围组织的淀粉样沉积,导致骨和关节的致残性病变[2]。该并发症的发病率随透析年龄和患者年龄增长而增加。淀粉样物质还可以沉积于消化道和心血管,引起吞咽痛、消化道出血、肠梗阻和心肌淀粉样变,严重者可死于充血性心力衰竭。
血液中β2微球蛋白(beta-2-microglobulin, B2M)的水平升高导致的淀粉样沉积是透析相关淀粉样变的显著特征[3]。B2M是1968年瑞典Berrgard等[4]首先从肾小管蛋白尿中分离发现的由100个氨基酸残基组成的单链多肽,相对分子质量为11.8 kDa。在健康人体内B2M以相对稳定的速率合成和代谢,血清中的含量一般为1.5~3 mg/L[5]。肾病患者由于肾脏功能受损,导致体内生成的B2M无法代谢,而常规透析等手段很难去除B2M这种中分子物质[6],长期透析的肾病病人血清中的B2M含量可以达到20~50 mg/L,血清中高浓度的B2M导致透析相关淀粉样变的发生。因此,研究B2M单体的聚集过程对于预防和治疗透析相关淀粉样变具有重要的意义[7]。此外,对B2M的透析过滤效果也是表征高通量血液透析器毒素透过性能的重要质量指标之一。上述两方面的应用需求都对B2M标准品的质量提出了较高的要求。
评估血液透析器的透过效率需要使用B2M作为标志物,使用商业化的B2M试剂盒(通过抗原抗体结合的原理进行检测[8,9])检测透析前后血浆中的B2M浓度来计算透过效率。由于B2M具有较强的疏水性,在制备和储存的过程中容易形成二聚体。当使用的B2M标准品中有B2M二聚体存在时,由于B2M二聚体相比B2M单体更不易透过血液透析膜,导致对透过效率评价结果的可信度下降。因此,有必要建立B2M标准品生产过程中单体含量的分析方法。
目前,B2M有肾脏病人尿液中提取和基因重组表达两种来源。由于在产量和生产成本上的优势,市场上B2M产品多通过基因重组表达获得[10-12]。B2M标准品纯度的检测采用基于抗体抗原特异性识别的免疫比浊法,该类检测试剂盒测定的是B2M总量,很难区分出单体、二聚体及多聚体。且市售的试剂盒主要用于临床诊断,其检测方法的线性范围远小于产品质控中常用的浓度范围[13,14]。因此,建立一种针对B2M标准品生产过程中单体和聚集体的快速准确定量方法对于B2M的生产及质控具有重要意义。凝胶过滤色谱已经广泛应用于蛋白质复性过程中聚集体与蛋白质单体的分析[15,16],选择合适的凝胶过滤色谱条件可以实现对B2M单体的定性定量检测。
本研究通过凝胶筛分高效液相色谱建立了B2M单体的定量检测方法,并对方法的精确度和稳定性加以验证。
1 实验部分
1.1 仪器、试剂与材料
液相色谱Agilent 1200 Series(美国Agilent Technologies);凝胶筛分色谱柱:TSKgel SuperSW2000(30 cm×4.6 mm, 4 μm,日本Tosoh Bioscience); Millipore Elix20超纯水系统(美国Millipore);精密电子天平(北京赛多利斯仪器系统有限公司)。
特定蛋白质分析仪及配套B2M免疫比浊检测试剂盒(石家庄禾柏科技有限公司)。20×磷酸缓冲液(PBS, 0.2 mol/L, pH 7.2~7.4)、Bradford蛋白质浓度测定试剂盒(北京索莱宝科技有限公司)。
1.2 单体B2M和二聚体B2M的制备
构建了B2M的重组表达载体B2M-pET23a,并在大肠杆菌BL21中进行表达。对获得的B2M包涵体进行了复性。复性后的B2M使用AKTA-Purifer100通过Q-Sepharose强阴离子交换介质纯化。使用0.01 mol/L pH 8.5 Tris-HCl缓冲液上样。B2M单体洗脱条件:0.1 mol/L NaCl, 0.01 mol/L pH 8.5 Tris-HCl缓冲液。B2M二聚体洗脱条件:0.3 mol/L NaCl, 0.01 mol/L pH 8.5 Tris-HCl缓冲液。检测波长为280 nm。
收集不同条件下的洗脱峰,使用非还原十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)初步检测其纯度。单体B2M超滤换液至超纯水中,冷冻干燥制成干粉保存。二聚体B2M超滤换液至超纯水中,于-20 ℃冷冻保存。
1.3 标准蛋白质溶液的配制
1×PBS的制备:20×PBS(pH=7.4)与超纯水按照体积比1∶19的比例混合,混合后经0.22 μm水相滤膜过滤,高温灭菌,超声除气处理。
使用精密分析天平称取10.0 mg单体B2M干粉,加入20 mL 1×PBS中,充分溶解制成B2M质量浓度为0.50 g/L的蛋白质溶液,使用B2M免疫比浊检测试剂盒测定溶液中B2M的浓度,测定结果应与理论值误差小于10%。
1.4 色谱条件
凝胶筛分柱:TSKgel SuperSW2000;柱温:25 ℃;流动相:1×PBS;进样体积:10 μL;流速:0.5 mL/min;紫外检测波长:280 nm。
1.5 凝胶过滤液相色谱对B2M的定性分析
使用非还原SDS-PAGE检测标准单体蛋白溶液和二聚体样品的纯度。使用Bradford试剂盒测定二聚体样品中总蛋白质浓度。将标准单体蛋白质溶液与二聚体溶液按体积比1∶1混合,制成混合样品。标准单体蛋白质溶液、二聚体蛋白质溶液、混合样品依次经凝胶过滤液相色谱进行样品纯度检测。
1.6 B2M单体定量检测方法的建立
1.6.1B2M标准曲线的线性范围及定量限
将标准溶液用1×PBS逐级稀释,在设定的色谱条件下进样测定。以峰面积(y)为纵坐标,B2M的质量浓度(x, g/L)为横坐标建立标准工作曲线。定量限以10倍信噪比(S/N=10)计算。
1.6.2检测方法的精密度及稳定性
在B2M质量浓度为0.10 g/L的PBS中添加一定质量(0.10、0.20、0.30 mg)的B2M干粉进行加标回收试验,计算蛋白质单体回收率和相对标准偏差。每种样品平行测定3份。
先在二聚体样品中添加B2M干粉至终质量浓度为0.13 g/L,在此基础上继续添加B2M干粉至终质量浓度为0.23、0.33、0.43 g/L,进行加标回收试验,计算蛋白质单体回收率和相对标准偏差。每种样品平行测定3份。
将B2M质量浓度为0.20 g/L的1×PBS溶液于室温放置5 h,每隔1 h取样,使用凝胶过滤色谱法测量蛋白质浓度。
1.6.3凝胶过滤液相色谱法与免疫比浊试剂盒分析B2M样品的优势比较
在二聚体样品中添加一定质量的B2M单体干粉(终浓度为0.10、0.20、0.30 g/L),分别使用凝胶过滤高效液相色谱法和免疫比浊试剂盒检测B2M单体浓度。

图 1 强阴离子交换色谱纯化B2MFig. 1 Purification of beta-2-microglobulin (B2M) bystrong anion exchange chromatography Peak 1: B2M eluted by 0.1 mol/L NaCl and 0.01 mol/L Tris-HCl at pH=8.5; Peak 2: B2M eluted by 0.3 mol/L NaCl and 0.01 mol/L Tris-HCl at pH=8.5. UV 280: absorbance at 280 nm; cond: conductivity.
2 结果与讨论
2.1 单体B2M和二聚体B2M的制备及检测
为了进一步的定性分析,需要制备高纯度的单体B2M和二聚体B2M。由于B2M在大肠杆菌中基因重组表达形成包涵体,包涵体需要复性后才能得到可溶的B2M。在复性的过程中,有部分B2M会通过分子间二硫键形成二聚体,如图1所示,复性后B2M与强阴离子交换色谱结合后,在0.1 mol/L NaCl (0.01 mol/L Tris-HCl, pH=8.5)和0.3 mol/L NaCl (0.01 mol/L Tris-HCl, pH=8.5)下洗脱收集到两个洗脱峰。经还原SDS-PAGE检测,如图2a所示,两个洗脱峰分子量均位于B2M单体分子量附近,推测其中一个洗脱峰是分子间二硫键形成的二聚体,在还原电泳中由于二硫键被还原而表现为单体条带。B2M单体和二聚体的空间结构不同影响蛋白质表面负电荷密度,导致出现不同的洗脱条件。经过非还原电泳检测后,如图2b所示,洗脱峰1的蛋白质相对分子质量约为12 kDa,为B2M单体,纯度较高。洗脱峰2主要成分相对分子质量约为23 kDa,是B2M通过分子间二硫键形成的二聚体。洗脱峰2中还有少量单体和多聚体B2M存在。
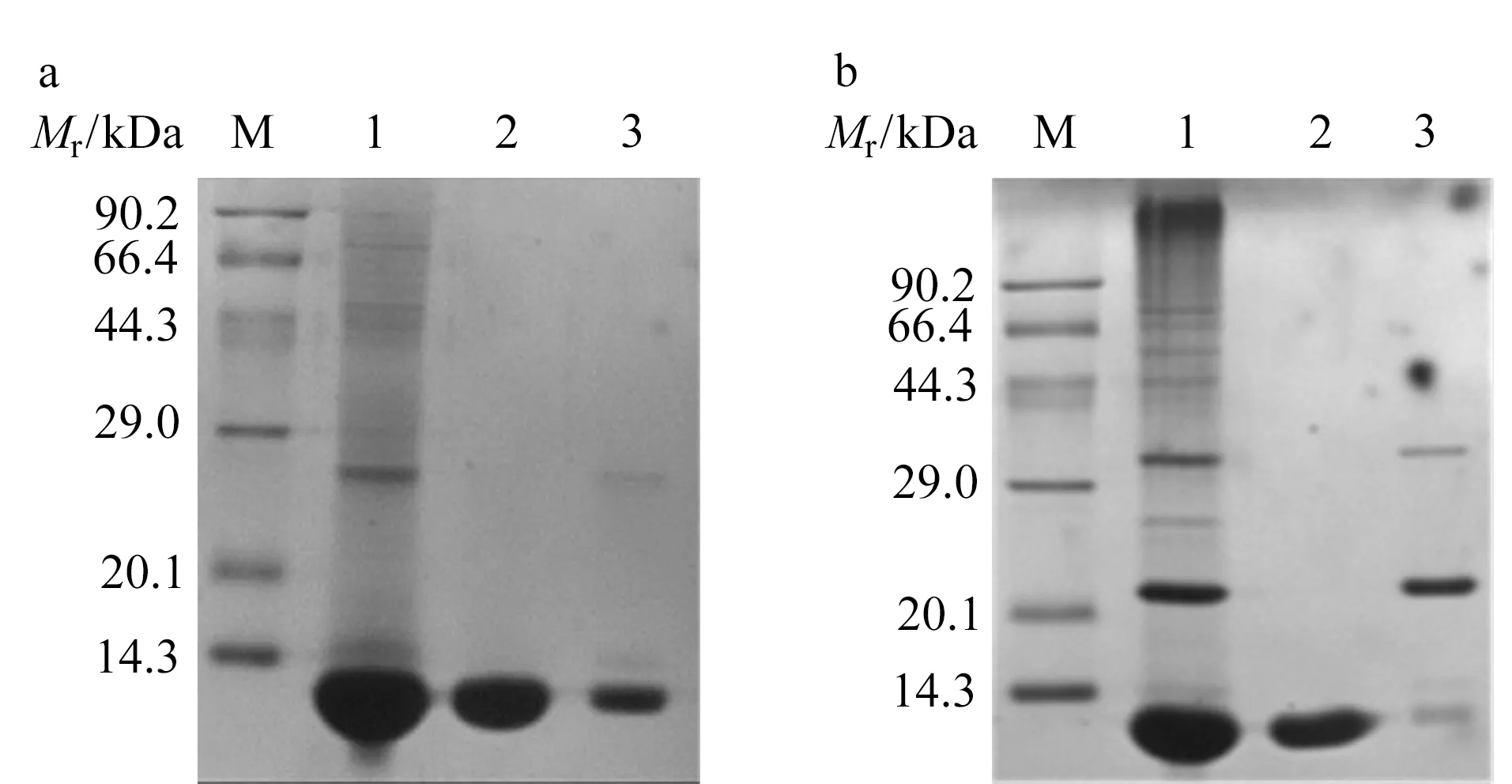
图 2 还原SDS-PAGE和非还原SDS-PAGE检测B2M纯度Fig. 2 Reduced sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) and non-reduced SDS-PAGE of B2M Lane M: low relative molecular mass protein marker; lane 1: B2M before purification; lane 2: peak 1 in Fig. 1; lane 3: peak 2 in Fig. 1.
将单体B2M超滤换液到超纯水中,冷冻干燥制成干粉保存。将二聚体B2M超滤换液到超纯水中,-20 ℃冷冻保存。

图 3 B2M的(a)单体、(b)二聚体及(c)两者混合样品的凝胶过滤色谱图Fig. 3 Gel filtration chromatogram of B2M (a) monomer,(b) dimer, and (c) mixture of monomer and dimer
2.2 凝胶过滤液相色谱对B2M的定性分析结果
制备的单体B2M和二聚体B2M为基于凝胶过滤色谱定性分析B2M样品奠定了基础。按1.4节色谱条件进行定性分析。结果如图3a所示,B2M单体在凝胶过滤色谱上的保留时间约为12 min,峰形尖锐,无杂峰,说明制备的单体蛋白质纯度较高。而图3b所示的B2M二聚体的保留时间约为8 min。两种蛋白质等体积混合后进样的色谱结果如图3c所示,单体和二聚体的峰形尖锐对称,两峰无重叠,可以实现基线分离。
图3b的结果显示制备的二聚体B2M的纯度低于单体,其中含有少量蛋白质单体和多聚体,这与非还原电泳结果一致。二聚体中的单体蛋白质可能是部分二聚体在保存过程中分子间二硫键断裂导致,也可能是在纯化过程中未能完全分离单体和二聚体。使用Bradford试剂盒测量二聚体溶液中的总蛋白质质量浓度为0.47 g/L,根据吸收峰面积积分后的结果计算,二聚体溶液中的单体质量浓度约为0.03 g/L,在后续实验中使用二聚体溶液进行分析时需要将这部分单体浓度计入。
2.3 方法学考察
2.3.1标准曲线的线性范围及定量限
称取10.0 mg单体B2M干粉,加入到20 mL的1×PBS中,充分溶解,制成B2M质量浓度为0.50 g/L的蛋白质溶液,使用1×PBS稀释至B2M质量浓度分别为0.05、0.10、0.20、0.25、0.30和0.40 g/L。不同浓度的样品依次上样,得到一系列B2M单体的UV280吸收峰。以积分峰面积(y)为纵坐标,对应的B2M单体的质量浓度(x, g/L)为横坐标建立标准工作曲线。线性方程为y=29.80x+0.11,相关系数为0.994 8,线性关系良好。线性范围为0.05~0.50 g/L,定量限为0.08 g/L。标准曲线的线性范围包含了生产过程中B2M常见的浓度范围,定量限低于生产过程中B2M的最低浓度,可以用于生产过程中B2M样品的检测。
2.3.2精密度及稳定性
为了验证标准曲线的精密度,向1×PBS溶液和二聚体溶液中添加一定浓度的B2M单体进行加标回收试验,每种样品平行测定3份。进行加标试验前,使用凝胶过滤色谱检测加入单体干粉后的PBS溶液和二聚体溶液中B2M单体的浓度,检测出的溶液本底测量值与根据干粉量计算出的本底添加量一致。因此在表1中只列出了溶液的本底测量值。加标试验结果表明,B2M的平均加标回收率为85.0%~96.7%,相对标准偏差为1.7%~3.3%。结果说明,该检测方法可以满足日常质量检测分析的要求。个别数据回收率较低是由于使用的仪器检出限较高,在测量的浓度范围内有效数字位数较少,导致计算出的回收率较低。
由于实验中所用单通道液相色谱检测一个样品所需时间为15 min,当有多个样品需要测定时,长时间放置在室温的蛋白质样品有可能发生降解或聚集,影响检测结果。为了证实检测结果的有效性,需要进行检测方法的稳定性试验,验证待测样品在一定时间内的稳定性。配制0.20 g/L的B2M溶液,在室温放置5 h,每隔1 h在设定的色谱条件下测定其蛋白质浓度,结果如图4所示。在5 h内蛋白质浓度测定结果比较稳定,没有发生蛋白质降解或聚集的情况,说明实验结果是稳定可信的,测量过程中没有二聚体生成。

表 1 B2M在磷酸盐缓冲液(PBS)和二聚体溶液中的加标
2.3.3凝胶过滤液相色谱法与免疫比浊试剂盒分析B2M样品的优势比较
模拟了生产及储存过程中B2M产品形成聚集体的情况来考察建立的B2M单体定量方法的准确性。在B2M二聚体质量浓度为0.40 g/L(其中B2M单体的本底质量浓度为0.13 g/L)的PBS溶液中分别加入终质量浓度为0.1、0.2、0.3 g/L的B2M单体,分别使用凝胶过滤液相色谱法和B2M免疫比浊试剂盒检测样品中B2M单体的浓度。结果如表2所示,当溶液中有B2M二聚体时,免疫比浊试剂盒的检测结果受到较大干扰,测得的溶液本底浓度达到了实际值的4倍左右,进而导致计算加标结果的回收率也产生较大偏差。而凝胶过滤色谱法能够准确地测量出B2M单体的本底浓度,回收率计算结果也保持良好的准确度,回收率范围是95%~110%。结果表明,免疫比浊试剂盒无法用于B2M标准品生产过程中的质量监控,而凝胶过滤色谱检测方法在有二聚体存在的溶液中仍然可以准确定量B2M单体。在实际生产应用中,根据测得的总蛋白质质量与凝聚过滤色谱测得的单体B2M质量,可以计算出样品中二聚体的含量,进而判断样品是否满足质量要求。
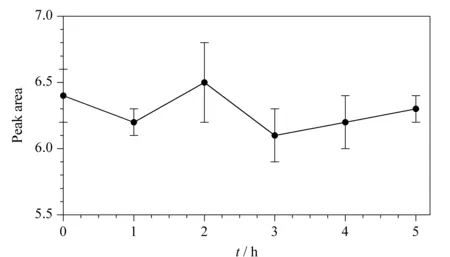
图 4 B2M样品的稳定性(n=3)Fig. 4 Stability of the B2M sample (n=3)

表 2 凝胶过滤色谱与免疫比浊试剂盒测定B2M二聚体溶液中单体
3 结论
建立了凝胶过滤色谱定性定量分析B2M单体的检测方法。本方法主要适用于B2M单体标准品生产过程中产品的质控检验,可以满足B2M标准品生产过程中的纯度及定量检测需求,也可以用于B2M聚集体及聚集过程的相关基础研究。
