基于超高效液相色谱-八端口转子阀的微升级预分级系统的建立
2019-05-29张养军应万涛钱小红
燕 蒙,赵 洋,张养军,应万涛*,钱小红,*
(1. 广东药科大学药学院, 广东 广州 510006; 2. 军事科学院军事医学研究院生命组学研究所,蛋白质组学国家重点实验室, 北京蛋白质组研究中心, 国家蛋白质科学中心-北京, 北京 102206)
色谱和质谱技术的飞速发展,推动了复杂体系中蛋白质组成和动态变化的深度覆盖鉴定与定量研究[1-3]。复杂生物样本常常拥有具有高达10个数量级的浓度范围,导致液相色谱的分离性能和质谱扫描的动态范围难以在单次分析中充分识别样品成分。因此在质谱分析前端,首先运用多维液相色谱系统进行预分离成为当前应对蛋白质组复杂性的重要解决方案。
多维液相色谱系统提供了高效的肽段分离方案,降低肽段的共洗脱,提高了峰容量,同时增加了针对复杂体系检测的动态范围,从而鉴定到更多数量的肽和蛋白质。其中,在线或离线二维液相色谱分离,在蛋白质组研究中被广泛运用。二维色谱由常见的色谱分离方式组合而成,根据不同分离机理分为离子交换色谱、亲水相互作用色谱、反相色谱等方法[4]。其中反相液相色谱(RPLC)具有分析速度快,分离效率高,而且流动相与质谱电喷雾电离(ESI)等电离技术相容,通常作为第二维分离模式。2005年,Gilar等[5]提出高pH反相色谱分馏作为第一维离线色谱分离,与第二维低pH反相液相色谱相结合。尽管两个维度的分离都是基于肽的疏水性质,但pH对某些残基的电荷状态和侧链疏水性的影响很大,因此也可达到很好的分离正交性。与其他方法相比,二维反相色谱在两个维度上都具有非常高的肽分离效率[6,7]。但是从应用效果看,这两个分离维度并不是完全正交的,分离组分间肽保留时间仍然存在一定相关性。为解决这一问题,在一维柱后引入“级联”收集方式[8],将不同时间洗脱的馏分组合,使第二维液相色谱整个洗脱周期得到更有效利用,从而提高质谱鉴定的效率。
近年来,二维液相色谱和质谱相结合的定量方法越来越多地应用于复杂生物样本或肿瘤组织等临床样本的深度定量蛋白质组分析[9-11]。常规高效液相色谱(HPLC)采用线性连续梯度洗脱模式,具有较高分离效率,而且能灵活改变级联收集方案。但目前常规HPLC仍存在的限制是对初始样本的大量需求和复杂的合并过程,以及由此带来的肽段的吸附损失。基于相同反相色谱分离原理的Stage-Tip[12-14]方法,有效降低了对初始样本的大量需求,并且减少了复杂实验流程,是复杂肽段混合物预分离的有效工具。但是,StageTip方法只能采用阶梯梯度洗脱,而且其预分离收集组分数目很难改变。鉴于以上2种方法,本文尝试建立基于超高效液相色谱(UPLC)-八端口转子阀的微升级预分级系统,使UPLC的高分辨率与八端口转子阀自动化的组分分馏相结合,在基于色谱柱的液相色谱分离系统中,实现微克级初始样本的超高效自动化预分离。通过与StageTip方法系统分析比较,UPLC-八端口转子阀预分级显示良好的肽段二维分离正交性和鉴定重复性。本研究为微量复杂生物样本提供了一种高分辨率、高重复性的蛋白质组深度覆盖策略。
1 实验部分
1.1 仪器、试剂与材料
Q-Exactive HF台式四极杆-轨道阱质谱仪、pH计、高速离心机购自美国Thermo Scientific公司;超高效液相色谱H-Class系统购自美国Waters公司;八端口转子阀购自美国VICI公司;ACQUITY UPLC Peptide BEH C18色谱柱(150 mm×2.1 mm, 1.7 μm)购自美国Waters公司;超声波破碎仪购自宁波新芝公司;真空浓缩蒸发仪购自德国Eppendorf公司;二氧化碳培养箱购自德国Thermo公司;超净工作台购自北京东联哈尔仪器制造有限公司;-80 ℃超低温冰箱购自日本Sanyo公司。
二硫苏糖醇(DTT)、碘乙酰胺(IAA)、碳酸氢铵(NH4HCO3)、氨水(NH3·H2O)、甲酸(FA)、三氟乙酸(TFA)、尿素(urea)、十二烷基硫酸钠(SDS)均为分析纯,乙腈为色谱纯,购自美国Sigma公司;1 mol/L pH 8.0 Tris-HCl购自中国Solarbio公司;蛋白酶抑制剂Cocktail购于瑞士Roche公司;牛血清白蛋白(BSA)、测序级胰蛋白酶购于美国Promega公司;DMEM细胞培养液、无菌磷酸缓冲液(PBS)均购自美国Hyclone公司;胎牛血清(FBS)、消化细胞用的0.05%(质量分数)胰酶-乙二胺四乙酸(EDTA)溶液购自美国Gibco公司。HepG2细胞株购自美国模式培养物集存库(ATCC),本实验室保存。30 kDa超滤管购于美国Millipore公司;C8膜购于美国3M公司;C18填料购于中国天津博纳艾杰尔公司;Tip枪头购自Axygen公司(美国); C18脱盐柱购于美国Waters公司。
1.2 样品前处理方法
1.2.1细胞全蛋白质提取
使用DMEM培养液培养人肝癌细胞HepG2,在37 ℃含5%(体积分数)二氧化碳及95%(体积分数)空气饱和湿度温箱中常规培养。使用0.05%(质量分数)胰酶-EDTA溶液消化收集细胞,离心去上清后,加入PBS溶液清洗。随后加入0.1 mol/L pH 8.0 Tris-HCl,重悬,加入等体积4%(质量(g)/体积(100 mL))SDS溶液、10 μL蛋白酶抑制剂。冰浴超声裂解,超声功率为180 W,超声1 s,停顿2 s,共99个循环。将蛋白质样本于4 ℃以20 000 r/min的速度离心10 min,取上清液,对蛋白质进行定量。分装后存于-80 ℃冰箱保存备用。
1.2.2蛋白质酶切
取500 μg HepG2细胞全蛋白质或BSA,加入8 mol/L尿素,将溶剂体系补足至500 μL,全部转移至30 kDa超滤管,以20 000 r/min的速度离心20 min,以替换溶剂体系。在超滤管中加入100 μL 20 mmol/L DTT,在37 ℃恒温箱还原反应4 h。取出超滤管,以20 000 r/min的速度离心15 min,加入100 μL 50 mmol/L IAA,在室温暗处反应30 min。以20 000 r/min的速度离心15 min,加入100 μL 20 mmol/L DTT,在室温暗处反应15 min。以20 000 r/min的速度离心15 min,加入200 μL 50 mmol/L碳酸氢铵,以20 000 r/min的速度离心15 min,此步骤重复一次。更换新套管,按照胰蛋白酶与蛋白质质量比为1∶50的比例加入20 μL 0.5 g/L胰蛋白酶,振荡混匀,于37 ℃恒温箱孵育过夜(>12 h),以20 000 r/min的速度离心15 min,回收液体,依次加入200 μL碳酸氢铵和超纯水,以20 000 r/min的速度离心15 min,回收液体并合并,放入真空浓缩蒸发仪热干,于-80 ℃冰箱冻存备用。
1.3 UPLC-八端口转子阀预分离
采用Waters超高效液相色谱H-Class系统,以Waters ACQUITY UPLC Peptide BEH C18色谱柱作为第一维分析柱,配在线过滤器。在高pH条件下进行液相色谱分离,流动相A为2%(体积分数,下同)乙腈-98%水,流动相B为98%乙腈-2%水,流动相A和流动相B均含0.1%氨水溶液,pH为10。流速为150 μL/min,柱温为40 ℃。梯度洗脱程序:0~24 min, 5%B~30%B; 24~26 min, 30%B~95%B; 26~29 min, 95%B; 29~30 min, 95%B~5%B; 30~33 min, 5%B。总梯度时长为33 min。每次运行结束后,回到初始状态,重新平衡7 min后再上样。在低pH条件下进行液相色谱分离,流动相A为2%乙腈-98%水,流动相B为98%乙腈-2%水,均含0.1%TFA溶液,pH为2。流速为150 μL/min,柱温为40 ℃。梯度洗脱程序:0~24 min, 5%B~30%B; 24~26 min, 30%B~95%B; 26~29 min, 95%B; 29~30 min, 95%B~5%B; 30~33 min, 5%B。总梯度时长为33 min。
色谱系统柱后连接八端口转子阀,在3~28 min组分收集时间内,八端口转子阀每隔60 s切换一次端口,将样品肽段分为6组分和8组分。6组分收集方案中,第一个循环结束后,阀直接由第6个输出端口转换到第1个输出端口,将新收集组分7合并到先前收集到的组分1中,以此类推,将样品合并成6个组分。8组分收集方案中,第一个循环结束后,阀直接由第8个输出端口转换到第1个输出端口,将新收集组分9合并到先前收集到的组分1中,以此类推,将样品合并成8个组分。实验上样量均为50 μg HepG2细胞蛋白质提取液酶切肽段,由流动相A液溶解,进样体积为10 μL。收集的组分用真空浓缩蒸干仪于45 ℃热干。
1.4 StageTip预分离
将5 mg C18填料溶于90 μL甲醇,转移至底部填有C8膜的Tip枪头,用注射器推压,压紧C18填料,即得StageTip装置。将90 μL乙腈加入装置中,用注射器推压,重复一次,推压过后加满乙腈,填柱完成,静置活化填料2 h后使用。配置pH 10的氨水溶液,溶解HepG2细胞蛋白质酶切后的热干肽段,涡旋振荡,振荡后测浓度。上样前加入pH 10氨水平衡装置柱,以1 500 r/min的速度离心7 min。上样量为50 μg,用pH 10氨水稀释至160 μL。将样品分2次加入装置中,以1 500 r/min的速度离心上样,每次7 min。上样完成后,将pH 10氨水加入装置中脱盐一次。配制6%(体积分数,下同)、9%、12%、15%、18%、21%、25%、30%、35%和50%乙腈-pH 10氨水10个洗脱梯度的洗脱液,每个梯度的洗脱液各取90 μL用于洗脱样品。将6%、9%、12%、15%、18%和21%这6个梯度的洗脱液各用不同的Eppendorf管接收,再将25%梯度洗脱液合并到6%管中,30%洗脱液合并到9%管中,35%洗脱液合并到12%管,50%洗脱液合并到21%管。StageTip共分成6个组分。
1.5 第二维在线低pH HPLC-MS/MS
Q-Exactive HF台式四极杆-轨道阱质谱仪分析样本。使用自灌装C18反相柱(120 mm×150 μm i. d.,填料粒径1.9 μm),流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈溶液。流速为600 nL/min,进样体积为5 μL。洗脱梯度:梯度洗脱程序:0~71 min, 5%B~32%B; 71~72 min, 32%B~95%B; 72~78 min, 95%B。在使用Q-Exactive质谱仪进行分析时,一级质谱分辨率为120 000,扫描范围为m/z300~1 400,选择一级谱图中丰度最强的20个离子进行二级分析,高能碰撞解离(HCD)高能碰撞能量为27%。二级质谱分辨率为15 000,扫描范围为m/z200~2 000,最大注射时间为45 ms,自动增益控制(AGC)目标为5×104。
1.6 数据处理
质谱产生的数据使用Maxquant(版本1.5.3.8)软件搜库。以Swissprot收录人蛋白质库(20180518, 20 341条序列)为检索数据库。搜库时设置最大漏切位点为2;固定修饰设置为Carboxyamidomethylation(C);可变修饰设置为Acetyl(ProteinN-term)、Oxidation(M);其他参数均为默认值。
2 结果与讨论
2.1 八端口转子阀
八端口转子阀是具有1个输入端口和8个固定输出端口的流量选择流出阀,转子在程序设定的时间间隔,切换至不同输出端口,每个输出端口通过管线连接到不同收集管中进行样品收集,一个循环结束后,阀转换回第1个输出端口,将新收集组分合并到先前收集到的组分中。以这种方式,装置自动收集和级联组分,不需要额外样品收集管及收集组分的再混合。八端口转子阀的原理如图1a所示。控制软件Vcom通过编程设定,不仅可以收集到8个输出通道(A~H)的倍数,而且还可以按实验方案收集到两个或多个组分。八端口转子阀全自动化操作,有效地避免了因人员操作和复杂试验流程造成的误差,有利于实验的重复性和定量应用。八端口转子阀通道内径为0.4 mm,有效减少了柱后分离组分的再次混合,降低组分间重叠率,更有利于蛋白质及肽段的鉴定。
2.2 高效肽混合物预分级系统的建立
预分级系统主要由UPLC与八端口转子阀组成,整个系统由转子阀编程系统Vcom和液相操作软件Empower 3控制,实验流程见图1b。其中UPLC包括液相四元泵、自动进样室、柱温箱。
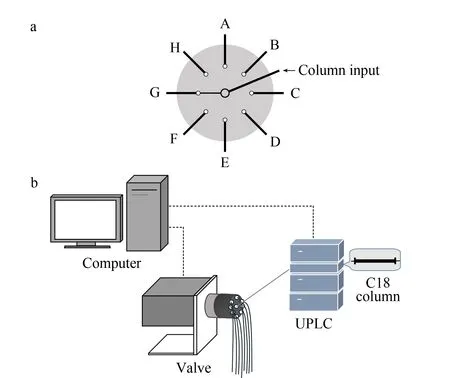
图 1 八端口转子阀分馏原理及分馏实验流程Fig. 1 Fractionation principle of the eight-port rotorvalve and its fractionation workflow a. Switch mechanism of the rotor valve, illustrating how the flow from the first dimension separation is divided into eight output lines (A-H); b. fractionation process based on the ultra-high performance liquid (UPLC) phase and the eight-port rotor valves.
以HepG2细胞蛋白质提取液酶切肽段为实验样品,UPLC采用ACQUITY UPLC Peptide BEH C18柱作为第一维分离柱,在pH 10条件下,进行33 min梯度洗脱。新开启色谱柱都需用BSA酶切肽段和HepG2细胞蛋白质提取液酶切肽段混合物进行钝化,每次试验前都使用BSA酶切肽段作为标准品,用于检测色谱系统稳定性。
从超高压第一维色谱柱上洗脱下的肽段,从柱后流入八端口转子阀的输入端口,在预定的时间间隔内,阀门切换到一个新的输出端口,每个输出端通过一个毛细管连接到收集装置中的离心管中,将分离洗脱下的肽段进行收集。因为UPLC系统的流速为0.15 mL/min,每隔60 s切换一次端口,组分体积仅为150 μL,实现自动化高效分离的同时,有效降低了样本较大组分体积造成的吸附损失。
2.3 UPLC-八端口转子阀预分级系统第一维反相色谱分离表征
第一维高pH液相色谱条件下,经过八端口转子阀分馏与级联,按试验方案收集8个组分(见图2a),通过紫外检测器,在相同高pH液相色谱条件下对每个组分重新上样,观察组分间的分离度(见图2b),可见相邻组分之间重叠度很低,而相间组分的紫外峰基本无重叠。

图 2 预分离的级联方案和反相液相色谱二维分离正交性Fig. 2 Fractionation concatenation strategy and orthogonality of separation between the two dimensions of RPLC a. UV (214 nm) chromatogram for pH 10 separation and the eight-fraction concatenation scheme; b. eight chromatograms (RP with pH 10) of the concatenated fractions (panel A) using separation conditions that identical to those in panel A; c. eight chromatograms (RP with pH 2) of the concatenated fractions. Nos. 3-28: the fractions collected from the 3 min to the 28 min at intervals of 1 min from the first-dimensional RPLC. F1-F8: the first fractionation to the eighth fractionation.
将在第一维高pH液相色谱条件下收集到的8组分热干后,采用相同的液相色谱仪器和C18柱,在低pH条件下进行紫外检测(见图2c)。观察到在33 min的低pH液相色谱洗脱梯度下,第一维高pH条件收集组分中的肽段都很好地分布于整个液相色谱的洗脱窗口,表明在不同pH值下的两种反相液相色谱分离具有良好的正交性。
2.4 不同预分离方法鉴定结果比较
为了系统地比较微克级肽段混合物二维分离的效果,以HepG2细胞蛋白质提取液酶切肽段为实验样品,将第一维高pH条件下液相色谱洗脱馏分按6组分方案进行收集。同时采用常用的StageTip方法进行预分级。StageTip也是基于高pH反相色谱条件的预分级方法,使用人工操作进行阶梯梯度洗脱分离及馏分汇合,分馏成6组分。两种方法均使用50 μg相同的HepG2细胞蛋白质提取液酶切肽段进行试验,使用相同质谱条件进行检测,对其鉴定结果进行比较。结果如图3所示,与StageTip方法相比,采用UPLC-八端口转子阀的收集策略,各个组分之间的质谱峰呈现更为均匀的分布,提示更好的正交互补性。同时,鉴定肽段和图谱数的分布也显示UPLC-八端口转子阀方法可以将肽段更均匀地分布于各个组分,提供更好的分辨率。
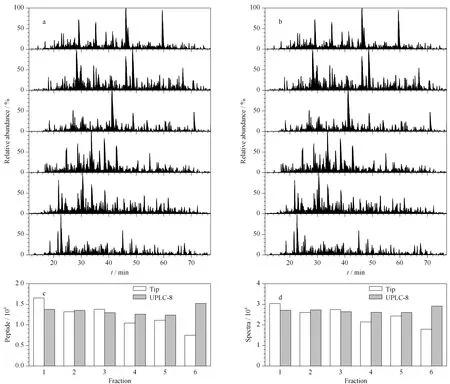
图 3 UPLC-八端口转子阀方法和StageTip方法收集级联组分在相同质谱条件下的鉴定结果Fig. 3 Identification results of the concatenated fractions by the UPLC-eight-port rotor valve strategy and theStageTip strategy under the same mass spectrometry conditions a. base peak chromatograms of the concatenated fractions using the UPLC-eight-port rotor valve strategy; b. base peak chromatograms of the concatenated fractions using the StageTip strategy; c: comparison of separation methods according to the distribution number of peptides; d: comparison of separation methods according to the distribution number of spectra identified via MS/MS. Tip: StageTip strategy. UPLC-8: UPLC-eight-port rotor valve strategy.

表 1 根据总蛋白质数、独特肽段、总肽段数、独特肽段占总肽段数比例、平均序列覆盖率对分离方法进行比较
6F: six fraction pools from the UPLC-eight-port rotor valve strategy. 8F: eight fraction pools from the UPLC-eight-port rotor valve strategy.
综合考虑试验时间和质谱鉴定工作量,优化UPLC-八端口转子阀预分级方法收集方案,在相同条件下,采用8组分收集方案[15],分离后组分在相同条件下进行质谱检测,结果见表1。与StageTip方法相比,在收集6个组分情况下,新建UPLC-八端口转子阀方法中鉴定总蛋白质数、总肽段数、独特肽段占比和平均序列覆盖率都更高;与StageTip方法相比,新建UPLC-八端口转子阀方法采用8组分接收方案,总蛋白质鉴定数提高7.49%,总肽段鉴定数提高23.52%,独特肽段鉴定数提高23.91%,平均序列覆盖率提高11.89%。由此可知,UPLC-八端口转子阀预分离方法通过灵活的改变接收方案,提高二维分离正交性,对肽段进行高效的分离,进而实现对蛋白质的深度覆盖鉴定。
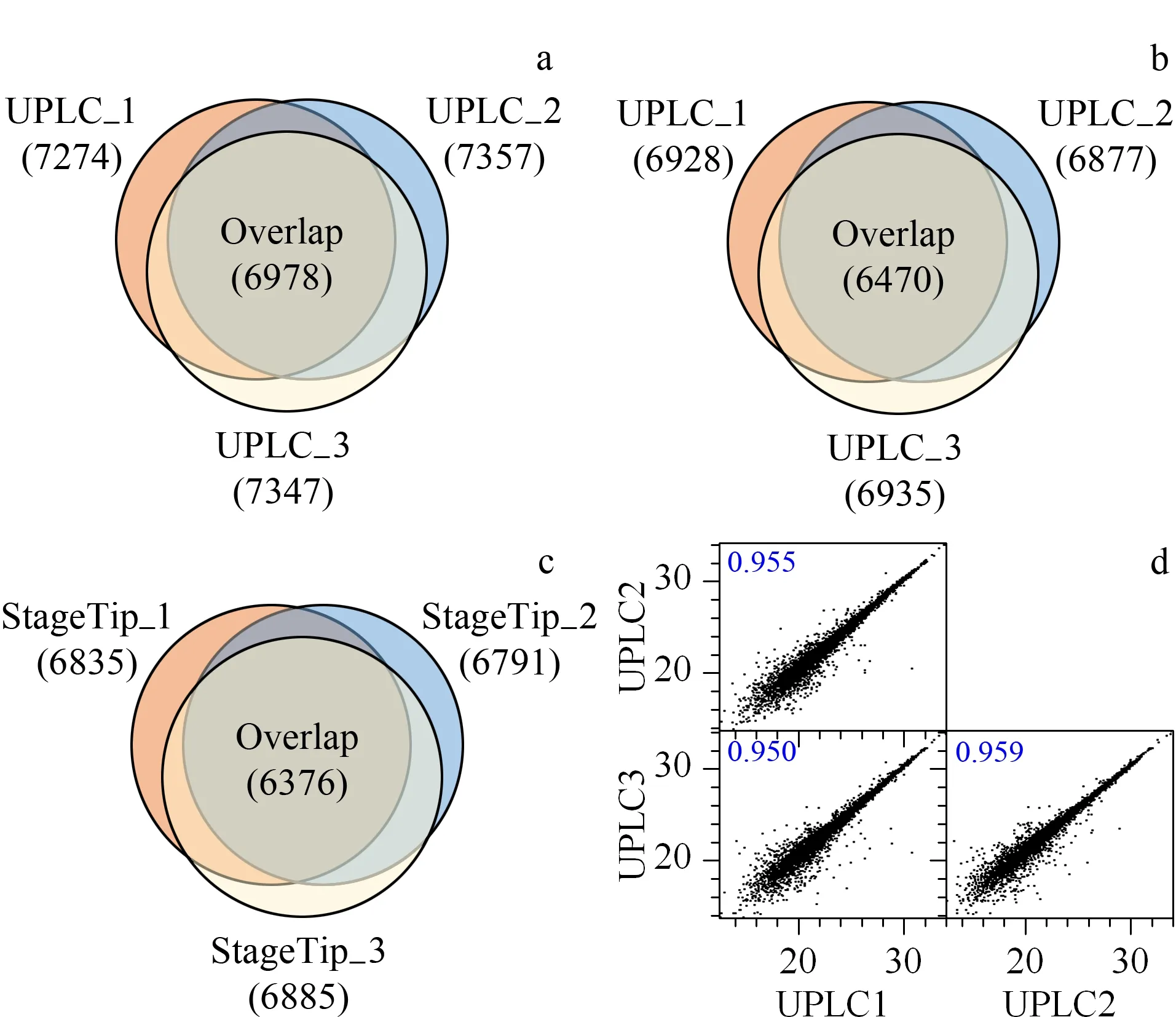
图 4 UPLC-八端口转子阀方法的高重复性和稳定的分馏效率Fig. 4 High reproducibility and robust fractionation efficiency of the UPLC-eight-port rotor valve strategy a. the high overlap in the Venn diagrams of the quantified proteins from three replicates indicates good reproducibility of the eight fraction pools from the UPLC-eight-port rotor valve strategy; b. the high overlap in the Venn diagrams of the quantified proteins from three replicates indicates good reproducibility of the six fraction pools from the UPLC-eight-port rotor valve strategy; c. the high overlap in the Venn diagrams of the quantified proteins from three replicates indicates the reproducibility of the StageTip strategy; d. comparison of the intensity based on the absolute quantification (iBAQ) intensity for the three replicates suggests the highly accurate quantitative reproducibility of the eight fraction pools valve strategy.
2.5 UPLC-八端口转子阀预分级方法的重现性
采用UPLC-八端口转子阀预分级方法和StageTip预分级方法对HepG2肽段混合物进行鉴定,将3次重复试验鉴定到的蛋白质数目占试验鉴定总数目的比例作为重要依据,考察预分级方法重复性。如图4所示,在UPLC-八端口转子阀预分级方法中,采用8组分收集方案,3次试验同时鉴定到6 978个蛋白质,占鉴定到的蛋白质的91.6%;采用6组分收集方案,3次试验同时鉴定到6 470个蛋白质,占鉴定到的蛋白质的88.24%。在StageTip预分级方法中,3次试验同时鉴定到6 376个蛋白质,占鉴定到的蛋白质的87.7%。此外,UPLC-八端口转子阀预分级方法的技术重复之间的定量重现性也非常高(决定系数R2>0.95,见图4d)。由此可知,UPLC-八端口转子阀预分级方法提供了很好的定量重现性。
3 结论
在对蛋白质组进行深度和大规模表征的过程中,肽的预分级起着关键作用。本文基于UPLC和八端口转子阀建立了新的RP-RPLC预分级方法,与StageTip系统比较表明,采用UPLC-八端口转子阀预分离方法能显著提高蛋白质、肽段的鉴定数目和方法的重复性,并且能够针对不同的情况,灵活地改变接收方案,对肽段样本进行精确鉴定。所建立的UPLC-八端口转子阀预分离方法具有显著的优点,有望在复杂生物样本蛋白质组研究中对蛋白质进行高效分离和鉴定,进而实现对蛋白质组的深度覆盖。
