黏着斑激酶抑制剂TAE226对人口腔鳞癌细胞增殖的影响
2019-05-29廖鹏程邹湘渝聂敏海
廖鹏程,刘 萍,曾 琴,邹湘渝,聂敏海△
(1.西安交通大学医学院附属三二〇一医院口腔科门诊,陕西汉中723000;2.西南医科大学附属口腔医院/口颌面修复重建和再生实验室,四川泸州 646000)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)简称口腔鳞癌,是头颈部最易好发的以影响口腔黏膜衬里上皮为主的恶性肿瘤[1]。在世界上常见的肿瘤致死排行榜中位居第6[2]。在发展中国家,它是第3常见的恶性肿瘤[1]。随着对口腔鳞癌研究的不断深入,以及在临床上治疗方法的不断改进,患者的术后生存率有了一定的改善,但仍在50%左右[3]。黏着斑激酶(focal adhesion kinase,FAK)是一种位于细胞内的非受体型酪氨酸激酶[4]。它与细胞的黏附密切相关,同时介导多条信号通路,与肿瘤的预后有着重要关系。 TAE226是一种双苯胺嘧啶类化合物,已被开发成为一种小分子酪氨酸激酶抑制剂,具有三磷酸腺苷(ATP)竞争结合性,它的作用靶点为FAK[5]。本实验采用CCK-8法检测不同浓度的TAE226干预HSC-3细胞后,对细胞增殖能力的影响。采用流式细胞术检测其对细胞凋亡和细胞周期的影响。
1 材料与方法
1.1材料来源 人口腔鳞癌HSC-3细胞株由四川大学华西口腔医学院、口腔疾病研究国家重点实验室惠赠。DMEM培养液(Hyclone,赛默飞世尔生物化学制品有限公司),优质胎牛血清(北京索莱宝生物科技有限公司),TAE226(Selleck,上海蓝木化工有限公司),DMSO(美国AMRESCO公司),CCK-8试剂盒(DojinDo,日本同仁化学研究所),细胞周期检测试剂盒(南京凯基生物)。
1.2实验方法
1.2.1细胞培养 HSC-3细胞株培养于含10%胎牛血清,100 U/mL青霉素和100 U/mL链霉素的DMEM高糖培养液中,置于37 ℃,5%CO2培养箱中培养,定期换液。
1.2.2TAE226配置 TAE226溶解于DMSO中,调整浓度为1 mmol/L,再用培养液配置成1、5、10、20 μmol/L的不同浓度贮存液,将其置于4 ℃冰箱备用,母液放于-80 ℃冰箱中长期保存。
1.2.3CCK-8法检测细胞增殖 取对数生长期细胞,调整细胞密度为5×104个/mL,将细胞悬液接种于96孔板上。设置对照组和实验组。实验组每孔加入100 μL细胞悬液,每组设6个复孔,培养24 h,吸去原培养液,对照组每孔加入新鲜培养液,实验组加入不同浓度的TAE226共100 μL,继续培养12、24、36、48、60、72 h。待药物共培养结束后,弃去孔中液体。实验组、对照组及空白组加入含有10% CCK-8液的新鲜培养液100 μL。于波长450 nm的酶标仪上测光密度(OD)值。实验重复3次。
1.2.4流式细胞术检测细胞周期分布 取对数生长期细胞,调整细胞密度为3×105个/mL,将细胞悬液接种于6孔板中,培养24 h。弃原培养液,对照组每孔加入新鲜培养液2 mL,实验组每孔加入不同浓度的TAE226 2 mL,将6孔板放入培养箱中继续培养24 h。取出6孔板,吸除废液,漂洗2~3次,0.25%胰蛋白酶消化细胞3~4 min,低速离心收集细胞,加入预冷70%乙醇,4 ℃固定过夜。低速离心,吸除上清液。每孔加入染色缓冲液500 μL,重悬细胞。加入碘化丙啶染色液各孔 25 μL,RNase A 各孔 10 μL,混匀,分散细胞。避光 37 ℃ 温浴30 min。流式细胞仪在激发波长488 nm 处检测细胞周期分布。实验重复3次。
1.2.5流式细胞术检测细胞凋亡情况 细胞种板和细胞收集同前细胞周期实验。收集细胞后,PBS液漂洗2~3次,镜下调整细胞密度为(1~5)×105个/mL。加入500 μL的Binding Buffer,混匀。加入5 μL的Annexin-FITC混匀后,加入5 μL Propidium Iodide,混匀。室温,避光反应5~15 min。于1 h内用流式细胞仪检测发射波长530 nm、激发波长488 nm下的细胞凋亡率。实验重复3次。

2 结 果
2.1TAE226对口腔鳞癌HSC-3细胞增殖的抑制作用 当TAE226的浓度为1 μmol/L,在12 h时与对照组比较差异无统计学意义(P>0.05),但是随着时间的延长,差异有统计学意义(P<0.05)。随着TAE226的浓度增至5、10、20 μmol/L时,在同一浓度下,随着作用时间的延长,其对HSC-3细胞增殖的抑制作用逐渐增强;同一时间下,随着TAE226浓度的增加,TAE226对细胞增殖的抑制作用逐渐增强(P<0.05),见表1和图1。

表1 不同浓度的TAE226于不同时间下HSC-3细胞的OD值

图1 不同浓度的TAE226于不同时间下HSC-3细胞的OD值
2.2TAE226对口腔鳞癌HSC-3细胞凋亡的影响 在TAE226作用于HSC-3细胞24 h后,TAE226浓度为1、5、10、20 μmol/L的实验组凋亡率分别为1.59%、8.50%、28.47%、49.05%。与对照组的0.08%相比,差异有统计学意义(P<0.05),随着TAE226浓度的不断增高,其对HSC-3的促凋亡作用越明显,见图2。
2.3TAE226对口腔鳞癌HSC-3细胞周期的影响 在细胞周期各阶段,对照组与1 μmol/L TAE226实验组相比,差异无统计学意义(P>0.05)。而对照组与其余各实验组比较,差异有统计学意义(P<0.01)。在G1期和S期比较时发现10 μmol/L和20 μmol/L实验组差异无统计学意义(P>0.05)。当TAE226的浓度达到5 μmol/L时,细胞周期G1期和S期所占比例逐渐降低,而G2期所占比例逐渐升高。组间比较,差异有统计学意义(P<0.01)。见表2、图3。

A:对照组;B:TAE226浓度为1 μmol/L实验组;C:TAE226浓度为5 μmol/L实验组;D:TAE226浓度为10 μmol/L实验组;E:TAE226浓度20 μmol/L实验组
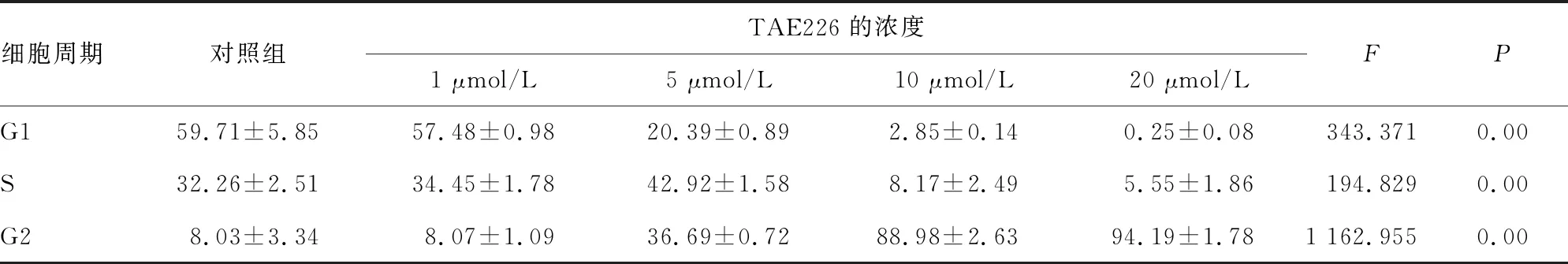
图2 不同浓度的TAE226对HSC-3细胞凋亡的影响
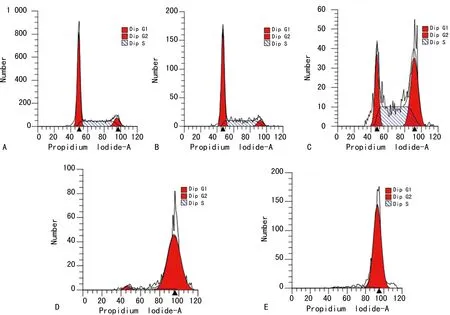
A:对照组;B:TAE226浓度为1 μmol/L实验组;C:TAE226浓度为5 μmol/L实验组;D:TAE226浓度为10 μmol/L实验组;E:20 μmol/L实验组
图3 TAE226对HSC-3细胞周期的影响
3 讨 论
口腔鳞癌是头颈部最易好发的恶性肿瘤,全世界每年有65万以上的人被诊断为口腔鳞癌,同时每年约有35万的人死于口腔鳞癌[6],近年来随着人们生活环境和生活方式的改变,口腔鳞癌的发生趋于年轻化。在过去的十年里,口腔鳞癌的发病率有所下降,但近20年来患者的5年生存率仅有约5%的提升,生存率的上升基本处于停滞状态[7]。越来越多的学者将目光集中于高效药物和早期诊断的灵敏指标的寻找。
FAK在不同来源的肿瘤细胞中随着肿瘤的分化程度及转移状态的不同,它的核酸和蛋白的表达量也不尽相同,但目前多认为在恶性程度高的肿瘤或者已经发生了转移的肿瘤组织中,FAK的表达有显著的提高。在恶性肿瘤的早期事件中可以发现FAK的过表达,并且这种现象会持续存在[8]。WANG等[2]通过对108例口腔鳞状细胞癌患者的病变组织和正常组织的比较研究中发现,miR-433可通过ERK/MAPK信号通路来下调FAK,从而抑制SCC-9细胞增殖、迁移、侵袭。CHANG等[9]通过提高生长缓慢时期的SCC-25细胞的FAK表达量,可以促进导致雌激素受体α(estrogen receptor alpha,ERA)的磷酸化、转录活性和细胞生长速率的增加。实验中通过降低生长快速时期的SCC-25中FAK表达量,可以降低ERA的磷酸化和细胞的活性,抑制细胞的生长。由此说明口腔鳞癌的活性可被FAK/AKT信号增强,这也是其促进细胞生长的关键[9]。CHIU等[10]研究发现相比于侵袭性低的SCC-4细胞,侵袭性强的OECM-1细胞的FAK和pY397高表达,同时与GDP相关联的Rac-1也高表达。当沉默OECM-1细胞中的FAK,Rac-1表达量明显降低,而这一变化也使得细胞的侵袭性降低,由此说明了抑制FAK在Py397位点的磷酸化或降低Rac-1的活性,可作为治疗转移性口腔鳞状细胞癌的一种治疗策略。本项研究旨在探索FAK的抑制剂TAE226对口腔鳞癌细胞的相关作用,以期寻找出合适的高效治疗药物。
TAE226可通过阻断FAK与ATP的连接位点及FAK的Y397位点和Y861位点的自磷酸化,从而抑制FAK的活性[11]。BEIERLE等[12]研究得出用TAE226处理了人神经母细胞瘤细胞后,FAK磷酸化水平呈浓度依赖性下降,细胞活力下降,细胞周期阻滞,细胞的凋亡增加。
本实验中的研究发现TAE226可以有效地抑制细胞增殖,在浓度为1 μmol/L时效果并不明显,但是随着浓度的不断增加,抑制效果越来越强。这与文献[2,9]结果相一致。同时TAE226可以促进细胞凋亡事件的发生,而这与其影响了细胞周期的关系密不可分,在细胞周期实验中发现,TAE226将HSC-3细胞阻滞于G2期,这与BEIERLE等[12]的研究相吻合。处于G2期的细胞已经完成了DNA的复制,处于相关蛋白的形成阶段及细胞的有丝分裂阶段,由此可以看出TAE226的作用位点主要与蛋白及RNA相关,同时也再次验证了上述增殖实验的结果,这也为后续的研究提供了一定的依据。
本实验证实了TAE226可以抑制口腔鳞癌细胞HSC-3细胞株的增殖,促进细胞的凋亡,同时将细胞阻滞于G2期,导致细胞的活力下降。以上结论可为口腔鳞癌的机制研究提供一定的理论依据。但是其对蛋白分子水平和RNA等基因水平的具体影响和机理还未可知,需要进一步的研究。
