HO-1对脓毒症大鼠血浆中HMGB-1表达的影响及其心肌保护机制
2019-05-29周仪华盛志勇郭良云
周仪华,袁 影,盛志勇,王 舒,王 萌,郭良云
(南昌大学第二附属医院:1.重症医学科;2.超声科,南昌 330006)
脓毒症性心肌损伤是脓毒症休克难以纠正,导致患者最终死亡的重要原因,血红素氧合酶-1(HO-1)对脓毒症心肌损伤具有保护作用[1]。经脂多糖(LPS)刺激后,有活力的心肌细胞通过TLR4/p13kγ信号通路分泌高迁移率族蛋白B-1(HMGB-1),HMGB-1在LPS诱导的心脏收缩功能障碍中发挥重要作用[2]。在肺部、肠道等器官功能炎症损伤动物模型中,机体通过调节 HO-1及HMGB-1的释放而发挥器官功能的保护作用[3-4]。HO-1的心肌保护作用是否与HMGB-1的表达存在特定关系仍然不清楚。本研究通过盲肠结扎穿孔术(CLP)方法建立脓毒症大鼠心肌损伤模型,给予HO-1增强剂和抑制剂,检测脓毒症大鼠血浆中心肌损伤标志物和HMGB-1的表达,明确HO-1与HMGB-1是否存在特定关系,并探讨其机制。
1 材料与方法
1.1材料 SPF级SD雄性大鼠128只(南昌大学江西医学院动物科学部提供),体质量180~220 g。
1.2方法
1.2.1模型的建立 所有大鼠术前禁食12 h,采用异氟烷吸入麻醉法诱导和维持大鼠麻醉状态,用手术直剪于腹白线中点下方约0.3 cm处逐层剪开皮肤、肌层和腹膜,直视下探查腹腔,将盲肠末端取出并置于腹壁外,采用4号缝合线距盲肠末端1.6 cm 处结扎,结扎后用3号三棱针穿刺1孔,之后分别将盲肠回纳腹腔,4号缝合针逐层缝合关腹。术后3 h左右自由进食、饮水。观察大鼠活动、进食、竖毛、腹泻、眼球凹陷、呼吸等情况。
1.2.2实验分组 SPF级SD雄性大鼠128只,随机分为4组:假手术组、脓毒症组、钴原卟啉(Copp)Ⅸ组、锌原足啉(Znpp)Ⅸ组,每组32只。假手术组除不做CLP术外,其余操作均同脓毒症组;CoppⅨ组和ZnppⅨ组分别提前24 h给于HO-1增强剂CoppⅨ(10 mg/kg,腹腔注射)和抑制剂ZnppⅨ(10 mg/kg,腹腔注射),以同样方法制作脓毒症模型。
1.2.3主要试剂及观察指标 HO-1增强剂CoppⅨ(美国Santa Cruz Biotechnology公司),HO-1抑制剂ZnppⅨ(美国Sigma公司),10%水合氯醛溶液(上海强顺化工有限公司),10%甲醛溶液(西陇化工股份有限公司),HMGBl和HO-1抗体及相关二抗(美国Cell Signaling公司)。各组均于0、6、12、24 h处死大鼠8只,开腹经腹主动脉抽取全血5~6 mL,采用酶联免疫吸附试验(ELISA)检测各组血浆中CK-MB、cTnⅠ、心型脂肪酸结合蛋白(H-FABP)、HMGB-1水平,按试剂盒(美国Amersham公司)说明书进行操作。
1.2.4苏木素-伊红(HE)染色法观察心肌组织结构变化 取心脏组织,以10%甲醛溶液固定,常规脱水、透明、浸蜡、包埋,制备石蜡切片,超薄切片机切片,切片厚度5 μm,行常规HE染色。石蜡切片常规脱蜡水化,苏木素液染色,1%盐酸乙醇分化,返蓝,乙醇伊红染色,脱水,透明,中性树胶封片,选择横断心肌的切片放大200倍,显微镜下观察心肌组织病理结构变化情况。
1.2.5Western Blot检测HMGB-1和HO-1蛋白表达 提取心肌细胞总蛋白,取25 μg总蛋白行聚丙烯酰胺凝胶电泳,转膜、封闭,加入HMGB-1兔抗人单克隆抗体(1∶1 000)孵育,洗脱后加入辣根过氧化氢酶标记的二抗进行孵育,通过化学发光法检测蛋白条带,充分洗脱后添加显影液孵育,并于暗室中曝光。同样方法检测心肌细胞HO-1蛋白表达。
2 结 果
2.1术后各组实验动物一般情况观察 所有实验动物术后均很快苏醒,各组均出现心率、呼吸加快,精神反应差,部分呈嗜睡状态,饮食差,竖毛,腹泻等状态,少数出现出血或出血倾向。假手术组术后3 h左右恢复正常活动、进食、进水。脓毒症组在24 h死亡1只,ZnppⅨ组24 h死亡2只。
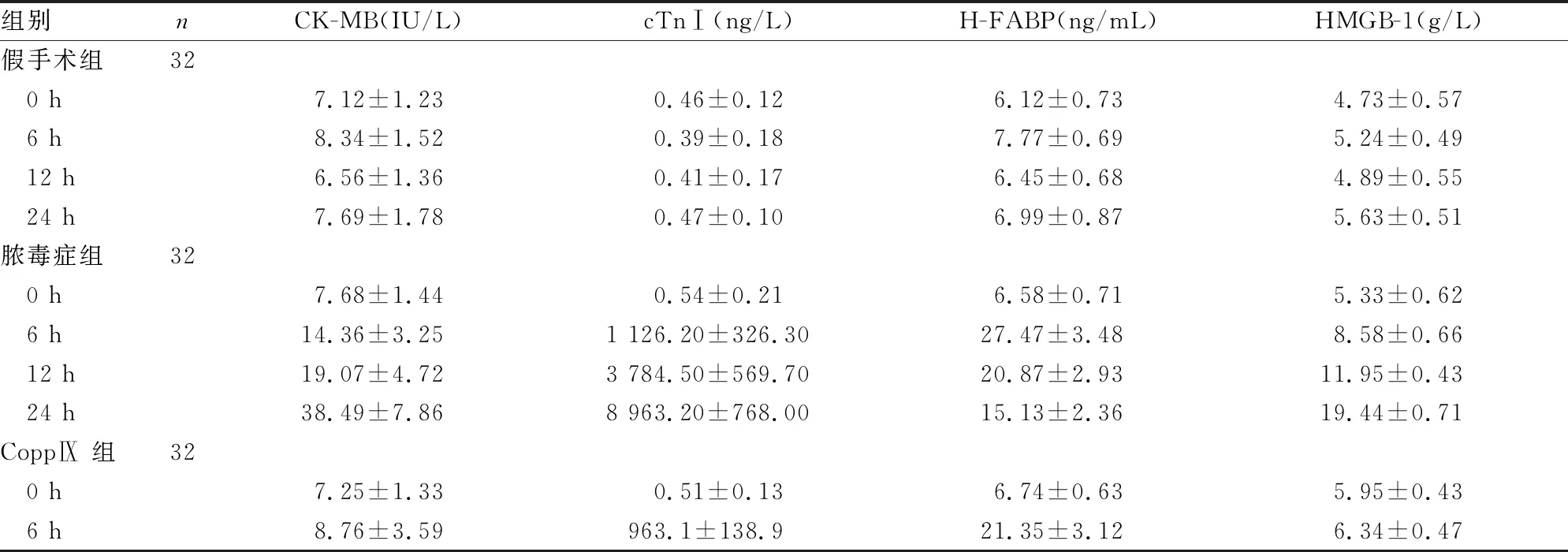
表1 各时间点血清H-FABP、HMGB-1及HO-1水平

续表1 各时间点血清H-FABP、HMGB-1以及HO-1水平
a:P<0.05,与脓毒症组同时间点比较;b:P<0.01,与CoppⅨ组同时间点相比较;c:P<0.05,与CoppⅨ组同时间点相比较;d:P<0.05,与脓毒症组同时间点比较;e:P<0.01,与CoppⅨ组同时间点相比较
2.2各时间点血浆CK-MB、cTnⅠ、H-FABP及HMGB-1表达水平变化 脓毒症组和ZnppⅨ组CK-MB、cTnⅠ升高,CoppⅨ组短暂升高后呈下降趋势,与脓毒症组和CoppⅨ组相比,ZnppⅨ组CK-MB、cTnⅠ升高明显(P<0.05)。除假手术组外,其余各组H-FABP均在6 h内升高,6 h后开始下降,与CoppⅨ 组相比,ZnppⅨ组升高明显(P<0.05)。假手术组HMGB-1表达水平无明显变化,其余各组HMGB-1表达水平均升高,其中ZnppⅨ组升高最明显,与脓毒症组和CoppⅨ 组相比,差异有统计学意义(P<0.05),见表1。
2.3HE染色法观察心肌组织结构变化 光镜下观察大鼠心脏的形态学变化:假手术组心肌结构清晰,胞核完整,心肌纤维排列整齐,横纹清晰,结构正常;脓毒症组可见心肌细胞水肿显著,核溶解、坏死;CoppⅨ组细胞肿胀、心肌纤维排列尚整齐,胞核完整,未见核溶解、坏死;ZnppⅨ组可见明显细胞肿胀,心肌纤维排列紊乱,核溶解坏死。见图1。

图1 HE染色光镜下心肌组织结构变化(×200)
2.4Western Blot检测心肌细胞HMGB-1及HO-1蛋白的表达 假手术组HMGB-1和HO-1蛋白的表达较弱,其余3组HMGB-1和HO-1蛋白均有不同程度的表达,其中ZnppⅨ组HMGB-1蛋白的表达最显著,与脓毒症组和CoppⅨ组相比,差异有统计学意义(P<0.05),差异有统计学意义(P<0.01)。CoppⅨ组HO-1蛋白的表达最显著,与脓毒症组和ZnppⅨ组相比,差异有统计学意义(P<0.05),见图2。

A:假手术组;B:脓毒症组;C:CoppⅨ组;D:ZnppⅨ组
图2 心肌细胞HMGB-1及HO-1蛋白的表达
3 讨 论
脓毒症时产生的多种细胞因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-6等,这些炎症因子可直接或间接损害心肌。这些细胞因子相互作用,可形成许多正反馈环,导致炎性反应持续加重,不仅可直接抑制心肌收缩功能,还参与心肌组织结构的破坏,增加心脏前负荷,破坏心肌钙稳态。HMGB-1是相对于TNF-α、IL-1等新的“晚期”炎症因子,是脓毒症致死效应的关键炎症介质,其表达水平与脓毒症严重程度及预后高度相关[1]。H-FABP主要存在心肌细胞胞质中,血液和其他组织中水平极低,因此在诊断心肌损伤方面具有较高的特异性;有研究显示,当心肌受损时参与心肌脂肪酸的摄入、运输和代谢的H-FABP会在心肌损伤时穿过细胞膜漏入血液中[5]。由于其相对分子质量小,在心肌受损情况下,可迅速穿过细胞膜漏入血管内,这在诊断心肌损伤方面具有较高的敏感性[6]。本研究通过CLP方法建立脓毒症大鼠模型,给予HO-1增强剂和抑制剂,检测脓毒症大鼠血浆中心肌损伤标志物和HMGB-1的表达。表1可以看出,假手术组各个时间点血浆中CK-MB、cTnⅠ、H-FABP无明显变化,而其余3组各指标在实验6 h内均有不同程度升高,从一定程度上证实脓毒症大鼠心肌损伤动物模型造模成功。
HO-1是一种细胞保护性蛋白,在炎性反应过程中可以抵抗各种有害刺激导致的机体损伤。目前已证实,在脓毒症心肌、肝脏、肺部等疾病的靶器官保护方面发挥重要作用[7-9]。从表1可以看出,ZnppⅨ组血浆中各心肌损伤标志物CK-MB、cTnⅠ、H-FABP均较CoppⅨ组明显升高,组间比较差异有统计学意义(P<0.01)。因为CoppⅨ是HO-1增强剂,而ZnppⅨ是HO-1抑制剂,因此,笔者推测在实验过程中CoppⅨ通过刺激HO-1的生成而发挥脓毒症心肌损伤的保护作用,这与上述多数研究所述的HO-1具有器官保护功能基本一致。同样,表1提示HMGB-1因子在ZnppⅨ组升高最明显,而在CoppⅨ 组的表达虽有升高,但明显低于CoppⅨ组,两组比较差异有统计学意义(P<0.01)。笔者推测在脓毒症心肌损伤动物模型中,HO-1与HMGB-1之间可能有某种特定的关联。
本研究结果表明,假手术组大鼠心脏组织细胞结构完整,未见明显心肌损伤,ZnppⅨ组心脏组织细胞严重破坏,脓毒症组次之,而CoppⅨ组心肌损伤明显较ZnppⅨ组和脓毒症组减轻,从心脏组织病理学角度证实在脓毒症心肌损伤过程中HO-1发挥着心脏保护作用。
另外,通过Western Blot方法检测损伤心肌HMGB-1及HO-1的表达,从细胞的角度探讨HMGB-1及HO-1在脓毒症心肌损伤过程中发挥的作用以及它们之间可能存在的关系。图2结果表明,假手术组HMGB-1和HO-1蛋白的表达均较弱,其余3组蛋白表达均有不同程度的增加。其中ZnppⅨ组HMGB-1蛋白的表达最显著,而CoppⅨ组该蛋白表达最弱,组间比较差异有统计学意义(P<0.01);CoppⅨ组HO-1蛋白的表达最显著,而ZnppⅨ组该蛋白表达最弱,组间比较差异有统计学意义(P<0.01)。
LI等[3]的研究发现在小鼠模型中氢气可以通过上调HO-1的合成抑制HMGB-1的表达,改善肺组织的炎性反应,并改善模型动物的死亡率。YU等[4]建立脓毒症大鼠肠功能损伤模型,给予氢气进行干预,研究发现,H2对野生型严重脓毒症大鼠肠功能损伤具有保护作用,其机制是通过调节 HO-1及HMGB-1的释放,减少氧化应激及炎症损伤,增加存活率。KIM等[10]的研究也证实在巨噬细胞系RAW264.7细胞中甘草皂苷可以通过上调H0-1的合成抑制LPS诱导的HMGB-1的表达。
本研究发现,HO-1和HMGB-1可能存在特定关系,即HO-1升高HMGB-1即下降,而HO-1下降,HMGB-1即明显升高。因此,笔者推测,HO-1可能通过抑制HMGB-1的表达而发挥脓毒症心肌保护作用。
