三江源草地植被群落与土壤性质对不同鼠兔密度的响应
2019-05-28刘碧颖
刘碧颖,王 毅,刘 苗,曾 涛
(1.成都理工大学地球科学学院,四川 成都 610059;2.中国科学院地理科学与资源研究所,北京 100101)
“三江源”为长江、黄河、澜沧江的发源地,是我国重要的生态安全屏障区域,其大面积的牧场为我国的经济发展做出了卓越贡献。然而,近几十年来,三江源地区的植被生长状况面临严峻考验,30%的高寒草原已经严重退化[1],除气候变化和人类活动之外,以高原鼠兔 (Ochotona curzoniae)为主的草原鼠兔的影响是造成三江源地区草原大面积退化又一个重要原因[2]。
高原鼠兔广泛分布于青藏高原高寒草地,是一种小型非冬眠的植食性哺乳动物,多栖息在土壤较为疏松的坡地和河谷地带[3]。高原鼠兔通常被认为是草地退化的元凶,一直被当作灭杀的对象。有研究指出,在青藏高原及其周边地区,频繁的鼠兔活动会导致高寒草甸土壤细粒物质的减少、砾石含量的增加以及土壤的疏松与旱化,并且在冻融过程和风力的推动下,逐渐形成土壤龟裂,从而发展为次生裸地[4-5]。多年冻土区的活动层厚度也与鼠兔活动息息相关,因为在鼠兔的觅食与挖掘活动下土壤总孔隙度增加,加速了温度在土壤中的传递,使得浅层土壤升温,从而导致多年冻土上限的位置下移[6-7]。Gordon和Letnic[8]则认为动物活动在高原植物群落的形成中起着重要作用,而高原鼠兔通过啃食高寒草甸群落中的鹅绒委 陵 菜 (Potentilla anserina)、 细 叶 亚 菊 (Ajania tenuifolia)、 直 立 梗 唐 松 草 (Thalictrum cultratum) 等杂草,影响植被群落组成,从而限制植物生长[9]。此外,在植物生长期和休眠期,裸露的鼠丘促进了土壤水分的蒸发,使之含水量降低,并逐渐由湿润紧密型土壤转变为干燥结构疏松型土壤[10-11],使草地生产力减弱[12-13]。而且在未来的气候条件下,鼠兔的适宜生存环境面积将增加6.25%,而青藏高原草原退化的威胁将在2050年变得更大[14]。因此,鼠兔活动导致的土壤性质的变化和植被盖度降低客观上成为水土流失和草地沙化的诱因。
然而,高原鼠兔作为植物和捕食者之间的连接点,是促进高山草原健康发展的重要角色[15]。在无鼠类活动区,由于上层植株的遮阴,限制了下层植株光资源的获取,而高原鼠兔的挖掘活动使得植被稀疏相间,提高了植物对土壤养分资源和光的可利用性,缓解了在资源和空间的竞争中植物之间的相互抑制作用[16];另一方面,鼠兔的造丘活动对土壤异质性的影响打破了草地上各物种之间原有的竞争关系,优势种首当其冲从而竞争力下降,间接促进了其他植物的生长发育[17-18]。而鼠类的取食行为同样为植物的种群扩散提供了有利条件,因为鼠类的搬运,调节了植物种子或果实的时空分布,一旦其搬运的储藏地为适宜的微生境时,种子将快速萌发生长,完成植物扩散[19-20]。此外,高原鼠兔还为许多地方性物种创造栖息地。而由高原鼠兔造成植被覆盖的适当减少也会影响到土壤表面活跃的动物群,使之在筑巢过程中形成土壤大孔隙,从而使土壤通透性增加,土壤容重减小,加速水分渗透,减少水土流失[21]。不仅如此,一定程度的鼠类挖掘活动将地下土壤推至地表,阳光的照射使之温度升高,土壤微生物活性增强,从而促进了土壤的矿化作用和基质的养分循环[22-23],相对于土壤表层有机物分解缓慢的青藏高原,这无疑为高原生态系统的内物质循环提供了动力[5]。
现有的关于鼠兔对高寒草地的影响研究已有不少;但群落的演替是个长期的过程,通过一次的调查无法获取其演替规律。因此,本研究通过分析不同鼠兔种群密度梯度下,土壤性质和植物生物量的响应以及植物群落结构的演替规律,以期为草原生态环境治理保护提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于青海南部三江源地区,31°82'-33°39' N,96°47'-97°42' E (图 1)。三江源地区位于世界屋脊- 青藏高原的腹地,平均海拔3 500~4 800 m,是长江、黄河和澜沧江的源头汇水区[24]。三江源为高原山地气候,全年平均气温为-5.6~3.8 ℃,年平均降水量 262.2~772.8 mm,多集中在6-9月,太阳辐射强烈,年日照时数平均2 500 h以上,潜在蒸发量为1 160.3 mm,全年无绝对无霜期,是世界上海拔最高、生物多样性最集中地区[25]。研究区样点植被为高寒草甸,主要优势种有高山嵩草 (Kobresia setschwanensis)、紫花针茅 (Stipa purpurea) 和甘肃棘豆 (Oxytropis kansuensis) 等[26]。
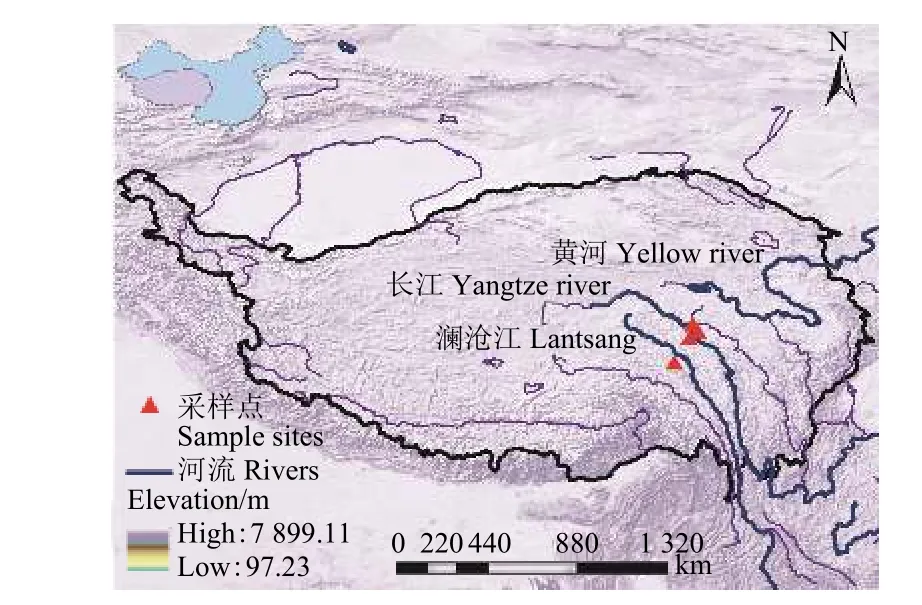
图1 采样点在三江源地区的位置Figure 1 Location of the sites in the Sanjiangyuan (Source of the Three Rivers) Region
1.2 研究方法
1.2.1 野外取样
本研究于2016年在三江源高寒草原的巴塘县,囊谦县,称多县歇武镇和称文镇选取4个不同高原鼠兔密度梯度的采样点,在每个采样点划出50 m × 50 m 的采样区并在采样区内随机选取 3 个50 cm × 50 cm 的样方,获取样方内的地上植被特征 (包括生物量、盖度和物种信息) 及地下生物量,并采集土壤样品用以分析土壤理化性质。
1.2.2 鼠兔数据测定
基于鼠洞法调查鼠兔密度,用单位面积内鼠洞的数量表征高原鼠兔密度。统一在离地40 m高度利用无人机 (大疆 Phantom 4) 对不同采样点垂直拍摄,对高原鼠兔的活动区域进行了观察。并通过对航片的目视解译及监督分类,将高原鼠兔密度分为4个等级:近似零密度 (每公顷0~15个)(approximately zero-density, AZD)、 低 密 度 (每 公顷10~110 个 ) (low-density, LD)、 中 等 密 度 (每 公顷110~200 个) (medium-density, MD) 和高密度 (每公顷 200~300 个) (high-density, HD)[27](图 2)。

图2 采样点的航拍图及梯度分级Figure 2 The aerial photographs of sample sites and their gradient grading
1.2.3 植物数据测定
在4个不同高原鼠兔密度梯度采样点,随机设置 3 个 50 cm × 50 cm 的植物样方,互为重复,记录各样方植物种类的植被覆盖度、高度、数量及物种多样性,然后与地表平齐剪取地上生物量;采集地上植被后,采用土钻法挖取剖面的形式获取地下生物量,取样的土壤深度分别为0-10、10-20和20-30 cm,然后用水冲洗,将地上生物和地下生物保存在纸袋中,在烘箱中75 ℃烘干至恒重和并称重记录[28]。Shannon-Wiener多样性指数 (H′) 的计算公式如下:
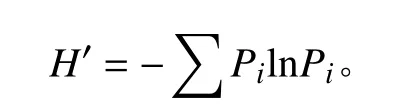
式中:Pi为样品中属于第i种的个体的比例。
1.2.4 土壤数据测定
将土钻取得的土样 (0-10、10-20和20-30 cm)混合均匀风干后过筛,去除草根和小石块等杂物。土壤 pH 用酸度计法测定,有机碳 (total organic carbon,TOC) 用重铬酸钾硫酸外加热法测定,全磷 (total phosphorus, TP) 和 速 效 磷 (available phosphorus, AP)用钼锑抗比色法测定,全氮 (total nitrogen, TN) 用半微量凯氏定氮法测定,速效氮 (available nitrogen,AN) 采用扩散吸收法测定[26],全钾 (total potassium,TK) 和速效钾 (available potassium, AK) 用火焰光度法测定[29],微生物生物量碳 (microbial biomass carbon)和微生物生物量氮 (microbial biomass nitrogen) 用熏蒸提取法测定[30],每同一采样点土壤理化性质的测定均为3次重复。
1.2.5 数据分析
首先,统计了各样点植物群落组成及各物种生物量比例,以探究不同高原鼠兔密度梯度下植物群落结构格局的演替规律;然后,比较了4个采样点的地上、地下生物量及其比值 (为了将各个梯度地下地上生物量的比值统一到一个数量级,对其取对数),观察不同高原鼠兔密度梯度下植物生物量的响应;又分别对相同土壤深度 (0-10、10-20和20-30 cm) 的土壤理化性质在不同高原鼠兔密度梯度下做差异性分析,比较不同高原鼠兔密度对土壤的影响程度;最后,对所有采集的土壤理化性质指标与地上、地下生物量的比值进行做热度图分析,以获取影响植物生物量响应的调控因素。所有分析均认为P< 0.05具有统计学意义[31]。分析过程 采 用 了 ArcGIS 10.2(ESRI, Inc., Redlands, CA,USA)、 SigmaPlot 10.0(Systat Software, Inc., Chicago,IL, USA) 和 R 软件[32]。
2 结果与分析
2.1 不同鼠兔种群密度梯度下植被群落性状的变化
三江源地区植被群落性状在不同鼠兔种群密度梯度下差异较为明显 (表1),具体表现为当高原鼠兔密度为AZD时,采样点植被群落的物种丰富度最高,为15.00,其优势物种为嵩草、发草 (Deschampsia caespitosa) 和鹅绒委陵菜;当为LD时,植被群落的物种丰富度降低为9.67,优势物种为昆仑蒿(Artemisia nanschanica),紫花针茅和莓叶委陵菜(Potentilla fragarioides);当为MD时,植被群落的物种丰富度为10.00,与LD没有显著差异(P>0.05),优势物种与AZD类似,为嵩草和鹅绒委陵菜;当为HD时,植被群落的物种丰富度最低,为5.70,其优势物种为地锦草 (Euphorbia humifusa) 和甘肃棘豆,相对前3个梯度也发生较大变化。植被群落的物种丰富度整体上随鼠兔密度的增加呈现显著下降趋势,但采样点LD和HD的植被群落优势物种均为在AZD中未采集到的新物种。
2.2 不同鼠兔种群密度梯度下地上地下生物量的响应
采样点地上生物量和地下生物量都随着高原鼠兔密度的增加而减少 (图3A)。对采样点的地上生物量而言,除LD和MD之间外,各个鼠兔种群密度梯度下,采样点地上生物量都有显著差异 (P<0.001);对地下生物量而言,AZD与HD差异性显著,而其他两个鼠兔种群密度梯度的地下生物量差异不大 (P= 0.15)。此外,在4个鼠兔种群密度梯度下,采样点HD的根茎比 (lgR/lgS)最大,为2.03;其余3个采样点根茎比从大到小分别为LD(1.86)、MD(1.78) 和AZD(1.76),整体随鼠兔种群密度梯度呈逐渐升高的趋势。但是当高原鼠兔密度不是很大时 (AZD、LD和MD),不同采样点间的根茎比差异不显著 (P= 0.15) (图 3B)。
2.3 不同鼠兔种群密度梯度下土壤理化性质
通过对比不同鼠兔种群密度梯度下同一土壤深度的土壤属性发现,不同土壤属性及其在不同土壤深度上对鼠兔种群密度梯度的响应差异显著(表2)。在0-10 cm的土壤中,除全钾、pH和速效钾外,其他土壤属性均随鼠兔种群密度梯度的增加呈现波动状递减趋势,pH随鼠兔种群密度梯度的增加有逐渐递增趋势;采样点AZD和HD的土壤属性整体上差异显著,而采样点AZD和MD的土壤属性值趋于近似。而在10-20 cm的土壤中,除全氮、微生物碳和微生物氮外,其他土壤属性对鼠兔种群密度梯度的响应变化趋势基本一致。但在20-30 cm的土壤中,除了pH和速效钾对鼠兔种群密度梯度的响应变化趋势与0-10 cm和10-20 cm相同外,其余均与前两层土壤的土壤属性的响应变化趋势不同,且速效磷、微生物碳和微生物氮对鼠兔种群密度梯度的递增没有表现出任何显著差异 (P> 0.05)。

表1 植物群落组成及各物种生物量比例Table 1 Plant community composition and biomass proportion of each species

图3 4个采样点的地上、地下生物量 (A) 及其比值 (B)Figure 3 Underground biomass, aboveground biomass and the ratio of Underground biomass to aboveground biomass in the four sampling sites
2.4 不同鼠兔种群密度梯度下影响植物生物量响应的调控因素
不同鼠兔种群密度梯度下,采样点植物根茎比与各土壤属性的热度图 (图4) 显示,在采样点AZD中,除OM、TK和AK外,剩余7个土壤因子对RS都是抑制作用,且其中除pH外,都是显著抑制作用 (P< 0.05) 。在采样点 LD 中,对 RS 有显著 (P<0.05) 促进作用和显著 (P< 0.05) 抑制作用的土壤因子数量相等,均为4个,分别是MC、MN、TN、TP和TK、AP、AK、pH。而在采样点MD中,对RS有显著 (P< 0.05) 促进作用的土壤因子和对 RS 有显著 (P< 0.05) 抑制作用的土壤因子同样数量相等,分别是MC、MN、OM、AP和TN、AK、N、pH。作为鼠兔种群密度梯度最为严重的样点,HD中除了TK,所有土壤因子对RS均表现为促进作用,且其中仅有pH为非显著促进作用。
3 讨论与结论
本研究通过分析三江源区域不同鼠兔种群密度梯度下,植物群落结构、土壤性质和植物生物量的响应,揭示了低密度 (LD) 和高密度 (HD) 的鼠兔种群均不利于草地的健康发展,而中等密度 (MD)的高原鼠兔对草地植物的生长有显著的促进作用。此外,发现高原鼠兔影响背景下,土壤因子是影响植物根茎比变化的主要驱动力。
前人研究强调了高原鼠兔的挖掘活动对草地植物赖以生长的土壤结构的破坏,以及高原鼠兔的种群数量增加导致草地次生裸地面积的升高[33],也有人通过统计分析处理证明高原鼠兔数量与危害面积率之间存在着显著的对数曲线关系, 而且基本不受生境变化的影响[34]。虽然本研究也证明随着鼠兔种群密度梯度的增加,地上地下生物量都随之递减 (图3A)。但适量的高原鼠兔对草甸群落的组成的影响 (表1) 证明,适当密度的高原鼠兔对草地植物群落结构和植物多样性是有益的。有研究提出,高原鼠兔活动在一定程度上可增加须根类植物生物量,因为须根类植物没有主轴根,即使受到鼠兔的啃食,仍旧不影响植株利用其未受损伤的根系生长发育,同时地下根系的生长抑制,会促进顶端优势,使得植株地上部分加速发育,使得光合作用积累的有机物增多,弥补了根部损伤的损失;而对于营养储存及运输功能均集中于轴根的直根类和根茎类植物,根系一旦遭到破坏,土壤营养和水分的吸收与利用必定受阻,从而导致植株生长缓慢[35]。但当高原鼠兔增加到一定数量时,高寒草甸群落中唐松草、莓叶委陵菜、昆仑蒿等毒杂草会被优先啃食,则其在群落中的数量与竞争力骤减,从而为禾本科和莎草科牧草的生长提供了机会,促进了它们在群落中的扩散[36]。所以鼠兔种群密度增加,草地却出现了新的植物物种,例如毒杂草昆仑蒿;而发草和嵩草等禾本科和莎草科牧草在LD中的物种生物量比例急剧下滑,但在MD中,莎草科嵩草生物量比例又出现了很大的回升,说明适量密度的高原鼠兔能够改变草甸群落的组分。但随着高寒草甸高原鼠兔活动的持续增加,土壤呼吸作用和生态系统生产总量也会因超出生态系统调控范围而继续下降[37-38]。相应的,物种丰富度、多样性、植物生物量等植被结构也会发生显著变化 (表1、图3A)。

表2 4个采样点不同深度下的土壤理化性质Table 2 Chemical properties in different depth soil on four sampling sites

续表 2Table 2 (Continued)

图4 4个采样点植物根茎比与土壤因子的热度图Figure 4 Heat map of root: shoot ratios and soil factors at the four sampling sites
适当数量的高原鼠兔促进生态系统的健康平衡发展不仅仅表现在草地植物群落结构和植物多样性上[39],10-20 cm的土壤因子随鼠兔种群密度梯度的先减后增的动态变化同样揭示了其重要作用。高原鼠兔的活动主要集中于地面[40],伴随觅食和常有选择地在其巢区内排泄粪、尿等活动,而植食性小哺乳动物粪尿的分解能促进生态系统的物质循环[41],可显著提高表层土壤 (0-20 cm) 有机质含量。此外,高原鼠兔的挖掘活动使得土壤总孔隙度增加,土壤透气性增强,土壤有机物的分解速率加快[42]。而土壤的疏松和透气性提高了植物根系的固氮能力,同时使土壤保水保肥能力都得到提高[43-45],使得各土壤因子在适当的鼠兔种群密度梯度下都有相对增加的趋势 (表2)。但在20-30 cm土壤层,各样点的土壤因子对鼠兔种群密度梯度的响应规律与表层土壤并不一致,而部分土壤因子没有显著差异。一是因为高寒草地的根系主要分布在0-30 cm,但是又以浅层的根系分布最多,大约占根系总量的60%~80%,植物与深层土壤的相互作用不明显[46];二则证明鼠兔活动基本集中在浅层土壤,对深层土壤的影响不大[47-48]。
除了植物群落结构和土壤因子外,植物根茎比是本研究的另一重要指标。植物根茎比整体上随鼠兔种群密度梯度呈逐渐升高的趋势 (图3),图4揭示了土壤因子对植物根茎比的促进或抑制作用,这种作用导致植物根茎比与鼠兔种群密度梯度之间对应变化。在AZD中,无鼠兔区域的土壤裸露较少,土壤含水量较高,植物根系都分布在地表附近,其吸收的土壤营养主要供给地上生物的生长[49],土壤因子对植物根茎比表现为抑制作用。而鼠兔的出现使鼠洞周边土丘裸露,容易接受日光辐射和透气,使微生物活动旺盛,矿化作用较强,在破坏地上根茎的同时也在促进植物地上地下生物量的积累[50],所以在LD和MD中,土壤因子对RS的促进和抑制作用相差不大,且RS值表现为无显著差异。众所周知,N、P和K为植物正常生长发育所必需的大量元素,是影响群落地上生物量的相对生长率的关键因子[51],在LD中,TN和TP都对RS有显著促进作用,而在MD中仅有AP对RS的促进作用,所以LD的RS值略高于MD的。当鼠兔种群密度持续增加后,土壤养分大量丢失,而植物为了生存,只能往纵深生长来吸收足够的营养[52],使得HD中的土壤因子对RS表现为强烈的促进作用。所以,不同鼠兔种群密度梯度下土壤因子是影响植物生物量的主要调控因素。
当然,本研究由于样本量较少,没有大量的试验数据佐证,有一定的局限性,因此,投入大量的试验去推敲和验证结论,是下一步研究的重点。
