人工干预对黄河源区沙化草地土壤微生物群落的影响
2019-05-28张文娟尤全刚李成阳赖炽敏
张文娟,薛 娴,彭 飞,尤全刚,潘 晶,李成阳,赖炽敏
(1.中国科学院西北生态环境资源研究院 / 中国科学院沙漠与沙漠化重点实验室,甘肃 兰州 730000;2.中国科学院大学,北京 100049;3.福建农林大学林学院,福建 福州 350000)
沙漠化作为土地退化的一种主要表现形式,影响社会经济和生态环境的可持续发展以及人类的生存和进步[1]。青藏高原是全球独特的地域单元,近年来区内土地沙漠化不断发展,已成为当地主要的生态环境问题之一[2]。2015年我国青藏高原沙漠化土地总面积已达到39.29万km2,约占整个青藏高原区土地总面积的15.1%[3]。沙漠化土地广泛分布在柴达木盆地、藏北高原、青南高原和大江大河河谷区[4]。
黄河源区位于青藏高原东部,是黄河重要的水源涵养区和补给区,历史时期湖泊密布[5-6]。然而,青藏高原抬升和气候变干,导致大湖泊开始解体、小湖泊逐渐干涸,在土层较薄的湖相沉积物上逐渐形成高寒草原[7]。近几十年,受气候变暖和不合理的人类活动影响,黄河源区的沙漠化土地总面积达 22 042.32 km2,占该区总土地面积的 16.77%,且沙漠化土地的面积和程度呈剧增态势[8];其主要分布在巴颜喀拉山北麓,散布于黄河干流两侧的湖泊周围、河谷滩地、河岸阶地及干涸湖滩[9]。黄河源区土地沙漠化影响畜牧业发展,危及黄河流域用水安全,是黄河源区最主要的生态环境问题[10-11]。
草方格沙障是沙漠化治理最有效的一种措施,被广泛应用于我国北方沙漠化防治中[12]。黄河源区以高寒草地畜牧业为主,缺乏制作草方格的麦草和稻草等材料,且气候较为湿润,降雨较多,草方格沙障易腐烂,使用年限短[13]。因此,当地人民利用砾石方格沙障代替草方格沙障作为固沙措施,并结合播草种的方法进行沙漠化治理[14-15]。但目前示范区内沙化土地治理的成效还没有相关研究和报道。因此,有必要对示范区内砾石方格沙障/播草种的沙漠化土地恢复措施进行研究和评价,从而为今后高寒地区沙化土地的治理提供理论指导。
一般来讲,退化土地恢复成效主要从土壤、植被和微生物3个方面进行评价[16]。但是研究区气候寒冷、成壤作用弱、土壤发育程度较低,人工干预措施影响下土壤和植被的恢复过程相对缓慢[17]。土壤微生物作为生态系统的重要组成部分,其多样性和群落结构的变化可以反映土壤生态功能的变化[18-20]。因此,土壤微生物群落组成及结构变化可作为土壤环境及植被变化的指示因子。本研究采用MiSeq测序方法,以黄河源区沙化草地为研究对象,对不同人工干预措施和不同恢复年限样地的土壤细菌和真菌群落组成进行高通量测序,旨在了解不同恢复措施对细菌和真菌群落结构及其动态变化的影响,揭示不同干预措施和恢复时间在沙化草地恢复中对土壤微生物种群演化的作用,以期为进一步开展黄河源区沙化防治工作提供科学依据。
1 材料与方法
1.1 研究区概况

图1 研究区位置及采样地点示意图Figure 1 Location of the study area and sampling plots
研究区被称为绵沙岭,位于黄河源区214国道沿线(K504)的星星海湖岸沙地。研究区位置及采样地点如图1所示,地处 34°44'57.85" N,98°07'06.32" E,海拔 4 241 m。年平均气温 5.1 ℃,年平均降水量313.8 mm,其中86%的降水发生在5-9月[10]。研究区天然植被为高寒草原,其群落稀疏,结构简单,主要以紫花针茅(Stipa purpurea)为建群种,伴生种有紫羊茅(Festuca rubra)、异针茅(S.aliena)、座花针茅(S.subsessiliflora)、钉柱委陵菜(Potentilla saundersiana)、细叶亚菊(Ajania tenuifolia)、沙生风毛菊(Saussurea arenaria)、乳白香青(Anaphalis lacteal)、矮火绒草(Leontopodium nanum)、镰形棘豆(Oxytropis falcate)和铁棒槌(Aconitum pendulum)等[21]。研究区草地退化后,植被主要由沙生风毛菊、铺散亚菊(Ajania khartensis)、垂穂披碱草(Elymus nutans)、紫菀(Aster tataricus)等组成。研究区退化之前土壤为高寒草原土,多为水成、半水成土,土层较浅,在高寒气候条件下,土壤成土过程十分缓慢[2, 17]。
自2005年开始,玛多县政府组织当地民众开展工程和生物措施治理沙化土地。在星星海与214 国道之间的沙化土地上布设了规格为 2 m × 2 m的砾石方格沙障,面积约247 hm2。沙面稳定后在沙障内人工播撒了垂穂披碱草、早熟禾(Poa annua)等禾本科植物的草种。
1.2 试验设计和样品采集
本研究选择了4种不同类型样地,其中选择邻近干涸湖泊区域无人工措施干预的沙漠化区作为对照样地,记为CK,4年播草种样地记为P1(2013年),4年砾石方格沙障 + 播草种样地记为P2(2013年),12年砾石方格沙障 + 播草种样地记为P3(2005年)。选择CK样地作为其他3个有人工干预措施样地的对照,以P1样地和P2样地对比分析不同干预措施对土壤环境的影响,P3样地与P2样地对比分析不同干预时间的砾石方格沙障 +播草种对土壤微生态环境的影响。
2017年7月在研究区4个样地进行样品采集。在每个样地内分别随机选取3个样方,为3个重复。利用 30 cm × 30 cm 样方框对样地内植被盖度及植物群落组成进行调查,并用齐地面刈割法收获地上生物量[22]。在样方内采用土柱法 (Φ = 60 mm)收集植物地下部分(0-10 cm),用细水将泥土冲洗干净后烘干根系并称量其生物量[23]。同时,利用剖面法取地表0-10 cm土样,将其分为两部分:一部分用于测定土壤容重、含水量、有机碳、硝态氮及铵态氮;另一部分经混合(3个样品合为一个)、均质、除杂(过1 mm筛)后收集在无菌离心管中,密封后使用干冰运至北京奥维森基因科技有限公司(http://www.allwegene.com/)进行测序(高通量测序样品在野外采集完成后,放置于内置冰盒的车载保温箱内,然后运抵实验室)。
1.3 研究方法
1.3.1 土壤理化性质测定
土壤容重采用100 cm3环刀取样测定;土壤含水量测定采用烘干法 (恒温 105 ℃, 48 h),称干土重,计算土壤含水量;有机碳测定采用重铬酸钾容量法-外加热法;土壤硝态氮和铵态氮测定采用美谱达UV-3300分光光度仪(中国,上海,美普达仪器有限公司)[24]。
1.3.2 土壤微生物多样性检测
称取0.5 g新鲜土壤样品进行微生物基因组总DNA的抽提,运用1%琼脂糖凝胶电泳检测基因组DNA的完整性,并鉴定DNA含量。PCR扩增采 用 TransGen AP221-02: TransStart Fastpfu DNA Polymerase;每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱;2%琼脂糖电泳检测。细菌16S rRNA基因通用引物为338F/806R[25],真菌ITS rRNA基因区引物ITS1-F/ITS2[26]。参照电泳初步定量结果,将PCR产物用QuantiFluor™-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求进行相应比例的混合。基于 Illumina MiSeq PE300 测序平台在北京奥维森基因科技有限公司上机测序。原始下机序列已提交到NCBI的SRA数据库(登录号:PRJNA490458)。
1.4 统计学分析
运用QIIME(v1.8.0)软件得到基于门和纲分类级别的细菌与真菌的相对丰度柱状图。Heatmap(热图)是基于Bray-Curtis法计算进化距离,运用临接法(neighbor-joining method)分析后通过R语言vegan包完成。采用SPSS 17.0软件进行统计学分析,用平均值和标准误表示测定结果,组间比较采用单因素方差 (One-way ANOVA)分析,P< 0.05 有统计学意义 (SPSS for Windows, Version 17.0, Chicago, IL)。
2 结果
2.1 不同干预措施样地的土壤和植被特征
表层土壤容重、含水量以及铵态氮含量在CK、P1、P2和 P3样地之间均无显著差异 (P> 0.05)(表 1)。土壤有机碳和硝态氮含量在CK、P1及P2样地之间无显著差异(P> 0.05),而P3样地表层土壤中有机碳和硝态氮含量显著高于CK、P1和P2样地的土壤有机碳和硝态氮含量(P< 0.05)。与CK、P1和P2样地相比,P3样地的土壤有机碳含量分别高出190.09%、60.98%和115.44%。与CK、P1和P2样地相比,P3样地的土壤硝态氮含量分别高出272.50%、60.12%和222.61%。
植被物种丰富度和总地上生物量在4个样地之间无显著差异(P> 0.05),而杂类草地上生物量在P3样地显著高出 CK 样地 342.27%(P< 0.05)(表 1)。植被盖度在CK、P1和P2样地之间无显著差异(P>0.05),但P3样地的植被盖度显著高于CK和P2样地的植被盖度(P< 0.05)。与CK和P2样地相比,P3样地的植被盖度分别高出480.00%和148.39%。
2.2 基于MiSeq测序的不同干预措施样地的物种组成
2.2.1 细菌群落组成
在门分类水平放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、拟杆菌(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)等21个共有门在CK、P1、P2和P3样品中分别占比为99.19%、99.80%、99.87%和99.89%。排在第1位的菌群是放线菌门,该细菌种类在CK、P1、P2和P3样地中相对丰度分别为30.33%、38.12%、23.20%和30.61%。变形菌门在CK、P1、P2和P3样地中相对丰度分别为26.81%、22.24%、36.24%和28.61%。放线菌门在P1样地中相对丰度最高,变形菌门在P2样地相对丰度最高(图 2a)。
在纲分类水平,α-变形菌纲(α-Proteobacteria)在4个样地中占比最高且波动性较大,在CK、P1、P2和P3样地的相对丰度分别为16.35%、16.73%、19.65%和26.97%(图 2b)。β-变形菌纲 (β-Proteobacteria)、γ-变形菌纲 (γ-Proteobacteria)和 δ-变形菌纲 (δ-Proteobacteria)在各个样地中占比均较低且波动较小,3种变形菌纲的相对丰度分别为3.67%、3.07%和1.80%(图2b)。
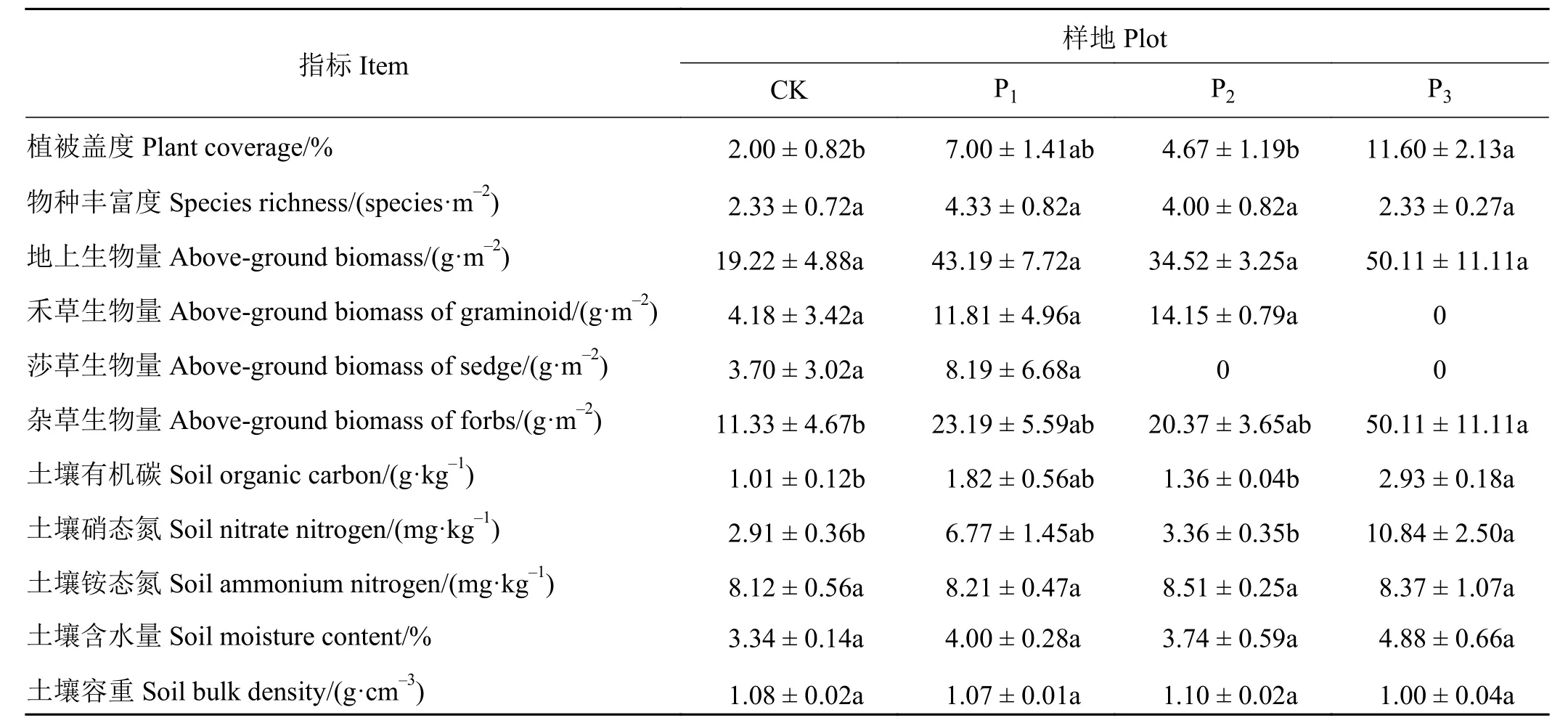
表1 不同干预措施样地土壤和植被特征 (n = 3)Table 1 Properties of the plant community and soil for each sample plot under different intervention measures (n = 3)
2.2.2 真菌群落组成
在门分类水平,子囊菌门(Ascomycota)在CK、P1、P2和P3样地相对丰度最高,分别占比为79.17%、61.67%、66.78%和71.61%。担子菌门(Basidiomycota)排在第2位,其在4个样地中的相对丰度分别为4.87%、7.86%、10.42%和18.58%。子囊菌门在CK样地中相对丰度最高,担子菌门在P3样地中相对丰度最高(图3a)。
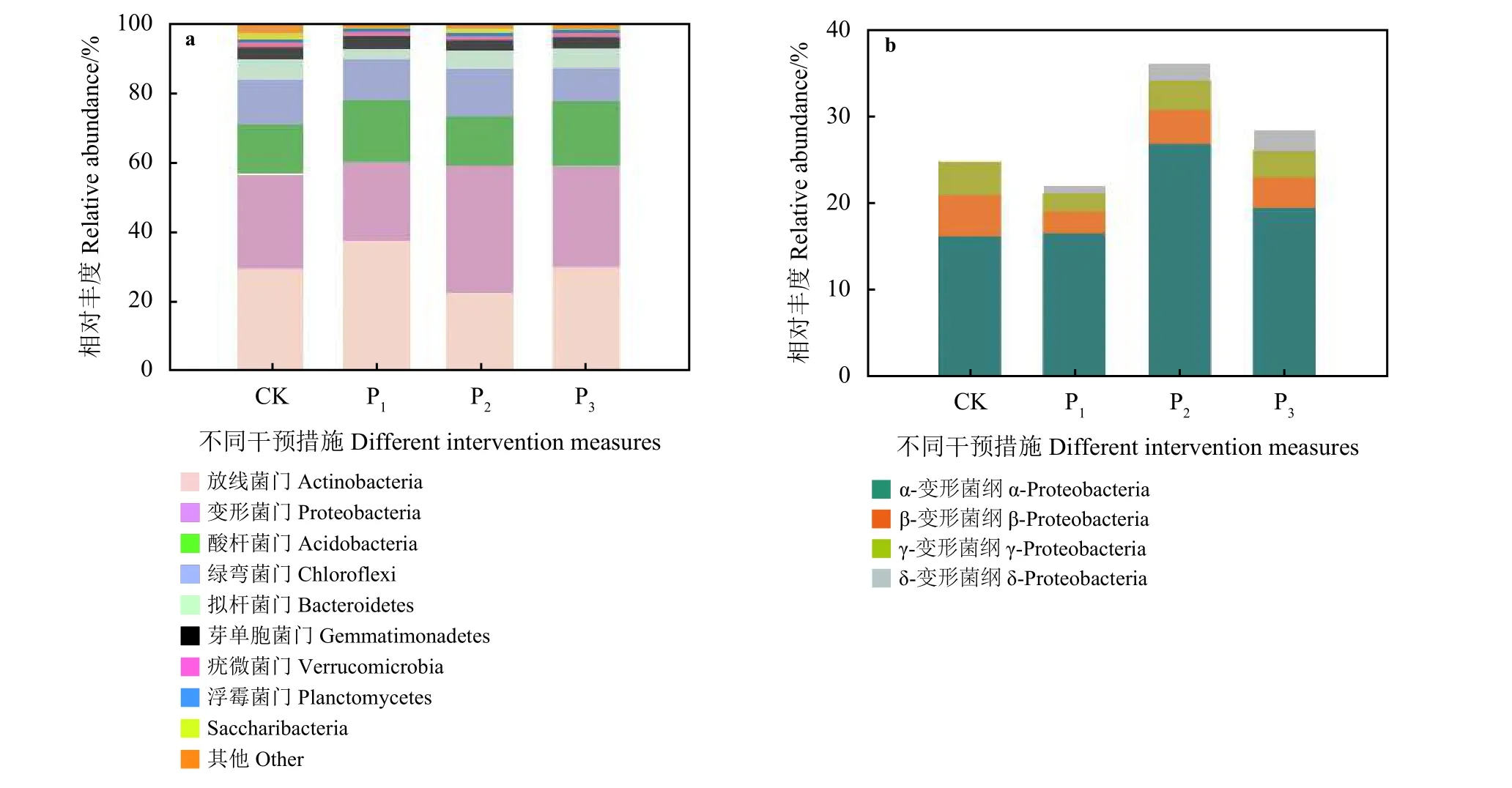
图2 不同干预措施样地土壤样品在门水平(a)细菌群落相对丰度评估和纲水平变形菌(b)分布百分比Figure 2 Relative abundance of the bacterial community at the phylum (a) level and the class distribution of Proteobacteria (b) for each sample plot under different intervention measures
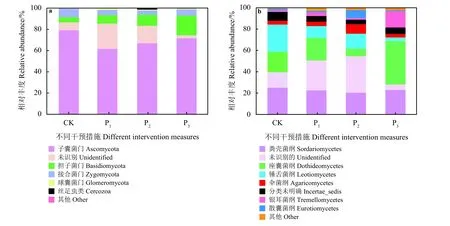
图3 不同干预措施样地土壤样品在门水平(a)和纲水平(b)真菌群落相对丰度评估Figure 3 Relative abundance of the fungal community at the phylum (a) and class (b) levels for each sample plot under different intervention measures
在纲分类水平,粪壳菌纲(Sordariomycetes)在4类样地中的相对丰度最高且变化较小,平均值为22.75%。未识别的菌纲在CK、P1和P23类样地中相对丰度较高,为14.50%~34.20%;在P3样地中相对丰度最低,为5.01%。P3样地的座囊菌纲(Dothideomycetes)和银耳菌纲(Tremellomycetes)相对丰度最高,分别为40.75%和15.03%。相反,锤舌菌纲(Leotiomycetes)的相对丰度在对照样地CK中最高,为25.40%;在P3样地中相对丰度最低,为3.42%(图 3b)。
2.3 不同干预措施样地微生物群落的β-多样性
在基于丰度比较高的前20个属水平的细菌类群的热图(图4a)中,CK和P1样地的细菌群落聚类为一组,P2和P3样地的细菌群落聚成另一组,这表明CK和P1样地的细菌群落相似系数较高,P2和P3样地的细菌群落相似系数较高。在基于丰度比较高的前20个科水平的真菌类群的热图(图4b)中,CK和P1样地的真菌群落首先聚类在一起,然后再与P2样地的真菌聚在一起,P3样地的真菌群落单独为一组,这表明CK、P1和P2样地的真菌群落相似系数较高而P3样地的真菌群落与CK、P1和P2样地的真菌群落差异性比较大。
3 讨论
土壤细菌和真菌是土壤有机物质矿化和腐殖质化过程的重要参与者[27],其群落多样性变化受土壤肥力[28-29]及植被特性[30-31]的影响。同时,土壤微生物又能够调节植物生长,其在土壤中的数量及分布反映了植被的生长发育状况和土壤肥力变化趋势[32]。相关研究发现,细菌群落的放线菌门在极端环境中非常丰富,而变形菌门则更多地生长在土壤肥力较高和植物相对较为丰富的环境[33-34]。本研究中细菌群落中的放线菌门在CK和P1样地的相对丰度高于P2样地;然而变形菌门,尤其是α-变形菌纲在CK和P1样地的相对丰度低于P2样地(图2)。以上研究结果证实,4年修复期的砾石方格沙障 + 播草种相结合的人工干预措施对黄河源区沙化土地的改良作用优于单纯的播草种干预措施。尽管播草种干预措施在黄河源区黑土滩退化草地的修复中取得了很好的效果[35-36],但研究区风沙活动强烈、土壤发育微弱、土地贫瘠,只有与固沙措施相结合人工播草种才能更好地定殖与生长。细菌菌群聚类分析结果表明,与CK样地相比,P1样地的细菌群落没有发生明显变化,且两类样地的细菌菌群相似性较高聚为一组,进一步说明仅仅使用人工补播这一种干预措施,在高寒地区沙化土地改良中的成效不甚明显;而P2和P3样地的细菌群落发生了显著变化,且这两种类型样地的细菌菌群由于相似系数较高聚为一组(图4a),说明本研究区砾石方格沙障 + 播草种相结合的人工干预措施有效改善了沙化土地的微生态环境。但是,区域土壤成土过程十分缓慢,致使植被和土壤的修复成效并不显著,因此研究区植被物种丰富度和总地上生物量及土壤容重、含水量和铵态氮等因子在4个样地间均无显著变化(P> 0.05)(表1)。
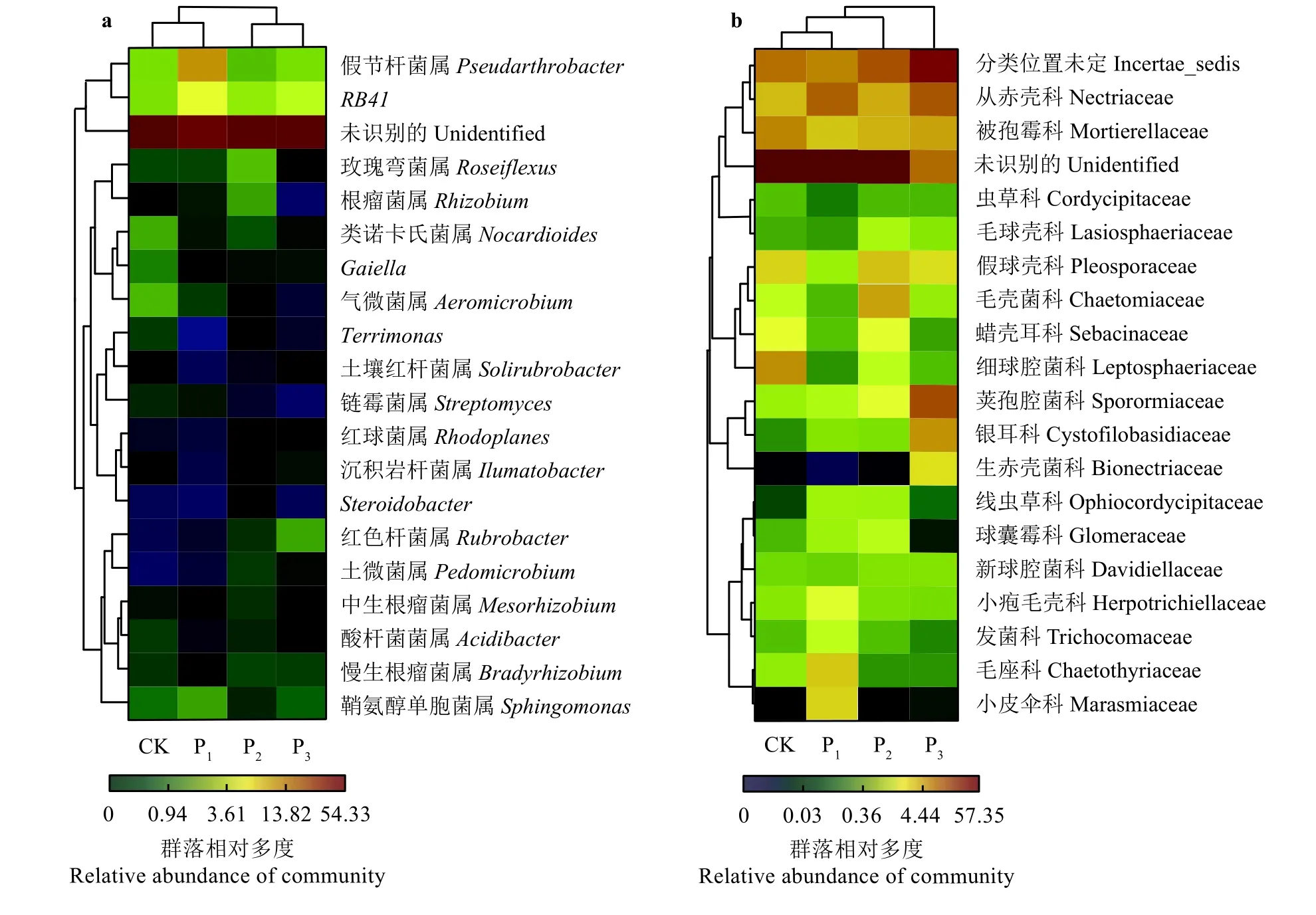
图4 基于丰度比较高的前20个属水平的细菌类群(a)和科水平的真菌类群(b)的热图Figure 4 Bacterial (a) and fungal (b) distributions of the top 20 abundant genera and families, respectively
真菌群落的子囊菌门在土壤养分贫瘠的环境中较丰富,而担子菌门则在土壤养分充足的环境中最为丰富[37-38]。有研究表明,座囊菌纲虽然属于子囊菌门,但其能在极端环境中通过改善水分和营养物质的获取而增强的植物生长[37]。本研究结果中,子囊菌门的座囊菌纲和担子菌门的银耳菌纲在P3样地中丰富度最高。真菌菌群聚类分析结果表明,P3样地的真菌群落与P2样地的真菌群落差异系数较大(图4b),且植被盖度及土壤有机碳、土壤硝态氮含量在P3样地显著高于CK和P2样地(P<0.05)(表 1),说明砾石方格沙障 + 播草种相结合的干预措施其成效随干预年限的延长而增强。
基于以上分析认为,高寒地区沙化草地的治理,应该采取工程措施和生物措施相结合的方法,绵沙岭治沙科技先导示范区所采用的砾石方格沙障 +播草种相结合的干预措施优于单一的播草种干预措施,促进了沙化草地表层养分积累,改变了土壤微生物结构,有利于植被的定殖和生长。但是,由于区域气候寒冷、土壤成土过程缓慢,致使植被和土壤的修复过程长。而接种有益微生物菌剂能够有效改善植物根基微生态环境,提高土壤水分和养分利用率,增强植物光合能力,促进植物生长[39-40]。因此,可在砾石方格沙障 + 播草种的干预方式基础上,通过施肥、添加微生物菌剂等措施快速提高土壤肥力,使黄河源区沙化土地得到有效治理。
4 结论
4年修复期的砾石方格沙障 + 播草种相结合的人工干预措施对黄河源区沙化土地的改良作用优于单纯的播草种干预措施,且砾石方格沙障+播草种相结合的人工干预措施对沙化草地的改善成效随干预年限的延长而增强。
