胃癌术后早期肠内、肠外营养治疗的临床研究
2019-05-28陈格亮张静花超蒋咏梅刘加新
陈格亮,张静,花超,蒋咏梅,刘加新
胃癌在消化系统恶性肿瘤疾病中属于一种常见病、多发病,其发病率在所有恶性肿瘤疾病中列居第2位,每年全球因胃癌死亡约80万,我国为胃癌高发地区,发病率在全国占35%,发病率、死亡率均列居首位[1]。当前,胃癌根治术是临床治疗胃癌的主要方式,因胃癌根治术后致胃失去正常生理功能,机体处于负氮平衡,加之术前因长期消耗等原因,使患者易出现营养不良,因此术后早期营养治疗至关重要[2]。临床营养治疗的方法包括肠外营养(parenteral nutrtion,PN)和肠内营养(enternal nutrition,EN)[3]。两种营养治疗方案均广泛应用于临床,但两种方法各存在利弊端,临床对于不同患者如何使用合理的营养治疗方案缺乏综合分析和可靠的依据[4]。故本研究通过比较早期全肠内营养(total enteral nutrition,TEN)、全肠外营养(total parenteral nutrition,TPN)与肠内+肠外营养(enteral+parenteral nutrition,EPN),旨在探讨三种营养方案对胃癌病人术后免疫功能、营养状况、肝肾功能和肠功能恢复的影响,以期为胃癌术后患者选择合理的营养治疗方式提供参考。
1 资料与方法
1.1 一般资料
选取上海交通大学医学院附属同仁医院2017 年1月至2018 年11月收治的90例行胃癌根治术患者进行临床研究,按随机数字表法分为TPN组、TEN组、EPN组,每组30例。TPN组中,男16例,女14例,患者年龄37~65岁,平均(51.7±5.6)岁;体重45~69 kg,平均(58.60±2.32)kg;病理分型:腺癌16例,低分化癌11例,印戒红胞癌3例;TEN组中,男18例,女12例,患者年龄35~62岁,平均(50.8±6.1)岁;体重46~70 kg,平均(59.12±2.45)kg;病理分型:腺癌14例,低分化癌12例,印戒红胞癌4例;EPN组中,男19例,女11例,患者年龄38~64岁,平均(51.1±6.3)岁;体重44~68 kg,平均(58.54±2.10)kg;病理分型:腺癌17例,低分化癌9例,印戒红胞癌4例。三组性别、年龄、体重及病理分型等一般资料比较,差异无统计学意义(P<0.05),具有可比性。
1.2 纳入条件
①患者年龄<65岁;②经术前胃镜及活检确诊为胃癌;③在接受手术治疗前,没有采取过诸如靶向治疗、化疗放疗、免疫疗法以及中药治疗等任何治疗方式;④术前影像学评估为可切除胃癌,无远处转移;⑤无心、脑、肺、肝、肾等重要脏器功能损伤,无糖尿病、甲亢等代谢性疾病;⑥接受根治性切除(D2)手术;⑦本研究须经医院伦理委员会批准实施,所有入组病例均签署知情同意书。
1.3 排除标准
①存在严重营养不良者;②存在肠梗阻、肠穿孔和肠坏死等肠内营养禁忌证。
1.4 营养治疗方法
1.4.1 TPN组 本组给予全肠外营养治疗。患者术后12~24 h内,通过颈内静脉或锁骨下静脉给予普通补液支持,24 h后给予三合一营养液(卡文注射液,生产单位:华瑞制药有限公司,批准文号:J20090046)1 440 mL,按理想体重25 kcal/(kg·d)给予。
1.4.2 TEN组 本组给予全肠内营养治疗。通过术中预留的肠内营养支持通道(鼻空肠管、鼻胃管、空肠造瘘管)给予完全肠内营养治疗。术后第1天经营养输液泵注入生理盐水500 mL+能全力肠内营养混悬液(生产单位:纽迪希亚制药(无锡)有限公司,批准文号:H20030011)500 mL;术后第2~3天增加至全量(即按理想体重25 kcal/(kg·d),约能全力1 200~1 500 mL),输注速度50~100 mL/h,经输液泵h给予[5]。
1.4.3 EPN组 本组给予肠内+肠外营养治疗。术后第1天通过术中预留的肠内营养支持通道(鼻空肠管、鼻胃管、空肠造瘘管)经输液泵注入生理盐水500 mL,输注速度20~30 mL/h;术后第2天予以生理盐水500 mL加能全力500 mL;第3~4天根据患者的耐受情况逐步增加能全力量,热卡不足部分由肠外营养供给[6]。
待三组患者可经口进食后,可停止肠内、肠外治疗。治疗期间记录三组肛门排气时间、术院住院时间及均营养费用。
1.5 观察指标
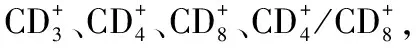
1.6 统计学方法
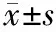
2 结果
2.1 三组营养治疗前后营养状况及体重比较
营养治疗前,三组营养指标Alb、Pre-Alb、TRF、Hb及体重BW水平比较差异无统计学意义(P>0.05);营养治疗后,三组Alb、Pre-Alb、TRF水平较营养治疗前明显提高(P<0.05),EPN组Alb、Pre-Alb水平显著高于TPN组、TEN组,三组治疗后TRF水平无显著差异(P>0.05);三组间营养治疗前后Hb水平比较无显著差异(P>0.05);三组营养后BW较营养治疗前明显降低,而组间比较无显著差异(P>0.05),见表1。
2.2 三组营养治疗前后肝肾功能指标比较
三组肝肾功能指标ALT、AKP、PT、BIL、BUN、Cr水平在营养治疗前后及组间比较差异均无统计学意义(P>0.05),见表2。
2.3 三组营养治疗前后免疫功能指标比较

表1 三组营养治疗前后营养状况及体重比较
注:与同组治疗前比较,*P<0.05;与TPN组比较,#P<0.05;与EPN组比较,▽P<0.05

表2 三组营养治疗前后肝肾功能指标比较

表3 三组营养治疗前后免疫功能指标比较
注:与同组治疗前比较,*P<0.05;与TPN组比较,#P<0.05;与EPN组比较,▽P<0.05
2.4 三组术后并发症发生情况比较
术后,TPN组、TEN组、EPN组并发症发生率分别为36.67%、33.33%、10.00%,TPN组、TPN组并发症比较差异无统计学意义(P>0.05),EPN组并发症发生率显著低于TPN组、TEN组(P<0.05),见表4。
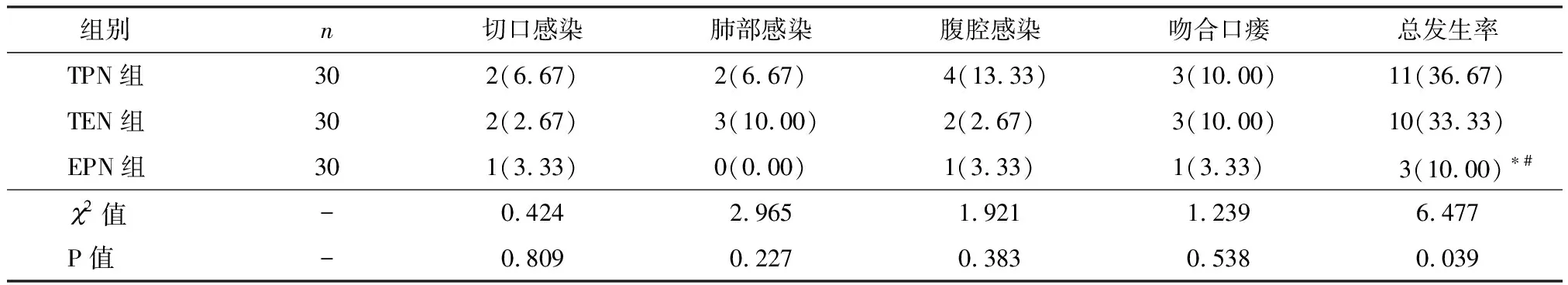
表4 三组术后并发症发生情况比较 [n(%)]
注:与TPN组比较,*P<0.05;与EPN组比较,#P<0.05
2.5 三组肛门排气时间、术后住院时间及营养费用比较
EPN组肛门排气时间、术后住院时间显著短于TPN组、TEN组(P<0.05),而TPN组、TEN组比较差异无统计学意义(P>0.05),三组日均营养费用比较具有显著性差异(P<0.05),其中TEN组日均营养费用显著低于TPN组、EPN组(P<0.05),见表5。

表5 三组肛门排气时间、术后住院时间及营养费用比较
注:与TPN组比较,*P<0.05;与EPN组比较,#P<0.05
3 讨论
胃癌根治术是临床治疗胃癌的一种重要方法,因胃癌患者长期受病情折磨本身存在不同程度营养不良,加上患者行胃癌根治术后受应激反应的影响致营养消耗加重,提高了患者术后切口、肺部、腹腔感染及吻合口瘘等并发症的发生率,不但不利于患者病情康复,影响下一步的抗肿瘤治疗,还增加了患者治疗费用[7]。因此,胃癌术后早期给予有效的营养治疗方式已成为现临床工作者研究的重点。
自1968年国外研究者Dudrick等首次提出了静脉营养方式,使供给营养和发生肠道功能障碍的难题得到解决,促进了营养支持的发展[8-9]。近年来,随着医疗事业的发展,当前营养供给制剂与方法都发生了改变,肠外营养(PN)已逐渐发展为肠内营养(EN)及肠内+肠外营养(EP),且使得术后早期营养治疗方式日趋完善,多数学者认为针对胃癌患者术后早期肠内+肠外营养治疗方式具有一定优势[10-11]。其中,PN指采取静脉途径的方式为机体提供人体必需的营养物质[12];EN指经管饲方式将人体所需营养物质输送到胃肠道,以满足人体对营养物质的需求[13]。一般情况下,衡量营养支持是否有效取决于能否改善机体的营养状态。经多项研究表明[14-16],胃癌术后早期营养支持治疗对改善患者营养状况有着重要作用,一般选择在手术后24h进行肠内营养治疗[17]。本研究通过对90例行胃癌手术患者术后给予早期全肠内营养(TEN)、全肠外营养(TPN)及肠内+肠外营养(EPN)治疗,结果发现,EPN组营养指标血清白蛋白(Alb)、前白蛋白(Pre-Alb)、血红蛋白(Hb)显著高于营养治疗前及TEN组、TPN组,而TEN组、TPN组营养治疗后各项营养指标比较无显著差异;EPN组营养后BW略高于TEN组、TPN组,但三组间比较无显著差异。结果提示,胃癌术后给予全肠内或全肠外营养支持治疗对营养状况的改善效果相当,但给予肠内+肠外营养支持治疗更有利于改善患者营养状况,且在一定程度上能减少患者的体重损失。
综上所述,对胃癌患者术后采取EPN营养支持治疗方式有利于改善患者营养状况,降低体重损失,保护患者细胞免疫功能,促进患者肠道功能及病情康复,减少住院时间,对肝肾功能无影响,且具有经济优势,因此可作为胃癌术后营养支持治疗的首选方案。
