下调miR-221对胃癌细胞SGC-7901增殖的影响及其相关机制研究
2019-05-28常威刘海鸿薛海贵
常威,刘海鸿,薛海贵
胃癌是我国发病率和死亡率最高的常见恶性肿瘤之一[1-2],据统计我国每年胃癌新发患者达70万人[3-4],由于胃癌的发病隐匿且诊断水平有限,大多数胃癌患者在确诊时已经发展为中晚期,失去了手术机会,即使早期胃癌患者在接受手术治疗后仍有可能发生局部复发或远处转移,导致治疗失败[5-6]。因此近年来的研究都集中在寻找新的药物靶点,旨在为胃癌的治疗寻找新的突破。
miRNA是一类微小非编码 RNA,其长约 20~22个核苷酸[7-8]。多项研究发现,miRNA 可通过结合靶基因3’的非编码区调节目的基因的转录和蛋白翻译,参与恶性肿瘤细胞的增殖、分化、凋亡等多个生物学过程,可发挥癌基因和抑癌基因的功能[9-10]。随着近年不断深入的研究,miRNA 在多种肿瘤中表达异常。蔡辉等[11]发现miR-221在早期胃癌患者血浆中明显升高,并且可作为早期胃癌检测的生物标志物,提示miR-221在胃癌的发生和发展中发挥重要作用。国内外关于miR-221对胃癌细胞增殖的能力及机制的研究较少,本文通过检测健康人和胃癌患者组织中miR-221的表达,同时运用反义基因技术靶向抑制胃癌细胞中miR-221的表达,检测其对增殖能力的影响,并探讨其相关的机制,为寻找治疗胃癌的新靶点提供一定的参考依据。
1 材料与方法
1.1 一般资料
本研究纳入我院2015年6月至2017年7月就诊的48例胃癌患者、32例同期体检健康者作为研究对象。胃癌患者纳入标准:①年龄18~70岁,男女不限;②经组织学或细胞学确诊为胃癌;③患者术前未进行化疗、放疗或靶向治疗;④未合并其他恶性肿瘤,无远处转移;⑤无严重感染;⑥自愿参加试验,并同意签署知情同意书。排出标准:①合并严重的心脑血管疾病;②合并严重的肝肾功能疾病;③有精神类疾病,依从性差;④妊娠期或哺乳期妇女。胃癌患者与健康者的一般资料如下表1,经统计学分析,两组研究对象在年龄、性别比例、实验室检查指标的差异无统计学意义(均P>0.05),具有可比性。
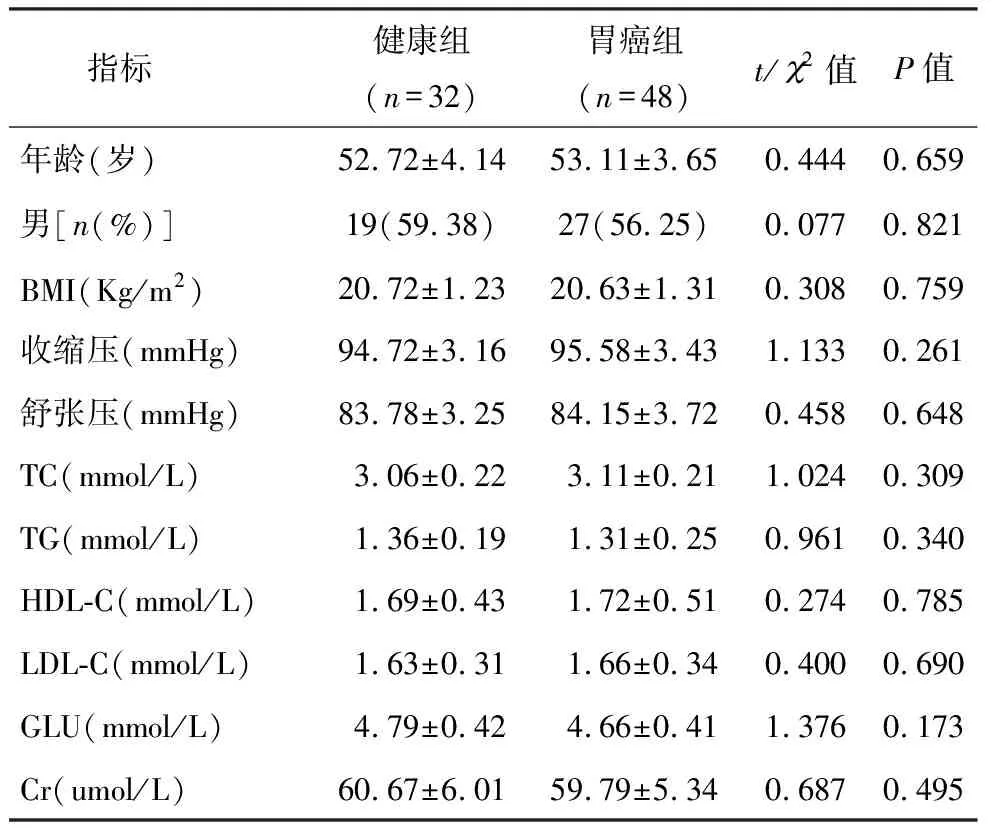
表1 两组的一般资料的比较
1.2 方法
1.2.1 主要试剂
胃癌细胞SGC-7901、正常胃上皮细胞GES-1购买于上海ATCC细胞库,细胞培养液RPMI1640、胎牛血清、0.25%胰蛋白酶(含EDTA)均为美国Hyclone公司产品,青-链霉素双抗为美国Sigma公司产品,Western blotting 中STAT3一抗、二抗均为美国Cell signaling 公司产品;RNA提取试剂Trizol Reagent、瞬时转染Lipo2000为美国Invitrogen 公司产品,RT-PCR、BCA试剂盒为日本Takara 公司产品,MTT试剂盒由南京建成生物提供,miR-221、U6引物由深圳华大基因公司合成,miR-221 mimics、anti-miR-221、对照miRNA由苏州吉凯生物提供,蛋白酶抑制剂、磷酸酶抑制剂、蛋白裂解液为北京碧云天生物公司产品,miR-221和内参引物见表2。
1.2.2 细胞培养
将胃癌细胞SGC-7901培养在含细胞培养基中(含10%的胎牛血清),置于37 ℃、5% CO2的细胞培养箱中,待细胞生长至80%~90%时传代培养,用于后续的实验,采用普通光学显微镜观察胃癌细胞SGC-7901(图1)。
1.2.3 组织和细胞miR-221的检测
取适量的组织,加入到研磨器中,研磨过程中加入适量的液氮,充分研磨组织,运用Trizol 提取细胞和组织总RNA后,根据Takara逆转录试剂盒的操作说明将 RNA逆转录为 cDNA,然后将 cDNA 为作为PCR 的模板,加入miR-221引物进行PCR 反应,根据公式ΔCt=CtmiR-221-CtmiRNA-U6计算各样本中miR-221的含量,逆转录和RT-PCR反应体系见表3、4。

表2 各基因的上下游引物
图1 胃癌细胞SGC-7901的形态学(20×)

表3 逆转录反应体系

表4 实时荧光定量PCR反应体系
1.2.4 瞬时转染
将胃癌细胞SGC-7901接种于细胞培养皿中,分为4组,组1(mimics对照组)、组2(hsa-miR-221组)、组3(anti-miR组)、组4(anti-miR-221),待细胞长至70%~80%时,弃去细胞培养液。4组加入 250 μL Opti-MEMLipo2000 和对照mimics、hsa-miR-221混合物、anti-miR、anti-miR-221,混合均匀放置5 min后换液,加入含10%胎牛血清DMEM培养基,RT-PCR检测miR-221的表达,观察转染效果。
1.2.5 MMT实验
将步骤4中处于对数生长期的细胞接种于96孔板中,设置第1天、2天、3天、4 天、5天共5组,每组设置3个复孔。细胞培养2~4 h细胞贴壁后加入10 μL的MTT,轻轻敲击培养板混匀,继续培养4 h,弃去孔中的混合物,加入150 μL DMSO,分别检测450 nm的吸光值,根据获得的数据绘制细胞的生长曲线。
1.2.6 蛋白印迹法(Western blotting)法检测STAT3相关蛋白的表达
采用BCA试剂盒对两组细胞进行定量,配平后加入适量的5xLoading buffer后,100 ℃煮沸5 min变性,制作SDS-PAGE凝胶,加入适量的变性蛋白进行电泳,电泳完成后将蛋白转至PVDF膜,采用3%的BSA液进行封闭,TBST液洗膜后按照1∶1 000的比例加入相应的一抗,4 ℃孵育过夜,TBST洗膜3次,按照1∶2 000加入二抗,孵育1 h,TBST洗膜3次,按照ECL试剂盒进行曝光显色,重复实验3次,采用Image J软件计算各条带的灰度值,并比较两组细胞STAT3的差异。
1.3 统计学分析
2 结果
2.1 不同胃组织miR-221阳性表达情况比较
如表5所示,胃癌组织的miR-221阳性表达率明显高于癌旁组织、正常组织(均P<0.05),癌旁组织高于正常的miR-221阳性表达率,但差异无统计学意义(P>0.05)。
2.2 正常胃上皮细胞和胃癌细胞SGC-7901细胞中miR-221的表达
如图2所示,与正常胃上皮细胞中miR-221表达水平(4.56±1.21)相比,胃癌细胞的miR-221表达水平(15.32±2.74)明显升高,差异有统计学意义(t=6.222,P=0.003)。

表5 不同胃组织miR-221阳性表达情况比较 [n(%)]
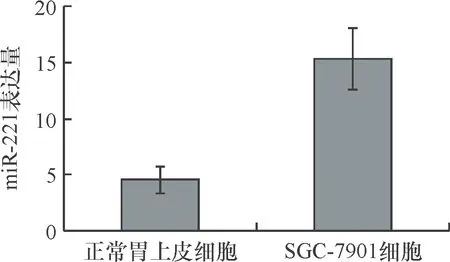
图2正常胃上皮细胞和SGC-7901细胞中miR-221表达水平比较
2.3 四组细胞中miR-221的表达的比较
如图3所示,组1(mimics对照组)、组2(hsa-miR-221组)、组3(anti-miR组)、组4(anti-miR-221组) 细胞miR-221的表达水平分别为3.49±1.15、14.36±2.81、3.18±1.26、0.58±0.16。其中组2细胞miR-221表达水平最高,组4细胞miR-221表达水平最低,组1和组3两组无明显差异,提示瞬时转染成功。
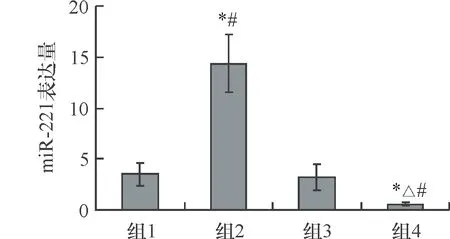
图3四组细胞miR-221的表达水平对比 四组比较,F=41.39,P=0.000;*与组1相比,P<0.05;△与组2相比,P<0.05;#与组3相比,P<0.05
2.4 miR-221对SGC-7901细胞增殖的影响
如图4所示,组1(mimics对照组)、组2(hsa-miR-221组)、组3(anti-miR组)、组4(anti-miR-221)中组2的增殖能力最强,组4的增殖能力最弱,组1和组3两组无明显差异(P>0.05)。
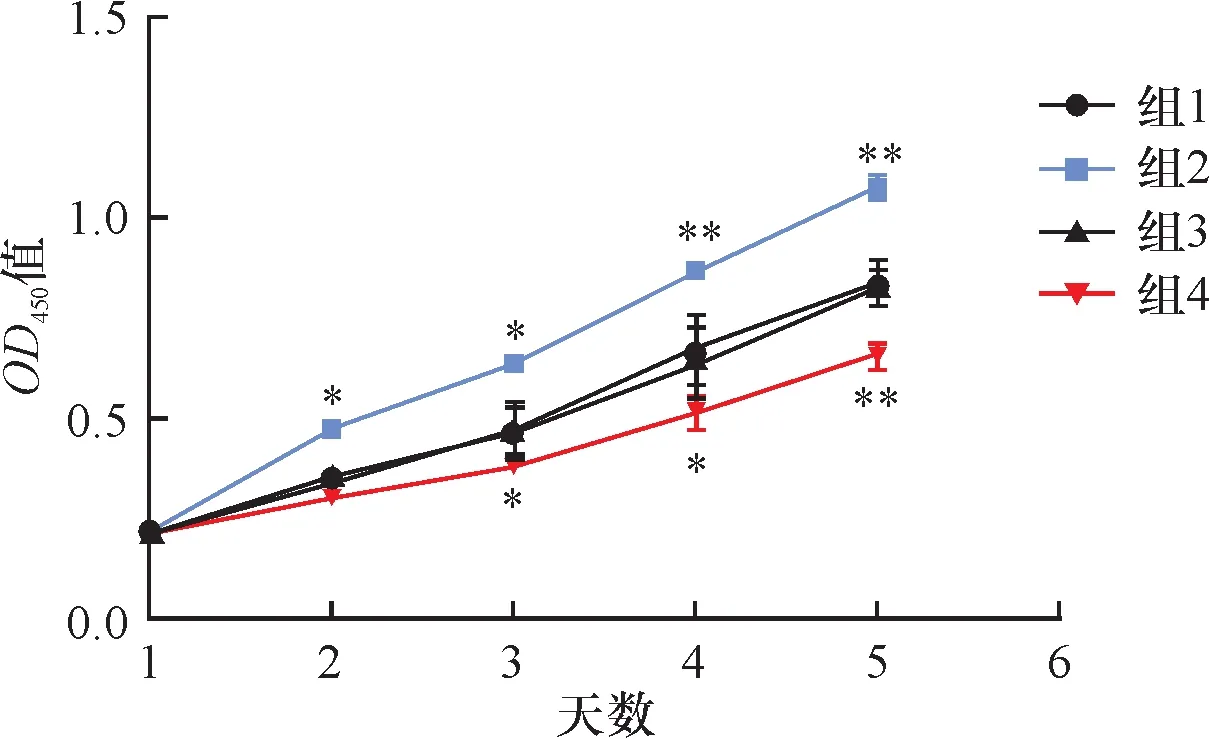
图4四组细胞增殖能力的对比 与组2、组3比较,*P<0.05,**P<0.01
2.5 miR-221对STAT信号通路的影响
如下图5、图6所示,组1(mimics对照组)、组2(hsa-miR-221组)、组3(anti-miR组)、组4(anti-miR-221组) STAT3蛋白表达水平分别为0.341±0.028、0.748±0.052、0.376±0.031、0.218±0.022。其中组2的STAT3蛋白表达水平最高,组4 STAT3表达水平最低,组1和组3两组无明显差异(P>0.05)。
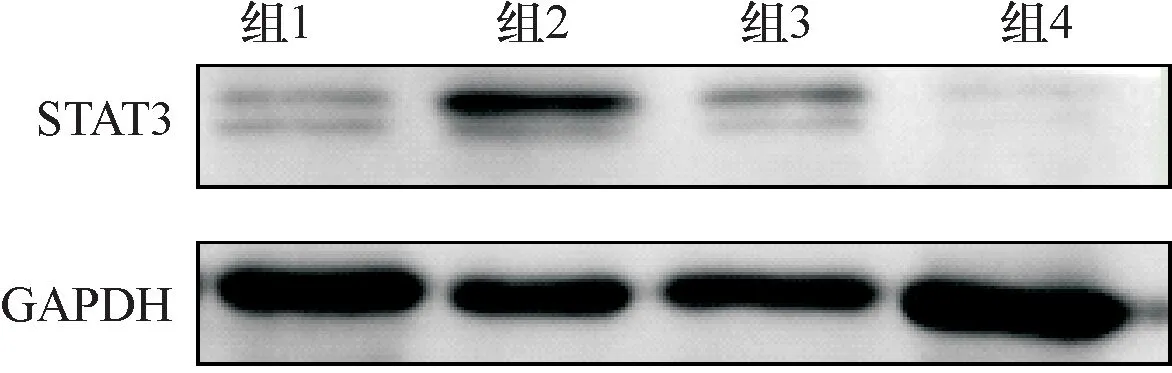
图5 四组细胞STAT3和GAPDH蛋白的表达
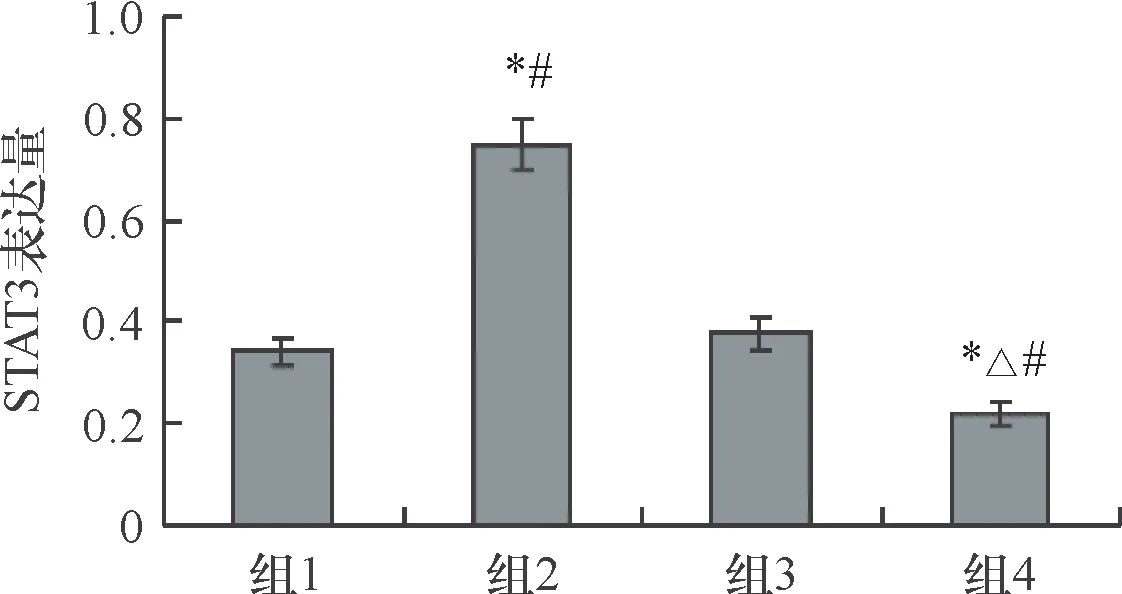
图6四组细胞中STAT3的相对表达量 四组比较,F=127.00,P=0.000;*与组1相比,P<0.05;△与组2相比,P<0.05;#与组3相比,P<0.05
3 讨论
胃癌是我国常见的恶性消化道肿瘤之一,近年来其总体发病率呈逐年上升趋势,大多数胃癌发现时已到中晚期,且治疗手段有限,因此提高胃癌的早期诊断率和临床疗效具有重要的社会和科学价值。
研究发现miRNA在各类生物中均有表达,由20~22个碱基构成的非编码的小分子RNA,通过靶向结合目的基因3’非编码区,调节转录过程,影响其蛋白的合成和表达,参与调控生物体的生长、发育、增殖、分化等多个生物学过程。最新研究发现,miR-221在肝细胞癌、胃癌、结直肠癌、肺癌等多种恶性肿瘤表达水平明显升高[12-15],因而研究miRNA在胃癌中的功能阐明其在胃癌发生和发展中的分子机制,为寻找更为精确的诊断方法和新的靶向治疗方法提供必要的理论基础。
王伟等[16]曾发现靶向抑制miR-221可抑制结直肠癌细胞的增殖并促进凋亡,miR-221对胃癌细胞增殖能力的影响鲜有报道,因此本研究通过检测不同组织和细胞中miR-221的表达,结果显示,与正常胃组织和癌旁组织相比,胃癌组织中miR-221的表达显著升高,胃癌细胞中miR-221的表达趋势与组织中的一致,提示miR-221在胃癌的发生、发展中可能发挥重要作用。
STAT3 信号通路通过介导多个生长因子和细胞因子参与细胞的增殖、分化和凋亡的过程,此信号的过度活化可引起细胞的异常增殖,在乳腺癌、胃癌、结直肠癌等恶性肿瘤中表达明显升高[17-19]。Liu S等[20]均发现miR-221通过调控STAT3信号通路影响结直肠癌细胞的增殖和凋亡。本研究运用MTT检测过表达miR-221和靶向抑制miR-221对细胞增殖能力的影响,结果表明,过表达miR-221可明显促进胃癌细胞的增殖,而下调miR-221可明显抑制胃癌细胞的增殖,同时运用免疫印迹法检测STAT3蛋白的表达水平,结果显示,过表达miR-221可明显促进STAT3蛋白的表达,而下调miR-221的表达可抑制STAT3蛋白的表达,提示miR-221可能通过激活STAT3信号通路促进胃癌细胞的增殖。miR-221相关的靶基因很多,因此否还存在其他信号通路参与还需进一步研究。
