红水樱桃种子玻璃化超低温保存
2019-05-28
(1.贵阳学院生物与环境工程学院, 贵阳 550003; 2.贵州大学农业生物工程重点实验室, 贵阳 550025;3.贵阳市农业试验中心, 贵州 贵阳 550003)
红水樱桃(PrunuspseudocerasuL.‘Hongshui’)是贵州省安顺市镇宁县主栽中国樱桃品种之一,在当地具有很强的适应性,市场销量大,具有一定的经济价值。有关红水樱桃的研究较少,尤其是种质资源长期保存方面,至今未见报道。
常见的种质资源保存为离体保存,常规的离体保存有体细胞无性系变异情况,而超低温保存是将材料储存在液氮中保存数百年甚至更长时间[1],是目前唯一可行的长期保存方式[2],至今已有许多关于种子超低温保存的报道。蓝药花[1]、黑杨[3]、玉簪[4]和中国红豆杉[5]等均已获得成功。樱桃种子超低温保存方面,Chmielarz等[6]对欧洲野樱桃进行了超低温保存,而中国樱桃在此方面却未见报道。众所周知,同一植物品种不同离体保存条件亦有差异,因此,考虑红水樱桃市场价值较大和适应性强的特点,对其种子进行超低温保存实验,以期为育种、砧木繁殖等提供物质保障,同时对中国樱桃种质资源长期保存提供方法参考。
1 材料与方法
1.1 材 料
红水樱桃种子于2015年4月下旬采自贵州安顺镇宁县,去果肉晾干后置于4 ℃冰箱保存4个月备用。
1.2 方 法
1.2.1种子含水量测定
绝对含水量(T1):将100 g种子置于105 ℃恒温干燥箱中快速干燥至恒重W;相对含水量(T2):将一定重量种子(W1)置于30 ℃恒温干燥箱中干燥至一定重量(W2)。
T1=(100-W)/100;
T2=[W2-W1·(1-T1)]/W2。
1.2.2实验设计
本实验分别探讨了种子不同含水量[25%、30%、35%及45%(T1)]、不同装载时间[0、20、40及60 min]、不同玻璃化时间[0、30、60及90 min]及去留种壳对超低温保存的影响(表1)。
含水量实验:将带种壳种子于4 ℃经60%PVS2(PVS2: 0.15 mol/L蔗糖=60∶40)装载20 min,然后室温下经PVS2(30%甘油+15%乙二醇+15%DMSO+0.4 mol/L蔗糖)玻璃化60 min,更换PVS2后立即投入液氮。
装载时间实验:将含水量30%的带种壳种子于4 ℃经60%PVS2处理相应时间,然后室温下经PVS2玻璃化60 min,更换PVS2后立即投入液氮。
玻璃化时间实验:将含水量30%的带种壳种子于4 ℃经60%PVS2装载20 min,然后室温下经PVS2处理相应时间,更换PVS2后立即投入液氮。装载和玻璃化处理时设置2个对照,探讨冰冻保护剂对种子的影响,即ck1:含水量为30%的种子不经处理直接投入液氮;ck2:含水量为30%的种子不经处理,但加PVS2后投入液氮。
表1 4种因素对红水樱桃种子超低温保存的影响
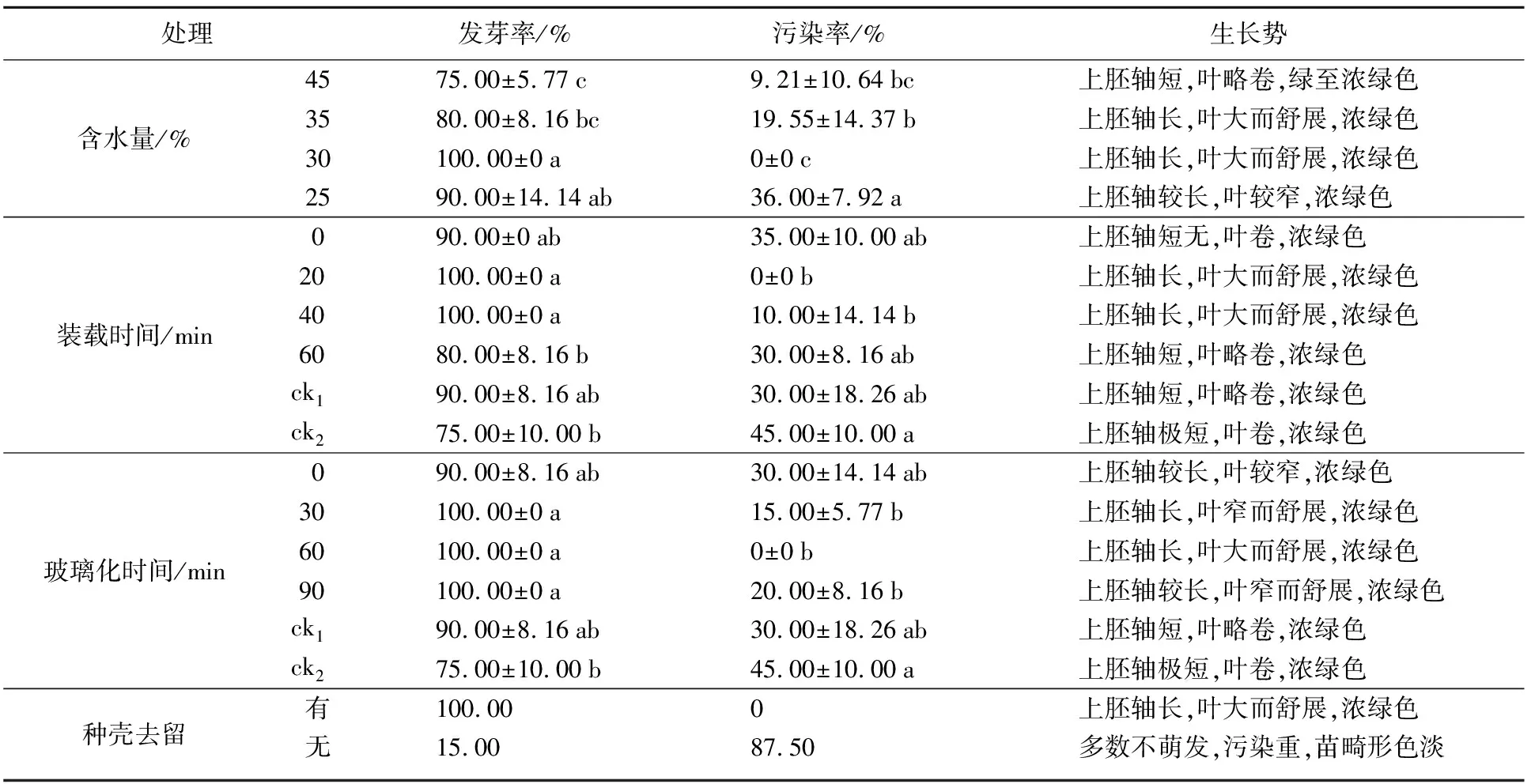
处理 发芽率/% 污染率/% 生长势 含水量/%4575.00±5.77c9.21±10.64bc上胚轴短,叶略卷,绿至浓绿色3580.00±8.16bc19.55±14.37b上胚轴长,叶大而舒展,浓绿色30100.00±0a0±0c上胚轴长,叶大而舒展,浓绿色2590.00±14.14ab36.00±7.92a上胚轴较长,叶较窄,浓绿色装载时间/min090.00±0ab35.00±10.00ab上胚轴短无,叶卷,浓绿色20100.00±0a0±0b上胚轴长,叶大而舒展,浓绿色40100.00±0a10.00±14.14b上胚轴长,叶大而舒展,浓绿色6080.00±8.16b30.00±8.16ab上胚轴短,叶略卷,浓绿色ck190.00±8.16ab30.00±18.26ab上胚轴短,叶略卷,浓绿色ck275.00±10.00b45.00±10.00a上胚轴极短,叶卷,浓绿色玻璃化时间/min090.00±8.16ab30.00±14.14ab上胚轴较长,叶较窄,浓绿色30100.00±0a15.00±5.77b上胚轴长,叶窄而舒展,浓绿色60100.00±0a0±0b上胚轴长,叶大而舒展,浓绿色90100.00±0a20.00±8.16b上胚轴较长,叶窄而舒展,浓绿色ck190.00±8.16ab30.00±18.26ab上胚轴短,叶略卷,浓绿色ck275.00±10.00b45.00±10.00a上胚轴极短,叶卷,浓绿色种壳去留有100.000上胚轴长,叶大而舒展,浓绿色无15.0087.50多数不萌发,污染重,苗畸形色淡
注:同列内相同字母表示经邓肯氏多重极差检验在0.05水平上差异不显著。
去留种壳实验:将含水量30%的种子分去掉种壳和保留种壳处理,均在4 ℃经60%PVS2装载20 min,然后室温下经PVS2玻璃化60 min,更换PVS2后立即投入液氮。每处理为40粒种子,每10粒为一个重复,重复4次。
1.2.3发芽率检测
所有处理经液氮保存1 d后用43 ℃水浴解冻3 min,去种壳后经无菌水浸泡2 h,在超净工作台上用70%酒精浸泡30 s,用0.1%升汞+数滴吐温80灭菌10 min,再用无菌水清洗5次后去种皮接种在1/2 MS+1.0 mg·L-16-BA+0.5 mg·L-1IBA+2.0 mg·L-1GA+3.0%蔗糖+0.7%琼脂粉培养基上诱导萌发。温度(25±2)℃,光强33μmol·(m2·s)-1,光周期14 h/d,20 d后统计发芽率和污染率,发芽率=(发芽数/原接种数)×100%,污染率=(污染数/原接种数)×100%,除种壳处理外数据采用SPSS 17.0软件处理。
2 结果与讨论
2.1 种子含水量的影响
樱桃种子含水量对其超低温保存有显著影响(表1)。本试验中,含水量25%的发芽率为90%,叶面较窄,污染率为36%;含水量30%的种子发芽率达100%,无污染,且出芽后上胚轴长,叶大而舒展;含水量为35%的种子虽然发芽率仅80%,但生长势较好,污染率为19%;含水量45%的种子不仅发芽率最低(75%),且上胚轴短,叶略卷,色稍淡。因此,以含水量30%的种子进行超低温保存较好。
2.2 装载时间的影响
种子装载时间对其超低温保存后的发芽率有一定影响(表1)。装载20 min和40 min时发芽率均为100%,且上胚轴长,叶大而舒展;装载0 min时为90%,但上胚轴短或无,叶卷曲;装载60 min时仅80%,且上胚轴短,叶略卷。不经任何处理直接投入保存的ck1,发芽率虽然也达90%,但上胚轴短,叶略卷,形态较差;不经处理但加PVS2后再保存的ck2,发芽率仅为75%,上胚轴也极短,叶卷,畸形较重。因此,预处理时间以20~40 min为好。
2.3 玻璃化时间的影响
虽然PVS2玻璃化时间的长短对种子超低温保存成活率影响不大,但对生长势有较大影响(表1)。经PVS2处理30~90 min的种子,发芽率没有区别,均为100%,但其生长势以60 min时为好,上胚轴长,叶大而舒展,其余两者叶片较窄;处理0 min时发芽率略低(90%),上胚轴稍短,叶较窄。ck1和ck2表现同2.2。因此,种子超低温保存时用PVS2处理60 min为好。
2.4 种壳的影响
种壳对种子超低温保存有显著影响(表1)。带种壳发芽率达100%,且无污染,上胚轴长,叶大而舒展,色浓绿;而无种壳发芽率仅15%,且苗畸形,污染率高达87.5%。因此,樱桃超低温保存时保留种壳为好。
3 讨 论
3.1 含水量和种壳
种子超低温保存的关键因素是确定最适含水量[6],不同植物适宜含水量范围不一样。垂枝桦超低温保存的最佳含水量为2%~23%[7]。欧洲野樱桃种子剥除种壳后,最佳含水量为9%~16.9%[6]。而本试验带种壳的红水樱桃种子最佳含水量为30%。2种樱桃种子含水量差别较大,分析原因有2个,第一,含水量计算时有带种壳和不带种壳的区别,差别有多大还有待进一步探讨;第二,含水量并非樱桃种子超低温保存的关键因素。欧洲甜樱桃种子含大量以甘油三酯形式存在的脂类物质[8],此类种子能忍受低温[9],因此,含水量并非甜樱桃种子超低温保存的关键条件[6]。本试验亦认为含水量并非贵州樱桃种子超低温保存的关键因素,其关键因素是种壳保留与否。本试验中不带种壳进行超低温保存,几乎不萌发,污染率极高,究其原因可能是经过低温与室温之间的变化刺激,种皮易破裂污染所致。合欢种子超低温保存时,含水量为5.76%~10.03%时萌发力没有明显差异,但炸裂率明显提高[10]。种子存入液氮后炸裂,认为是在冷冻和解冻过程中种子要经受极大的物理压力,如果种子的细胞间质承受不了如此巨大的压力,就会产生物理损伤,种皮破裂,这承受力跟种子含水量有关系[11-12]。而试验认为种壳能极大地提高这种承受力,带种壳的樱桃种子少见种皮破裂现象,且存活率高,生长势良好,可能因种壳厚实,能减缓温度变化对种皮的直接伤害而起保护作用。在种壳的保护下,水分影响略显轻微。
3.2 装载和玻璃化
虽然试验中装载和玻璃化时间变化未造成种子发芽率的急剧下降,但各处理生长势有较大区别,处理时间过短或过长都易造成上胚轴短和叶片狭窄卷曲。玻璃化冰冻保护剂可减少自由基变化,从而避免细胞损伤[13-15],但大多数玻璃化液对材料有毒害作用。因此,玻璃化处理前,通常增加一个装载过程,即用含少量玻璃化液的溶液对材料进行预处理,不仅能降低材料含水量,同时能让材料逐渐适应玻璃化溶液的毒性,降低损伤。ck1和ck2相比,ck2发芽率和生长势都较差,说明未经装载和玻璃化处理,直接使用玻璃化溶液对材料损伤更大。此外,装载20 min后玻璃化处理0 min时,生长势比装载0 min后玻璃化处理60 min时的生长势好,胚轴相对较长,叶片也无卷曲,说明装载过程对种子超低温保存十分重要,这是植物适宜玻璃化液毒性的一个过程,从而降低玻璃化液的损伤。
