火龙果miRNA表达分析的qRT-PCR检测体系建立
2019-05-28
(贵州大学农业生物工程研究院/生命科学学院,山地植物资源保护与保护种质创新教育部重点实验室,贵阳 550025)
MicroRNA(miRNA)是由19~25个核苷酸组成的非编码单链小RNA[1-2],通过碱基互补配对切割靶基因、抑制翻译、介导DNA甲基化等过程实现调控功能[3],参与植物形态建成、激素应答和逆境胁迫等生物学过程[4-6]。近年来,如何精准检测miRNA是否表达及表达量成为研究重点,目前的检测方法主要有原位杂交、Northern blot和qRT-PCR等,其中qRT-PCR以其灵敏度高、特异性强、操作简便等优势,已成为基因检测的首选方法[7]。由于长度短小,miRNA的qRT-PCR与普通PCR不同,前者需延长待测miRNA的长度,构建出足够长的PCR模板。目前,基于茎环法[8]和多腺苷酸聚合酶加尾法(poly A polymerase,PAP)[9]设计特异引物,采用qRT-PCR技术成为miRNA的常用检测方法。同时,由于RNA数量和质量等因素可能会影响miRNA的检测效果,常规qRT-PCR的内参基因不适合miRNA检测[10]。因此,特异引物的设计和内参基因的选择成为植物miRNA检测的关键。
贵州属南亚热带和中亚热带气候,在喀斯特高温干旱地区火龙果已成为新、特、优农业项目[11]。火龙果具有较强的抗逆性且易于栽培等特性[12-15],在生产上有广阔的发展前景。为进一步从非编码基因方向理解火龙果抗逆分子机理,本课题组在前期进行了干旱胁迫下火龙果小RNA组测序,获得了大量miRNA序列。迄今,尚未有文献报道关于火龙果miRNA的qRT-PCR检测。因此,火龙果miRNA内参基因的筛选及qRT-PCR检测体系的建立亟待解决。从小RNA组测序结果中选取了干旱胁迫下差异显著表达的miR 396 b,分别使用茎环和PAP加尾qRT-PCR法检测miR 396 b在火龙果不同组织及干旱(15%PEG)胁迫下的表达情况,通过特异性、灵敏度及检测通量等方面对此2种方法进行综合比较,并对常用的内参基因5 S和U 6进行稳定性比对,旨在建立火龙果miRNA的qRT-PCR检测体系,为开展火龙果相关miRNA的研究奠定基础。
1 材料与方法
1.1 材料及干旱处理
火龙果根、茎、果实采自贵州罗甸新中盛火龙果基地,干旱处理材料取自贵州大学农业生物工程研究院科研温室,选长势一致的“紫红龙”组培苗在1/2 MS液体培养基中预培养1周,然后转移到含15%PEG-8000的1/2 MS液体培养基,实施人工诱导干旱胁迫处理0,2,8 h和20 h,以同期未处理材料为对照,取3个生物学重复材料,用液氮迅速冷冻后于-80 ℃保存。qRT-PCR相关引物由上海生物工程有限公司合成,序列见表 1。
表1 火龙果miR 396 b实时定量PCR引物序列
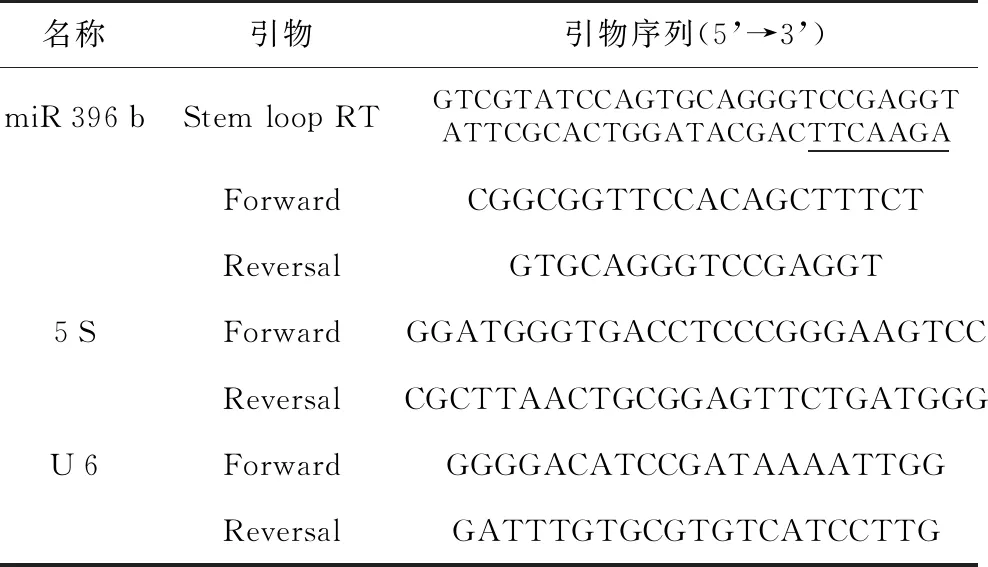
名称引物引物序列(5’→3’)miR396bStem loop RTGTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTTCAAGAForwardCGGCGGTTCCACAGCTTTCTReversalGTGCAGGGTCCGAGGT5SForwardGGATGGGTGACCTCCCGGGAAGTCCReversalCGCTTAACTGCGGAGTTCTGATGGGU6ForwardGGGGACATCCGATAAAATTGGReversalGATTTGTGCGTGTCATCCTTG
注:划线部分为与miR 396 b的3’端互补部分。
1.2 总RNA提取及cDNA合成
分别取根、茎、果实及干旱处理后的幼茎,采用miRcute miRNA 提取分离试剂盒(Tiangen,北京)提取总RNA;RNA浓度及纯度用Thermo NanoDrop 2000酶标仪(Thermo Fisher,美国)测定;完整性用2%的琼脂糖凝胶电泳检测。
茎环法、PAP加尾法反转录体系及反应程序分别按照试剂盒说明书(Thermo Fisher,美国)、miRcute增强型miRNA c DNA第一链合成试剂盒(Tiangen,北京)进行。
1.3 相关指标检测
通过荧光染料SYBR Green I qRT-PCR检测miR 396 b、5 S及U 6相关指标。茎环法定量反应体系为:2×Taq SYBR Green PCR Mix 5μL,F、R Primer(10μM)各 0.5μL、cDNA 1μL、ddH2O补至10μL。反应程序:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,35个循环;PAP加尾法定量反应程序及体系参照miRcute增强型miRNA荧光定量检测试剂盒(Tiangen,北京)。
由引物扩增效率及熔解曲线确定qRT-PCR的特异性,扩增效率在90%~110%之间,同时熔解曲线为特异单峰;比较茎环法和PAP加尾法灵敏度,取火龙果幼嫩茎RNA逆转录合成的cDNA按10倍比依次稀释,最终稀释107倍,检测火龙果miR 396 b能检测到Ct值的最大稀释比例;比较5 S和U 6作为内参基因时的稳定性。
1.4 茎环法检测火龙果miR 396 b表达情况
采用茎环法qRT-PCR检测火龙果 miR 396 b在不同组织及干旱胁迫下的表达情况,反应体系及程序同1.3,结果用2-△△CT法分析,差异显著性利用SPSS 21.0软件进行单因素方差分析,以p<0.05作为差异显著性判断标准。
2 结果与分析
2.1 标准曲线绘制及灵敏度分析
将火龙果肉质茎RNA分别使用茎环法和加尾法逆转录合成cDNA,以同—cDNA为模板,分别以10倍比稀释cDNA,荧光染料SYBR Green I qRT-PCR检测miR 396 b,设置3个复孔。结果显示,加尾法和茎环法分别在cDNA稀释106倍和107倍后检测不到Ct值(表2)。茎环法、加尾法能检测到miR 396 b的RNA最低浓度分别为138.9×10-5ng/μL、138.9×10-4ng/μL。与加尾法相比,茎环法检测miR 396 b灵敏度增加了10倍。由此,茎环法在检测灵敏度上优于加尾法。
茎环法检测miR 396 b时Ct值在 21.31±0.26间,扩增效率为113.24%;而加尾法检测时Ct值在24.95±0.25之间,扩增效率为134.03%。加尾法比茎环法高出约3个Ct值、扩增效率高出约21%(表2、图1)。
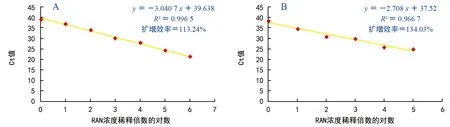
图1 miR 396 b茎环法(A)与加尾法(B)qRT-PCR标准曲线
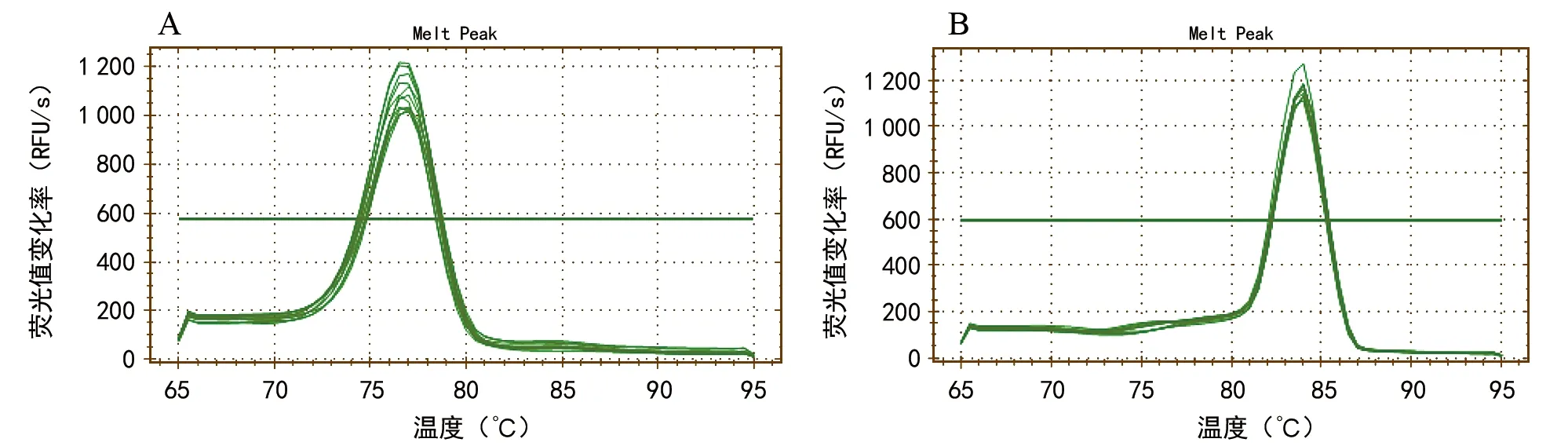
注:茎环法(A)与加尾法(B)实时定量 PCR 法产物溶解曲线峰图;横线为检测基线。图2 Bio-Rad CFX manager软件检测hpo-miR 396 b溶解曲线分析图
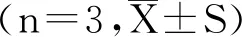

c DNA稀释倍数茎环法加尾法021.31±0.2624.95±0.2510-124.21±0.1025.77±0.1310-227.92±0.2229.90±0.0810-330.09±0.1530.83±0.0510-433.94±0.1934.67±0.3110-536.95±0.2938.38±0.4810-639.19±0.37—10-7——
注:“—”表示未检测出Ct值。
2.2 引物特异性分析
采用茎环法和加尾法检测火龙果miR 396 b表达量,结果显示,加尾法溶解曲线在主峰前出现了小峰(图2 B),说明PCR过程中存在非特异扩增;茎环法溶解曲线为单峰(图2 A),说明PCR产物单一,引物特异性好。由此,茎环法在特异性上优于加尾法。
2.3 茎环法与PAP法综合比较
根据MIQE实时荧光定量PCR国际化标准,无论是茎环法还是加尾法检测miRNA的表达量,其标准曲线的相关系数(R2)大于0.98,越接近1,结果可信度越高;扩增效率(En)在0.9~1.1间,越接近1,越理想。本试验结果显示,用茎环法检测火龙果miR 396 b其标准曲线R2为0.996 5、En为113.24%;加尾法检测其标准曲线R2为0.966 7、En为134.03%(图1),显然,茎环法检测火龙果miRNA的表达结果更准确。虽然加尾法RT-PCR实验所用时间短,其在检测通量、反转录准确性上都优于茎环法(表3),但是定量试验对特异性、灵敏度要求较高,这一点茎环法更具优势。综上比较,茎环法更适用于火龙果miRNA表达分析的qRT-PCR检测。
2.4 内参基因5 S和U 6稳定性比较
以火龙果的茎、根、果实及干旱处理下的茎为试材,分别检测内参基因5 S和U 6的稳定性。结果表明,5 S作为内参时Ct值范围为19.85~21.42,扩增效率为109.18%;U 6作为内参时Ct值的范围是18.18~19.37,扩增效率为114.7%。本试验结果表明,U 6的Ct值比较一致,更适合作为龙果miRNA的内参基因(表4,图3)。
2.5 miR 396 b在不同组织及干旱胁迫下的表达分析
以U 6为内参,用茎环法qRT-PCR检测miR 396 b在火龙果中的表达情况。结果显示,miR 396 b在火龙果不同组织中均有表达(图4 A)。以茎为对照,miR 396 b
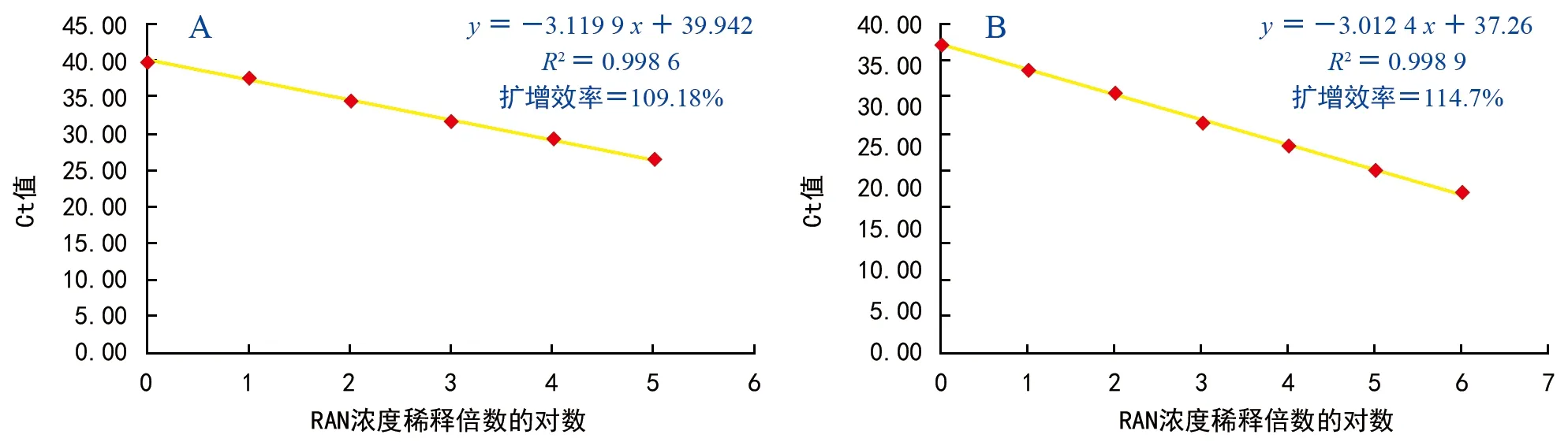
图3 内参基因5 S(A)、U 6(B)qRT-PCR标准曲线
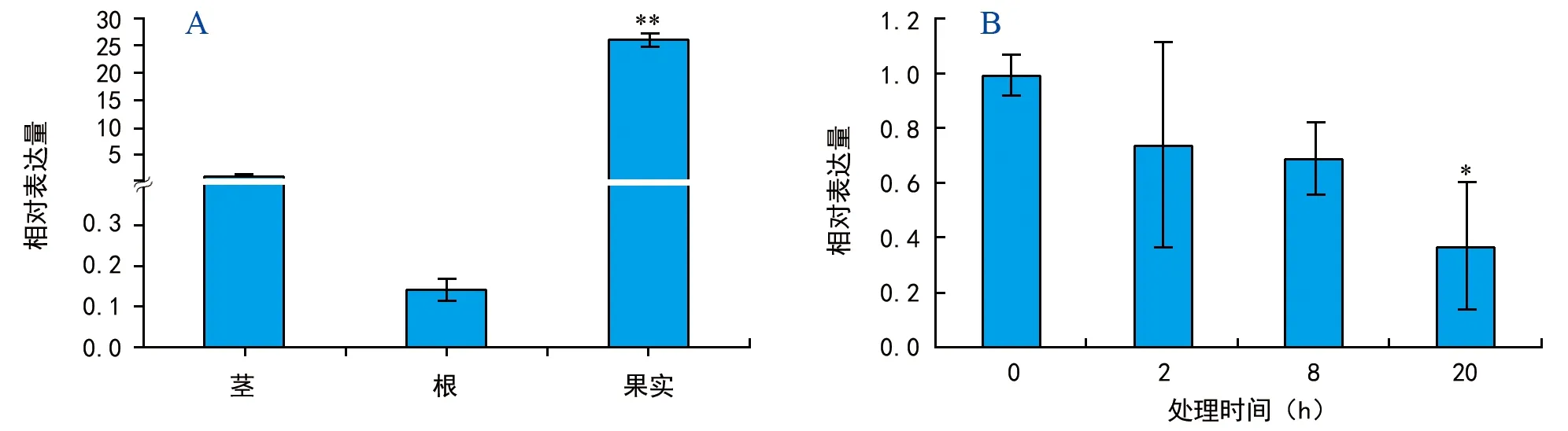
注:“*”表示在p<0.05水平上差异显著,“**”表示在p<0.01水平上,差异极显著。图4 火龙果miR 396 b在不同组织(A)及干旱胁迫下(B)的相对表达情况
表3 茎环法与PAP法qRT-PCR综合比较

茎环法反转录加尾法反转录检测通量一次反转录只能检测1个miRNA一次反转录可检测多个miRNA反转录准确性内参与miRNA分开,在2个体系分别反转录,容易产生误差内参与miRNA一起,在同1个反应体系反转录,准确性高检测特异性☆☆☆☆☆☆☆☆☆检测灵敏度☆☆☆☆☆☆☆☆☆实验时间+++++++++
注:“☆”越多表示特异性、灵敏度越高;“+”越多表示实验所用时间越多。
在火龙果根中几乎不表达,在果实中的表达量约是茎中的26倍,达到极显著水平(p<0.01),表明hpo-miR 396 b可能参与调控火龙果生长发育。
在干旱胁迫下miR 396 b的表达呈下调趋势(图4 B),处理2、8 h后差异不显著(p>0.05),而处理20 h后的差异达到显著水平(p<0.05)。与0 h相比,在处理20 h后miR 396 b的表达量下调了37%,推测火龙果miR 396 b可能参与应答干旱胁迫。
3 讨 论
自第1个miRNA(lin-4)在线虫(Caenorhabditiselegans)中被发现以来,很多学者便展开miRNA作用机理的研究[16]。为探讨更多miRNA的未知功能,选择合适的方法尤为重要,虽因miRNA的短小对其研究提出了巨大挑战,但仍有多种检测方法被开发出来[8-9,17-18]。qRT-PCR 技术包括荧光染料法和探针法[19]。探针法主要采用Taq Man荧光探针,特异性高于染料法,但成本高。本研究设计特异性茎环反转录引物,通过荧光染料SYBR Green I qRT-PCR检测火龙果miR 396 b的表达量相对PAP加尾法更具优势,本研究结果与相关文献报道茎环法、加尾法检测miRNA的精确度、特异性和灵敏度一致[20-23]。
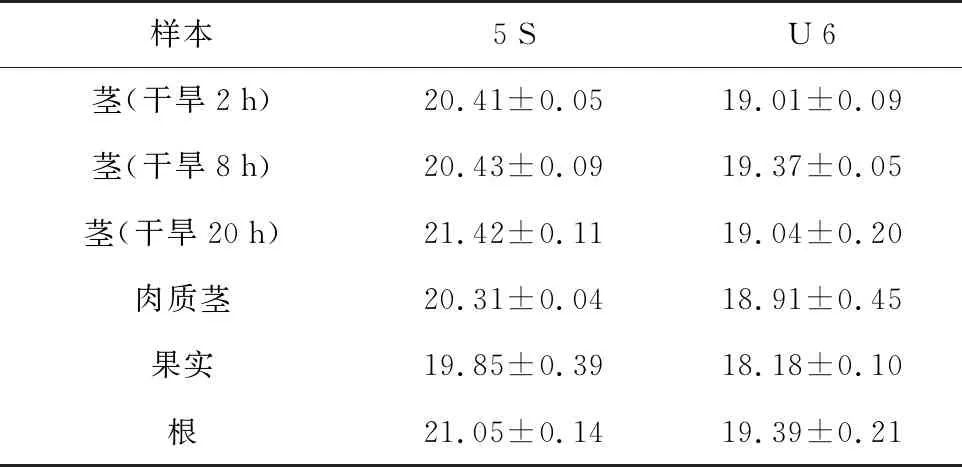
样本5SU6茎(干旱2h)20.41±0.0519.01±0.09茎(干旱8h)20.43±0.0919.37±0.05茎(干旱20h)21.42±0.1119.04±0.20肉质茎20.31±0.0418.91±0.45果实19.85±0.3918.18±0.10根21.05±0.1419.39±0.21
本实验用茎环法、加尾法分别对火龙果miR 396 b进行了处理,人为地延长了反转录产物,其中设计的茎环结构hpo-miR 396 b反转录引物,经qRT-PCR发现引物特异性、扩增效率和R2均符合实验要求,表明该方法可以准确的反应hpo-miR 396 b的表达量。在内参基因的选择上,本实验探究出U 6更适合作为火龙果miRNA的内参基因。相关献报道选择同种属表达量恒定的miRNA作为内参定量结果更准确[24],在实际研究中,建议选择多个预作为miRNA内参的基因进行稳定性评价后,最终选择一个合适的内参。
本研究发现,hpo-miR 396 b在火龙果的茎、根、果实中均有表达,且在果实中的表达量最高。 有报道表明,miR 396在植物不同组织均有不同程度的表达[25-27]。Kim等[28]和Liu等[29]研究发现拟南芥GRF家族9个成员中有6个是miR 396的靶基因。在植物中,miR 396通过介导GRF进而调控细胞的增殖分化[25];影响着植物的生长发育及逆境响应能力[30]。火龙果hpo-miR 396 b在果实中积累,可能通过介导靶基因GRF从而调控果实的发育,这可能是我们发现火龙果果实中miR 396 b表达量高的原因。此外,hpo-miR 396 b在火龙果干旱处理后表达量呈下调趋势,暗示hpo-miR 396 b在响应干旱胁迫中具有重要作用,这与刘伟灿[31]对干旱胁迫下大豆miR 396的研究结果一致。本研究成功建立了火龙果miRNA 茎环SYBR Green I qRT-PCR检测体系,为火龙果相关miRNA的研究奠定了基础。
