小鼠初级听皮层第6层同侧响应神经元对对侧响应特征频率的修饰加工
2019-05-27严林清张新贵肖中举
严林清,张新贵,肖中举△
(1.南方医科大学基础医学院生理学教研室,广州 510515;2.汕头大学精神卫生中心,广东汕头 515065)
初级听觉皮层(primary auditory cortex,A1)在双耳整合中发挥着关键的作用,它接受来自丘脑的上传投射和皮层间的相互投射[1-2]。通过整合同侧和对侧感觉的输入,皮层神经元在双侧信息整合上有多种功能表现。例如在声音处理上,声源定位主要依赖双耳时间差(interaural time difference,ITD)和双耳强度差(interaural level difference,ILD)[3]。A1作为听觉传导通路到达大脑皮层的第1站,单侧皮层损伤缺损实验证实A1参与声源定位[4],同时也存在双耳整合神经元,此类神经元的拓扑学分布是客观存在[5]。
根据不同单侧耳神经元响应特征把双耳神经元简单划分为一侧耳兴奋,另外一侧耳也兴奋和一侧耳兴奋、另外一侧耳抑制类神经元[6]。对于双耳整合神经元的功能特点,目前普遍认同的观点是:神经元编码ITD或者ILD,进而转换为空间特征的信息,完成对声音空间位置的编码[7]。但上述研究局限在对声源定位的研究上,对双耳整合频率研究的方法较传统,因此与声音频率相关上双耳整合的突触机制并不清楚。通过多单位记录手段证明,A1从浅层到深层的细胞集群具有相似的特征频率(characteristics frequency,CF),即具有相似功能或者相似的响应特点[8],也就是存在相似频率垂直功能柱。但上述研究的局限性在于对对侧优势耳响应进行了相似频率的划分,并没有考虑同侧耳(Ipsi)的输入会对对侧耳(Contra)造成的影响,因此单侧耳响应的频率功能柱并不代表双侧耳(Bi)共同响应的反应特点。另外,由于A1第6层(layer 6,L6)位置较深的关系,记录较难,并不能很好地在在体清醒动物上开展单细胞膜片钳记录,多单位记录并不能精确地得到带宽、CF等神经元特征性变化的参数[9]。
本文首先在体清醒动物单细胞贴附式记录得到A1 L6同侧有或者无声响应的神经元双耳整合后准确的特征参数:阈值上20 dB带宽(BW20)、反应延时(Onset-Latency)、阈值(Threshold)、CF等,再通过在体全细胞膜片钳的方法研究双耳整合神经元特征参数的突触机制,最后用双重免疫荧光标记法证实同侧声刺激激活同侧听皮层L6的抑制性神经元,进而可能参与调节对侧响应的抑制性输入。
1 材料与方法
1.1材料 本实验采用在体清醒动物的膜片钳技术,所用的电极为玻璃电极,拉制后呈椎形,尖端直径约1 μm,结合自动推进器能进行精细操作;所使用的78只SPF级C57BL/ 6J雌性小鼠均由南方医科大学实验动物中心提供,周龄6~8周。小鼠因为体质量较轻,雌性小鼠也较安静,清醒状态下小鼠的肢体运动对被钳制的细胞的稳定性可以经由训练控制,能在小鼠运动状态下还能记录到被钳制的细胞,因此小鼠比较适合做清醒动物的在体膜片钳记录模型。实验全过程均在南方医科大学动物保护和使用管理委员会的批准和监督下进行。
1.2方法
1.2.1实验动物手术准备 实验小鼠用戊巴比妥钠(60 mg/kg)腹腔麻醉后,转置于立体定位仪进行定位,将头背面向左倾斜70°左右并固定小鼠头部。剪开小鼠头部皮肤和部分肌肉,充分暴露颞骨和顶骨,以后卤上骨缝与骨隆交点为零点,旁开0.3 mm,分别在距此点向前卤方向1.5~3.0 mm处标记A1的位置。并在小鼠非听觉相关核团埋置参比电极,用牙科水泥将一根长约1.5 cm的自制铁钉固定在颅骨表面。待牙科水泥完全凝固后,将小鼠置于实验台上,头钉末端插入一已经固定在防震台的金属固定杆上的小孔里,调节好小鼠头部让其处于合适的体位,并上紧螺丝固定住头钉,在体视显微镜下用小钻头在已经标记的A1位置的颅骨上钻约0.5 mm×0.5 mm大小的颅窗,充分暴露听皮层,并保护好暴露的脑组织及创口。待第2天小鼠恢复清醒后给予动物训练,动物训练放在类似记录时的环境下,小鼠每次训练2~4 h,每天3次,训练2 d,训练期间每隔1小时在红外摄像头下观察并记录老鼠的状况,待小鼠能长时间内保持安静状态后进行记录。
1.2.2在体清醒动物细胞贴附记录 细胞贴附式记录(cell-attached recording)所用仪器有TDT system Ⅲ系统、膜片钳放大器700B (Axon Instrument,美国)和数模转换器1440A (Axon Instrument,美国)。通过软件Clampex10.2 和Brainware控制实验条件和保存数据。找到听觉相关神经元后,闭合场行频率-强度扫描,纯音序列强度:0~70 dB SPL(10 dB SPL的间隔),线性频率:2~48 kHz(1 kHz间隔),上升/下降时间为5 ms,时程为50 ms,随机给声,每个声音2次/秒,每个声音重复3~5次。定义记录侧为给声同侧,Ipsi、Contra和Bi随机给声,并将神经元的电活动和声音方案保存在软件Brainware的DAM文件里和Clampex软件的ABF文件里。在细胞外贴附的膜片钳记录实验中,通过同侧给声观察同侧皮层神经元是否有给声后发放,如果发放数高于自发放的3倍的标准差定义为同侧给声响应类神经元,反之,则定义为同侧给声无响应神经元。
1.2.3在体全细胞记录 全细胞记录是以细胞贴附式记录为基础,达到高阻(GΩ)封接,给予一定负压抽吸让电极管内的细胞膜撕裂,从而使电极内液与细胞内液的成份互相交换,可用不同钳制方式反映膜电位或者膜电流的变化[10-11]。当钳制在0 mV时(钠离子的平衡电位),可记录到抑制性突触后电流(IPSC);当钳制在-70 mV时(氯离子的平衡电位),可记录到兴奋性突触后电流(EPSC)。给声方案如上,采取同一强度60 dB不同频率(3~45 kHZ)随机扫描3遍,声音刺激方案保存在Brainware的DAM文件里,IPSC和EPSC的波形保存在Clampex软件的ABF文件里面。在全细胞实验中,通过同侧给声观察同侧皮层神经元是否有给声后阈下输入,如果叠加后的反应波形大于基线的3倍标准差定义为同侧给声响应类神经元,反之,则定义为同侧给声无响应类神经元。
1.2.4灌注固定和双重免疫萤光 为避免运动或者外在环境噪声对小鼠造成的干扰,小鼠给声前予以20%乌拉坦(0.45~0.50 mL/100 g)麻醉。固定头部,一侧外耳道口放置闭合声场软管(定义给声同侧),在屏蔽室内隔音、避光放置3 h后单侧给纯声90 min(12 kHz,60 dB,50 ms duration,给声频率2次/秒)。给声结束后小鼠仍处于深度麻醉状态,随后立刻采用心脏灌流法,依次灌注4 ℃保存的冰冻0.9%生理盐水和4%多聚甲醛各50 mL,固定后择期进行切片,切片厚度每片为40 μm。根据小鼠脑立体定位图谱收集目标脑片进行免疫萤光双染[12]。步骤如下:0.01 mol/L PBS漂洗3遍,每遍10 min;0.3%双氧水孵育30 min(避光,防止双氧水见光分解);PBS漂洗3遍,每遍10 min;0.25% Triton(打孔用)孵育2 h;PBS漂洗3遍;2.5%山羊血清封闭2 h;一抗4 ℃孵育过夜(c-Fos∶sc-52为1∶500;Anti-GAD67 Antibody∶clone 1G10.2,1∶1 000,稀释液为5%山羊血清);复温后用0.01 mol/L PBS漂洗3遍,每遍10 min;二抗室温避光孵育2 h(Alexa Fluor®488 goat anti-mouse IgG (H+L),1∶500;Alexa Fluor®594 goat anti-rabbit IgG(H+L),1∶500,稀释液为0.01 mol/L PBS);PBS漂洗3遍;移至干净的载玻片,自然风干后封片,使用共聚焦显微镜(Nikon,A1R,Japan)观察,大脑切片经免疫荧光染色后,使用蓝光(激发光波长为488 nm)为激发光,可检测到经过GABAergric染色神经元的胞体为黄绿色荧光;使用绿光(激发光波长为568 nm)激发,可检测到经过c-fos蛋白的神经元胞核为橙红色荧光[13],分别在低倍或者高倍进行检测,仪器会根据不同厚度的细胞层进行分层扫描,把扫描到的染色结果保存为图像。

A:不同频率-强度纯音组合刺激得到感受野的三组伪彩图;B:与图A对应的刺激后时间直方图;C:Contra和Bi所在频率的发放曲线图;D~E:Bi和Contra的CF和阈上20 dB带宽(BW20)拟合曲线;F~G:△Threshold和△Latency的细胞数柱状分布图
图1 同侧无响应神经元电生理结果


A:不同频率-强度纯音组合刺激得到感受野的三组伪彩图;B:与图(A)对应的刺激后时间直方图;C:Ipsi、Contra和Bi所在频率的发放曲线图;D、F、G:CF位移、△Threshold和△Latency的细胞数柱状分布图;E:Bi和Contra BW20拟合曲线
图2 同侧有响应神经元电生理结果
2 结 果
2.1同侧无声响应神经元的双耳反应特点 图1(A)Ipsi没有TRFs,图中有零散的自发放动作电位数,Contra和Bi有TRFs,对纯音的响应呈V型。图1(B)是与图1(A)对应的PSTH,Ipsi在50 ms给声后没有响应,Contra和Bi在50 ms给声后有PSTH,且发放类型较为一致。图1(C)Contra和Bi的同一个同侧无声响应神经元的重合CF,重合频率为20 kHZ。图1(D)Bi和Contra的CF的拟合曲线参数:r=0.997 1,slope=1.004 4;Contra CF:(21.800 0±9.857 6)kHZ,Bi CF:(21.730 0±9.857 6)kHZ;t=0.141,P=0.89,n=15。Bi和Contra的CF改变差异无统计学意义(P>0.05)。图1(E)15个神经元的Bw20拟合曲线参数:r=0.988 8,slope=0.994 4;Con-tra:(21.413 0±5.142 3)kHZ,Bi:(21.625 0±4.815 6)kHZ;t<-0.45,P=0.735,n=15。Contra和bi的Bw20改变差异无统计学意义(P>0.05)。图1(F)Contra和Bi的△Threshold有13个神经元差值为0 dB,有2个神经元差值为-10 dB,有1个神经元差值为10 dB,而图1(G)的△ Latency的神经元分布有12个神经元差值为0 ms,2个神经元差值为-2 ms,1个神经元差值为-1 ms。

A:全细胞模式下突触后电流曲线;B:由图(A)得到EPSCs和IPSCs的听觉优势度指数-频率关系的趋势图;C:由图3(B)得到各个频率EADI和IADI的比值统计图
图3 同侧有响应神经元的全细胞结果分析
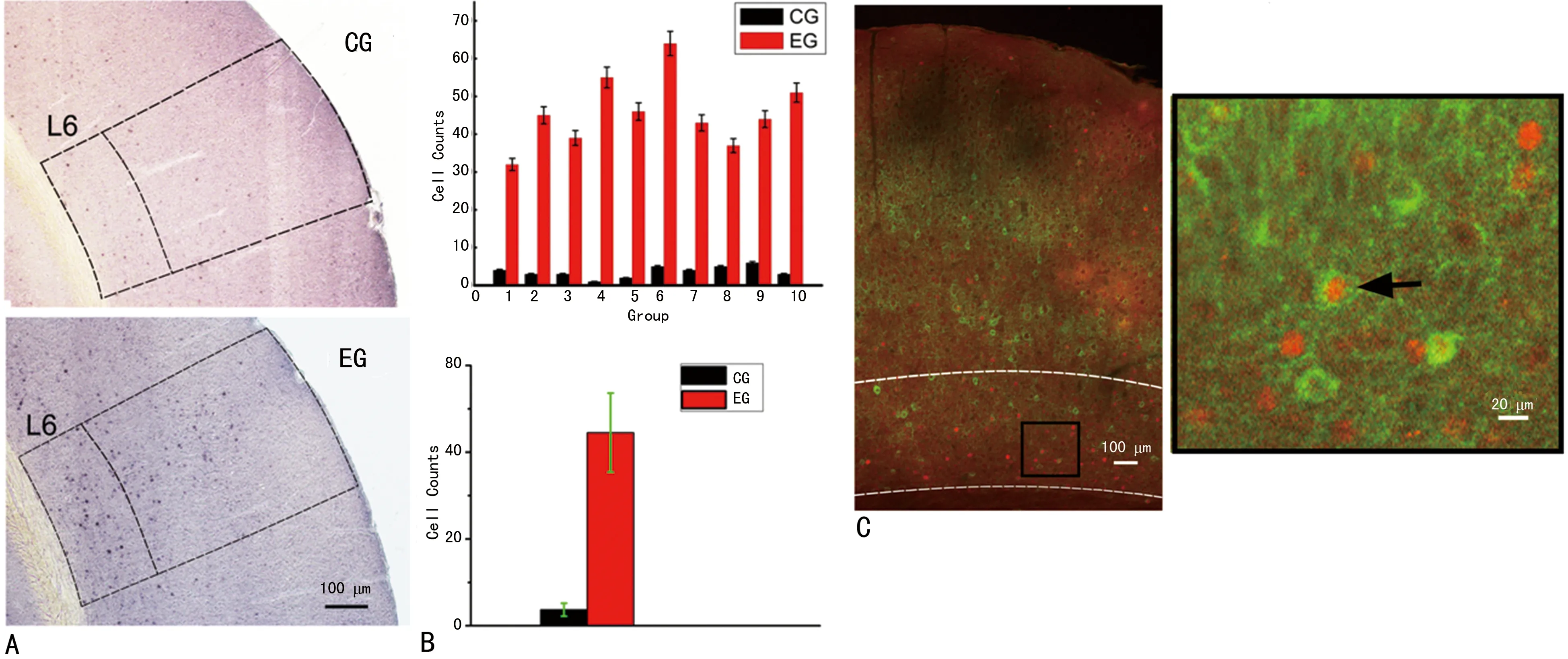
A:c-fos阳性表达脑片图;B:实验组和对照组的柱状统计图;C:左图为双重免疫荧光染色脑片图,右图为局部放大图,黑色箭头所示为c-fos阳性的GABAergic神经元
图4 同侧给声的c-fos蛋白表达结果
2.2同侧有声响应神经元的双耳反应特点 图2(A)Ipsi、Contra和Bi分别有不同TRFs,Ipsi对纯音的反应较弱,CF在高频位置,而Contra和 Bi对纯音响应较强,CF位置在不同的频率,三者反应类型都为V型。图2(B)是与图2(A)对应的PSTH,三者在50 ms给声后都有反应,Contra的动作电位发放数最多,三者发放类型较为一致。图2(C)Ipsi、Contra和Bi的同一个同侧有声响应神经元分别有不同的CF,Ipsi为44 kHZ,Contra为26 kHZ,Bi为39 kHZ。图2(D)13个同侧有声响应神经元中有7个CF有位移,3个CF无变化,3个因为CF在高频位置无法辨认。图2(E)13个同侧有声响应神经元中的Contra和Bi的Bw20拟合曲线参数:r=0.971 2,slope=0.993 7;Contra:(19.615 0±6.252 2)kHZ,Bi:(19.923 0±6.909 7)kHZ;t<-0.47,P=0.647,n=13。Contra和Bi的Bw20改变差异无统计学意义(P>0.05)。图2(F)Contra和Bi的△Threshold有11个神经元差值为0 dB,有1个神经元差值为-10 dB,有1个神经元差值为10 dB,而(G)的△ Latency有11个神经元差值为0 ms,1个神经元差值为-2 ms,1个神经元差值为-1 ms。
2.3同侧有声响应神经元的全细胞反应特点 图3(A)Ipsi、Contra和Bi都有IPSC和EPSC,IPSC的幅度值较弱,Contra和Bi的IPSC和EPSC较强。图3(B)中,CF及其附近(矩形灰框)的IADI值较高,而EADI变化不明显。图3(C)IADI的值为(0.180 0±0.190 0)pA/kHZ,EADI的值为0.095 0±0.940 0 (pA/kHZ)(t=-3.275,P<0.01,n=43),EADI和IADI的变化差异有统计学意义(P<0.05)。
2.4同侧响应的神经元的c-fos变化特点 从图4(A)EG有黑色点密集分布在L5和L6,CG则是零散分布。图(B)中EG和CG的c-fos阳性细胞数计数差异有统计学意义(t=-13.98,P<0.01,n=10)。图4(C)有神经元表达c-fos蛋白(橙红色标记细胞核),也存在GABAergic神经元(黄绿色标记胞体),同时也有大量表达c-fos蛋白的GABAergic神经元(两种颜色均标记)。
3 讨 论
动物在麻醉状态下,听皮层神经元的活动降低,对声音的反应延时、延长[14],在麻醉动物上得到A1 L6双耳整合的结果并不能很好地反映神经元的真实响应。本文在清醒动物上开展对听皮层L6的双耳整合的电生理研究,更能还原小鼠在自然状态下双耳整合的结果。下丘双耳整合研究的机制当中,双耳响应增益值的大小主要依赖赖于ILD[15],当双耳给予相同的声音,Ipsi的输入并不影响Contra的反应特性(图1),特别是CF(图1C),说明同侧无声响应神经元并不影响对侧的CF,因此这类神经元接受的输入可能并不在皮层发生整合,有可能接受下丘或者更低位核团双耳整合后的直接上传的结果。A1 L6部分神经元接受丘脑的直接输入,比其他层有着更短的反应延时,而且反馈投射到丘脑核团,其投射的复杂性取决于该层神经元有着复杂的细胞种类[16],该层除了存在同侧无声响应神经元外,也存在同侧有声响应的神经元(图2),本文结果证实了该层存在同侧声响应的神经元,而且这类神经元能够改变对侧响应的CF(图2C~D),同一神经元Ipsi的输入可能与Contra的输入可能发生皮层内的整合,导致同侧给声后,对侧响应的CF发生偏移(图2C~D)。之前的研究证实,听觉皮层神经元的TRFs受兴奋性和抑制性输入整合的影响,当兴奋或者抑制发生改变,神经元响应的基本特性会发生改变[17-18]。在全细胞记录模式下,更能清楚地看到兴奋性和抑制性输入的变化(图3),本实验同侧和对侧刺激都存在输入的情况下,证实了同一个神经元同时接受同侧和对侧的两种输入(EPSCs和IPSCs),当双耳同时给声时,同侧影响了对侧的抑制性输入(图3C),特别在CF附近抑制作用更强(图3B),这种同侧的干预对对侧响应的CF有修饰加工作用。c-fos基因参与机体众多功能活动的信号转导和调控过程,特别是脑神经功能活动,多种刺激因子,如应激、声光刺激、体感刺激等均可诱导神经系统中c-fos基因的表达。细胞受刺激后,胞核内c-fos基因被激活,转录形成mRNA,后者进入胞质,翻译合成相对分子质量55×103的核酸蛋白,即Fos蛋白。Fos蛋白经磷酸化修饰后返回胞核内与另一家族原癌基因c-jun编码的Jun蛋白形成复合物。Jun与哺乳动物基因转录因子AP-1结构、功能相似,Jun/Ap-1为其表示形式。Fos和Jun/AP-1通过各自的a-螺旋区以光价键结合形成亮氨酸拉链,Fos-Jun/AP-1复合物与目的基因结合,激活目的基因的转录活性。通过上述过程,细胞外的各种刺激信号转化为调节细胞核内基因表达的信号,产生细胞的刺激效应,可作为接受某种特定刺激的神经元激活的标记,是目前较为理想的神经功能活动的定位标记[19]。听觉信息在上橄榄复合体(superior olive complex,SOC)开始交叉传到对侧皮层[20]。双耳同时给声后,实验中发现同侧声输入会影响对侧响应的CF,同侧的声输入没有直接上传到同侧皮层的传导通路,因为声音信息是沿着对侧交叉上传到对侧A1加工处理。由于两侧大脑皮层间通过胼胝体存在大量的互相传导纤维[21],同侧声输入传到对侧皮层后,有可能经胼胝体传到同侧皮层的某一类神经元对对侧CF产生影响。为了观察同侧声输入是否能引起同侧初级皮层神经元的活动,本实验先采用单独Ipsi连续给声90 min的方法,再取材染色,发现同侧A1的L6同侧给声跟同侧不给声的空白对照组(图4A)的c-fos蛋白相比有明显差异(图4B),这就定位到同侧给声后同侧听皮层L6有神经元产生同侧响应,使得神经元产生动作电位发放活动性指标的变化,持续性的动作电位发放能使c-fos基因激活持续表达c-fos蛋白,可以在形态学直观看到同侧给声后神经元响应的位置,证实同侧给声有到同侧皮层的间接通路。双侧同时给声时,同侧声输入使得同侧L6产生有动作电位发放的活性神经元,这类神经元有可能对对侧响应的CF产生调节作用,但不清楚是抑制性中间神经元还是兴奋性椎体神经元对CF产生调节作用。已有文章证实,对侧听觉皮层有纤维投射到同侧L5抑制性中间神经元的通路,这类抑制性神经元能特异性调节椎体神经元的活动[22];L5和L6同是信息输出层,有相似的功能,参与离皮层投射,有大量纤维投射到丘脑和下丘,参与调节椎体神经元的活动[23]。本实验记录到双侧给声后CF的改变是跟抑制性变化相关,然后再行免疫荧光双染实验,发现在L6有大量的抑制性神经元表达c-fos蛋白(图4C),而同侧声输入没有直接上传到同侧皮层的通路,这更加证实了同侧声输入可能经过对侧皮层跨胼胝体到达同侧L6的抑制性神经元调节对侧响应的CF,实验中通过持续给声激活神经元的c-fos基因,抑制性神经元的发放频率较椎体神经元快[24],c-fos蛋白的表达跟神经元的放电率有直接关系,发放率越高,相同时间内细胞受到的刺激越多,c-fos表达就越强,同侧接受相同声音刺激时,抑制性神经元的快放电率特征有调节其他神经元活动的优势,双耳整合后由于抑制性输入发生变化导致CF改变的原因更有可能是因为抑制性神经元的快放电率引起的,抑制性神经元能提供其他神经元抑制性输入,参与抑制性调节。在听觉皮层,存在许多不同种类的抑制性神经元,突触的抑制参与了感受野的形成,加强听觉时间信息的认知和调节增益值[25]。本实验通过双重免疫荧光染色,证实同侧给声激活了大量听皮层L6的GABAergic神经元(图4),而全细胞结果又证明了对侧响应的抑制性输入被同侧输入影响,导致兴奋-抑制平衡失去同步变化趋势,而同侧激活大量的抑制性神经元被认为可能参与调节对侧响应。综上所述,可以推测双耳同时给声时,得出结论:(1)同侧无响应神经元的同侧输入并不影响对侧响应的CF;(2)同侧有响应神经元的同侧输入对对侧响应的CF有修饰加工作用,双耳同时给声时,同侧输入影响对侧的抑制性输入,从而导致双耳响应中对侧CF发生偏移;(3)同侧输入主要激活同侧听皮层L6的抑制性神经元,被激活的抑制性神经元可能参与对侧特性频率的加工和修饰。
