TLR-8在慢性伴鼻息肉中的表达
2019-05-27史文静李重文
柳 笛,史文静,李重文
(1.山西医科大学第二临床医学院临床医学系,太原 030001;2.山西医科大学第二医院西院防保科,太原 030053;3.山西医科大学第二医院西院耳鼻喉科,太原 030053)
慢性鼻-鼻窦炎伴鼻息肉是耳鼻咽喉头颈外科的一种常见病和多发病。它以反复发作和持续性黏膜炎症为主要特征。鼻黏膜作为呼吸道天然免疫的第一道防线,它通过产生自然抗微生物因子和启动炎性反应对微生物做出反应。上皮组织还是产生细胞因子、化学因子和其他炎症因子的重要来源[1],其中Toll样受体(Toll-like receptors,TLRs)在鼻黏膜免疫中的作用越来越受到人们的重视[2-3]。研究表明,TLRs在人鼻黏膜中有表达,并且参与了鼻黏膜的免疫防御,对鼻黏膜抵抗微生物入侵发挥关键作用[4]。
TLR-8(Toll-like receptor 8)作为TLRs 的成员,主要识别单链RNA,参与病毒感染,其活化的信号传导属于经典的Toll样信号通路,可介导MyD88依赖型信号通路,启动NF-κB 途径和应激激酶途径,最终导致炎性反应[5-6]。尽管已有揭示TLRs在慢性鼻-鼻窦炎伴鼻息肉的发生与发展中作用的报道[7],然而少见有关TLR-8在慢性鼻-鼻窦炎伴鼻息肉发病过程中的作用和表达调控机制的报道。本文通过免疫组织化学技术,研究鼻中隔偏曲伴下鼻甲肥大患者下鼻甲鼻黏膜上皮组织和慢性鼻-鼻窦炎伴鼻息肉黏膜上皮组织中TLR8的表达情况,探讨其在人鼻黏膜上皮组织免疫中的作用,揭示慢性鼻-鼻窦炎伴鼻息肉发病机制,现报道如下。
1 资料与方法
1.1一般资料 选取2014年5月至2015年4月山西医科大学第二医院18例鼻中隔偏曲伴下鼻甲肥大患者下鼻甲鼻黏膜上皮组织作为对照组,排除慢性鼻窦炎、过敏性鼻炎性疾病,其中男11例,女7例,平均年龄(31.0±4.8)岁,再选取50例慢性鼻-鼻窦炎伴鼻息肉黏膜上皮组织标本作为鼻息肉组,其中男34例,女16例,平均年龄(44.0±6.7)岁。所采用病例术前经临床症状、体征、内窥镜检查、CT检查及术后病理证实。所有患者排除1周内上呼吸道感染、类固醇药物及抗组胺药物等应用史,标本收集前告知患者并取得患者同意及签署同意书,且本研究方案通过医院伦理委员会批准。
1.2方法
1.2.1主要试剂 小鼠抗人TLR-8多克隆抗体购于启动子生物有限公司。免疫组织化学检测试剂盒与抗体专用稀释液购于武汉博士德生物工程有限公司。DAB显色试剂盒购于福州迈新生物技术开发公司。磷酸盐缓冲液(PBS)与枸橼酸钾缓冲液均购于北京中杉金桥生物技术有限公司。
1.2.2实验方法 本实验采用免疫组织化学方法。钳取鼻息肉组患者息肉头端组织;根据以往文献中相关手术操作方案[8-10],取同时行中鼻甲切除术和鼻中隔偏曲矫正术的患者中鼻甲头端距上缘约5 mm处一约3 mm×3 mm大小黏膜组织作为对照组。取材后固定、包埋。腊块连续4 μm切片后置于47 ℃温水中,选取平整的切片于事先经防脱片处理过的载玻片上摊片、烤片(60~62 ℃) 12~18 h,脱蜡水化后放入3% H2O2,在室温下孵育10 min,然后用蒸馏水和PBS分别洗涤3次,并用0.01 mmol/L枸橼酸盐缓冲液(pH 6.0)于高压锅中进行抗原修复,PBS洗涤3次。除去PBS,于室温下放置25 min后,除去血清加一抗[TLR-8切片加1滴第一抗体 (TLR-8抗体滴度为1∶400),PBS代替一抗作为阴性对照,湿盒中4 ℃过夜]。24 h后加二抗 (PBS冲洗4次,除去PBS,每张切片加1滴生物素标记的第二抗体,室温下孵育30 min,PBS冲洗3次)。加三抗 (除去PBS,每张切片加l滴链霉菌抗生物素-过氧化物酶溶液,室温下孵育30 min,PBS冲洗)。DAB显色后,苏木素复染、脱水、透明、中性树胶封片、镜检。
1.2.3结果判定 应用BI-2000病理图文分析系统进行图像采集。细胞染色强度分为:阴性(-)为不着色,弱阳性(+)为淡黄色,阳性(++)为棕黄色,强阳性(+++)为深棕黄色。
1.2.4平均积分光密度值(AIOD)的测定 每张组织切片于400倍镜下取5个阳性部位,所取部位均不重叠,在测量窗标准相同的前提下,经校正后测量位于阳性目标区域内的积分光密度值,将所测的积分光密度值取均值即为AIOD,其值越大表示炎性反应越强。

2 结 果
2.1免疫组织化学染色结果 TLR-8在鼻中隔偏曲伴下鼻甲肥大患者下鼻甲鼻黏膜上皮组织和慢性鼻-鼻窦炎伴鼻息肉黏膜上皮组织中均有表达。阳性细胞染色后呈淡黄色到深棕黄色分布,主要位于细胞质,细胞膜上也有分布。见图1。
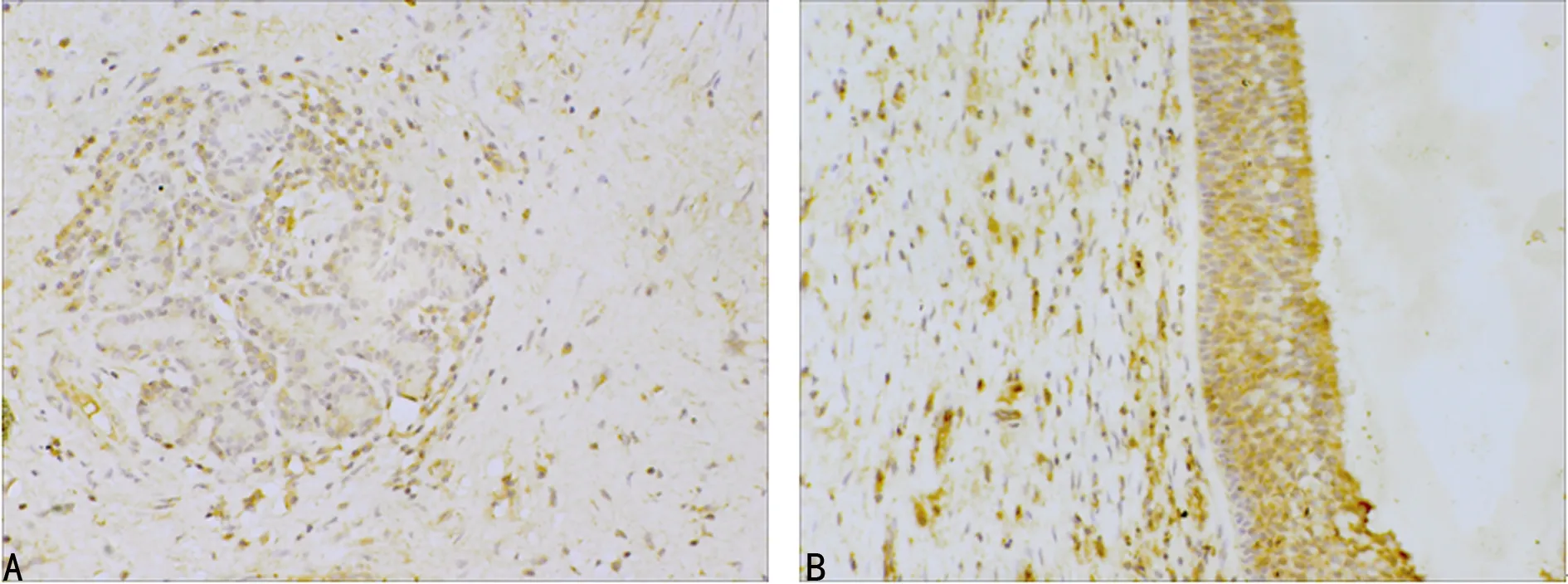
A:对照组;B:鼻息肉组
图1 TLR-8在对照组和鼻息肉组的表达(×200)

表1 TLR-8在鼻息肉组和对照组中的阳性表达率[%(n/n)]
2.2AIOD测定结果 TLR-8在鼻息肉组中的AIOD为0.52±0.06,而其在对照组中为0.30±0.05,鼻息肉组明显高于对照组,差异有统计学意义(P<0.05)。鼻息肉组中TLR-8蛋白的阳性表达率为76.0%(38/50),明显高于对照组的27.8%(5/18),差异有统计学意义(P<0.05)。见表1。
3 讨 论
慢性鼻-鼻窦炎伴鼻息肉具有持续性黏膜炎症的特征,天然免疫和获得性免疫在慢性鼻-鼻窦炎伴鼻息肉发生、发展中起重要作用。天然免疫系统对病原体的识别涉及模式识别受体(PRRs)和病原相关分子模式的相互作用。最广泛具有特征性的跨膜PRRs是TLRs。目前,已经发现TLRs家族包含11种受体,分别对不同种类的配体具有特异识别性[11]。
近年来,TLRs在慢性鼻-鼻窦炎伴鼻息肉发病机制中的作用引起了人们广泛关注。2012年,LAURIELLO等[12]对不同类型鼻炎中TLR-4和TLR-9表达水平的研究发现,人正常鼻黏膜上皮细胞中有TLR-4和TLR-9表达,在变应性鼻炎中其表达显著下降,然而在慢性鼻-鼻窦炎中TLR-4表达显著提高。2013年,夏忠芳等[13]借助免疫组织化学方法检测了儿童慢性鼻-鼻窦炎鼻黏膜组织和正常鼻黏膜组织中TLR-9蛋白的表达和分布,发现TLR-9在实验组和对照组中均有表达,且在慢性鼻-鼻窦炎鼻黏膜组织低表达。MELVIN等[14]发现囊性纤维化病伴慢性鼻窦炎患者中,TLR-9在鼻黏膜上皮细胞中的表达显著高于正常对照组,差异有统计学意义(P<0.05)。另外,TLRs在鼻息肉组织中的表达也引起了人们极大兴趣。2013年,顾兆伟等[15]采用免疫组织化学技术检测了慢性鼻窦炎鼻息肉组织中TLR-2和TLR-4蛋白的表达和分布,同时选取正常筛窦黏膜进行对照。结果表明TLR-2和TLR-4表达水平可能与慢性鼻窦炎鼻息肉的发病机制存在着一定的关联。ZHAO等[16]对正常鼻黏膜和鼻息肉组织中TLR-9蛋白质表达进行了系统的比较,发现感染性因素对鼻息肉发病有重要影响。汪际云等[17]对鼻黏膜中TLR-5表达的研究发现,在所有息肉组织标本中均检测到TLR-5 mRNA和蛋白表达,推测鼻息肉组织中TLR-5表达的增高可能与鼻息肉内持续的炎症状态密切相关。ZHANG等[18]借助基因芯片技术初步发现TLR-7在慢性鼻-鼻窦炎细胞有显著表达。总之,尽管人们对TLRs在慢性鼻-鼻窦炎鼻息肉黏膜上皮组织中的表达进行了大量研究,但对于人鼻黏膜上皮组织中TLR-8的表达鲜有报道。
本研究发现,在慢性鼻-鼻窦炎伴鼻息肉黏膜上皮组织中和鼻中隔偏曲伴下鼻甲肥大患者下鼻甲鼻黏膜上皮组织中均检测到的TLR-8的表达。由于蛋白质是机体生理功能的直接执行者,因此,鼻黏膜上皮有TLR-8蛋白行使功能。
本研究显示,鼻息肉组黏膜上皮组织中TLR-8的AIOD和蛋白的阳性表达率均显著高于对照组下鼻甲鼻黏膜上皮组织。这一结果表明在鼻-鼻窦炎伴鼻息肉炎症过程中,炎症刺激能上调TLR-8在鼻黏膜上皮细胞中的表达,表明TLR-8可能参与了鼻黏膜上皮细胞免疫防御性炎性反应,参与了鼻黏膜的免疫防御。鼻息肉在遭受病原微生物侵害时,参与TLR-8相关的免疫反应对病原微生物的限制和清除能力较强,TLR-8对鼻黏膜抵抗微生物入侵可能发挥关键作用。研究表明,TLR-8可介导MyD88依赖型信号通路[5-6]。因此,结合以往文献可以推测,慢性鼻-鼻窦炎伴鼻息肉的形成可能是TLR-8的信号通过MyD88途径,引起了NF-κB及各种酶(如蛋白激酶,基质金属蛋白酶-9等)的活化,从而引起了嗜酸性粒细胞的活化,形成炎症。同时,嗜酸性粒细胞在鼻黏膜上皮细胞产生的细胞因子和间质细胞中的成纤维细胞的活化下发生了聚集和间质的纤维化的现象,改变了上皮细胞纤毛系统生物电特性,使鼻黏膜组织内环境遭到破坏,水分和离子代谢失衡,使水分进入细胞内和间质中,形成组织水肿,导致鼻息肉发生和发展。因此,若能深入研究TLR-8参与鼻黏膜上皮细胞免疫防御性炎症慢性鼻-鼻窦炎伴鼻息肉反应机制,必将为慢性鼻-鼻窦炎伴鼻息肉的免疫治疗方向提供更系统的理论依据。
综上所述,本研究初步证实了TLR-8在慢性鼻-鼻窦炎伴鼻息肉上皮组织中高表达,其能在慢性鼻-鼻窦炎伴鼻息肉发生、发展中起重要作用。因此,在临床中测定TLR-8的表达,必将有助于慢性鼻-鼻窦炎伴鼻息肉的确诊与治疗。
