-1438A/G基因多态性与进食障碍发病相关性的Meta分析
2019-05-27郑晓娇梁雪梅刘可智
郑晓娇,梁雪梅,向 波,雷 威,陈 晶,刘可智△
(1.西南医科大学精神病学教研室,四川泸州 646000;2.西南医科大学附属医院精神科,四川泸州 646000)
进食障碍(eating disorders,EDS)主要包括3种亚型:神经性厌食(anorexia nervosa,AN)、神经性贪食(bulimia nervosa,BN)以及其他未分型的进食障碍。AN是指对体质量增加的病理性的恐惧,进食限制和低体质量。BN是指在一段时间内无法控制地大量进食[1]。AN和BN的发病率分别为8/10万人/年,13/10万人/年[2];终身患病率分别为0.9%和1.5%[3]。患者通常死于营养不良或自杀。
在EDS致病基因的研究中,5-HT2A受体(the serotonin 2A receptors,5-HT2ARs)启动子基因-1438A/G(rs6311)受到较多关注[4]。5-HT2ARs通过调节在眶额叶皮层和杏仁核之间的连接实现调控认知灵活性的作用[5]。AN患者皮层区域5-HT2ARs的效率较对照组低[6],但在BN患者中并未发现显著区别[7]。CLOOIER等[8]在1997年首次报道了AN患者比健康对照组在-1438位点携带A等位基因的频率更高开始,相关文章陆续发表,然而结论并不一致。因此有必要进行Meta分析,以明确该基因在进食障碍中扮演的角色。
1 资料与方法
1.1文献检索 两名研究者独立检索关于-1438 A/G多态性与进食障碍发病关系的相关文章。检索数据库包括PubMed、Web of Science、中国知识资源总库(CNKI)以及万方数据库。语言限定为使用英文或中文发表的文章。英文数据库检索关键字包括:(“5-hydroxytryptamine 2A receptor” OR “receptor,serotonin,5-HT2A” OR “HTR2A”) AND (“Feeding and Eating disorders” OR “Anorexia Nervosa” OR “Binge-Eating Disorder” OR “Bulimia Nervosa” OR “Feeding and Eating Disorders of Childhood” OR “Female Athlete Triad Syndrome” OR “Pica”) AND polymorphism。中文数据库检索关键词包括:(“5-羟色胺2A受体” OR “5-HT2A受体”)AND(“进食障碍” OR “神经性厌食” OR “神经性贪食” OR “暴食症” OR “儿童期喂养和进食障碍” OR “异食癖”)AND(“基因多态性”)联合检索。检索时间范围限定到2017年11月30日为止。对所有纳入文章的参考文献中提到的相关文章逐一进行人工检索,加以补充。
1.2纳入和排除标准 文献纳入标准包括:(1)采用病例对照研究;(2)评价了-1438A/G基因多态性与进食障碍发病的相关性;(3)病例组和对照组的基因频率在文章中已明确标明;(4)至少对照组被试应当满足哈迪-温伯格平衡法则(Hardy-Weinberg equilibrium,HWE)。排除标准包括:(1)基因频率数据不全;(2)重复发表的数据;(3)Newcastle-Ottawa 文献质量评价量表(NOS)得分6分。
1.3数据提取 对纳入文章数据的提取同样也由两名研究者独立进行,对结果中有争议的由两人讨论后决定。需要提取的信息包括:第一作者的姓名(文章发表年份)、国家、人种、基因分型的方法,病例组和对照组基因频率的数据。若有文章上述信息提供不够详细或全面,研究者采取电子邮件联系相应作者取得相关数据。删除重复发表的数据,当不同文章包含同一被试群体时,采纳发表年份靠后且样本量较大的研究。其中一个研究(ENOCH,1998)报道了来自美国和意大利的两组病例组数据,但是来自意大利的病例组并没有相对照的健康人群,因此删除了该研究中来自意大利的病例组的数据。
1.4统计学处理 采用Reman5.3进行异质性检验、选择效应指标和统计模型。采用OR和95%CI来评价-1438A/G基因多态性和进食障碍的相关性的程度,并用OR[95%CI]表示。各研究之间的异质性采用Q检验和I2检验,异质性显著时采用随机效应模型,反之则用固定效应模型对数据进行合并。采用秩和检验检验合并的ORs的显著性,以P<0.05为差异有统计学意义。文中所有的P值均采用双侧检验。亚组分析是基于疾病亚型和人种差异进行的。由于进食障碍是一种多基因共同参与的复杂疾病,其遗传规律并不明确,因此采用等位基因模型(Avs. G)、显性模型(GA+AAvs.GG)、隐性模型(AAvs. GG+GA)、共显性模型(AAvs. GG)和超显性模型(GG+AAvs. GA)来分别合并OR值。采用逐一排除法进行敏感性分析,以评价研究结果的稳定性。采用漏斗图来评价纳入的文献可能存在的发表偏倚。
2 结 果
2.1纳入研究的主要特征 本文根据《Preferred Reporting Items for Systematic Reviews and Meta-Analyses(PRISMA)》指南[9]进行数据的纳入与分析。 3个数据库共检索到88篇相关的文章,对检索到的文章的所有参考文献进行逐一人工检索,共增加7篇相关文章共同纳入文献筛选。阅读上一步骤纳入的所有文献的题目和摘要后,有34篇明显不相关的文章被排除。在对剩下43篇文章进行全文阅读后,有25篇文章被排除:其中16篇为综述,1篇文章全文是用中、英文以外的语言写作,1篇文章未采取病例对照研究,6篇文章目标基因非-1438基因,剩下1篇文章的研究对象为非进食障碍患者,文献筛选流程见图1。经过质量评价(NOS文献质量评价量表 6分者被剔除),最终有18篇文章纳入Meta分析,包括2 327例病例组和2 703例对照组。提取最终纳入Meta分析的研究中的主要信息见表1。
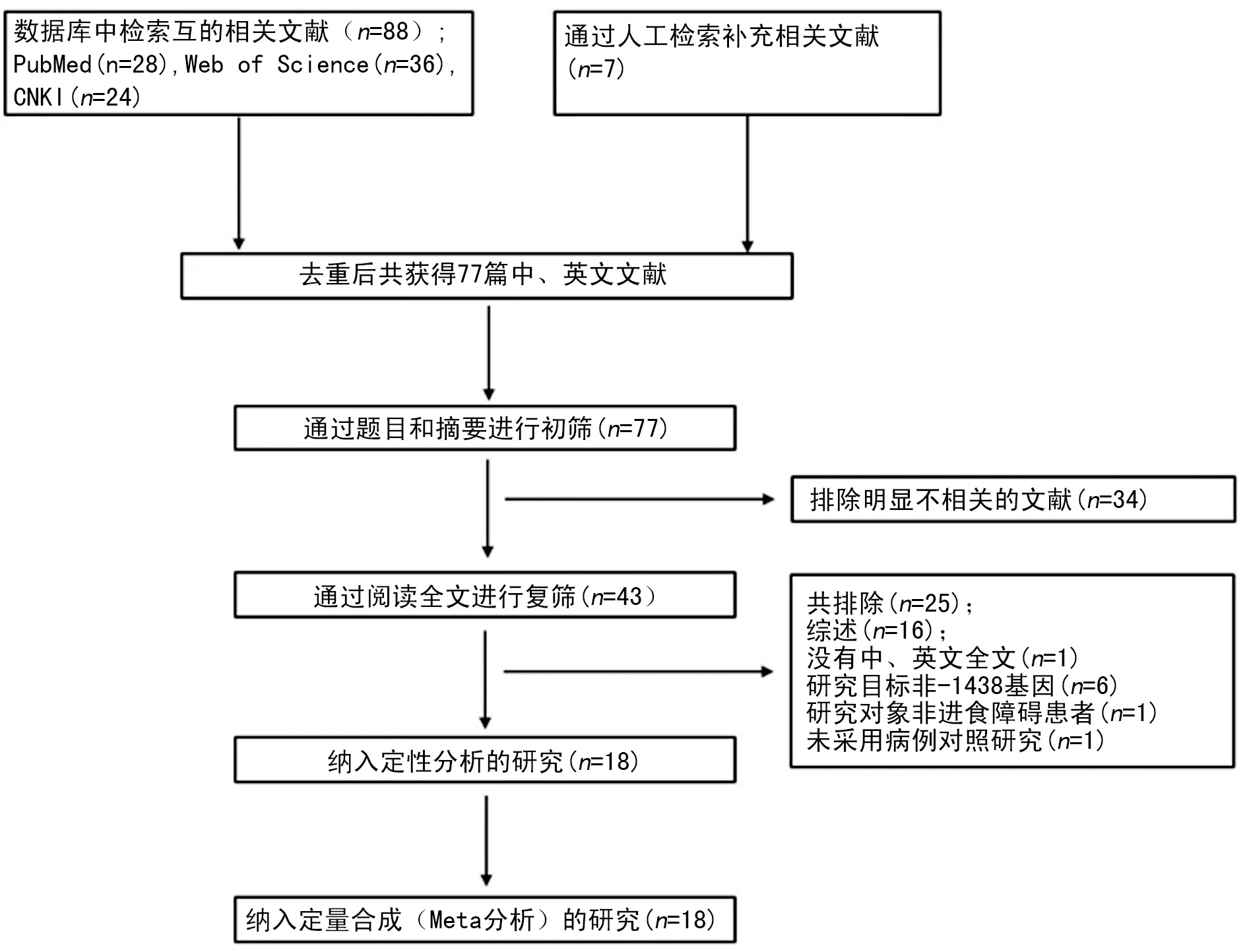
图1 文献筛选流程
2.2总体定量分析 采用等位基因模型进行定量分析发现,18项研究的异质性检验χ2=73.59,自由度为17,P<0.01,I2=77%,异质性显著,故采用随机效应模型。研究结果表明,相较于G等位基因,在-1438位点携带A等位基因将增加罹患进食障碍的风险[OR=1.22,95%CI(1.02,1.45),Z=2.18,P=0.03]。其他基因模型分析结果汇总于表2。

表1 纳入文章的主要特征
a:被试组是否符合哈迪-温伯格平衡法则(Hardy-Weinberg equilibrium,HWE)
2.3亚组分析 根据纳入的文献,进食障碍包括的亚型有AN组和BN组,在疾病亚型之下依据人种不同又进一步分为高加索人和蒙古利亚人两组。在AN组的亚组分析中发现,采用等位基因模型时,I2=75%,χ2=61.14(P<0.01),因此采用随机效应模型进行合并。结果表明-1438A等位基因携带者AN发病风险显著增加[OR=1.26,95%CI(1.05,1.52),Ζ=2.45,P=0.01]。其中,高加索人中-1438 A等位基因的携带者罹患AN的风险显著增加(OR=1.36,P=0.003),但在蒙古利亚人中却未发现二者有显著相关(OR=0.91,P=0.43),见图3。
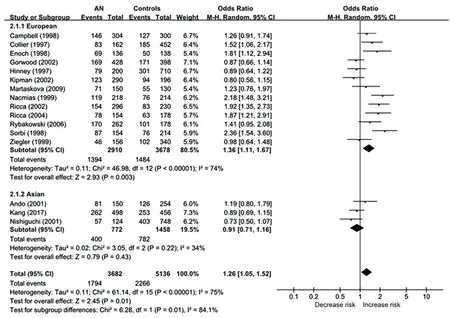
图3 5-HT2ARs -1438 A/G基因多态性与AN发病相关性的森林图(等位基因模型)

图4 5-HT2ARs -1438 A/G基因多态性与BN发病相关性的森林图(等位基因模型)
表2 不同基因模型下疾病亚型和人种的亚组分析

疾病/亚型人种n基因模型OR[95%CI]PaI2(%)异质性模型b进食障碍-18GA+AA vs. GG1.03[0.67,1.58]0.8891RAA vs. GG+GA1.40[1.08,1.81]0.0165RAA vs. GG1.54[1.05,2.24]0.03 77RGG+AA vs. GA1.05[0.94,1.18]0.370F
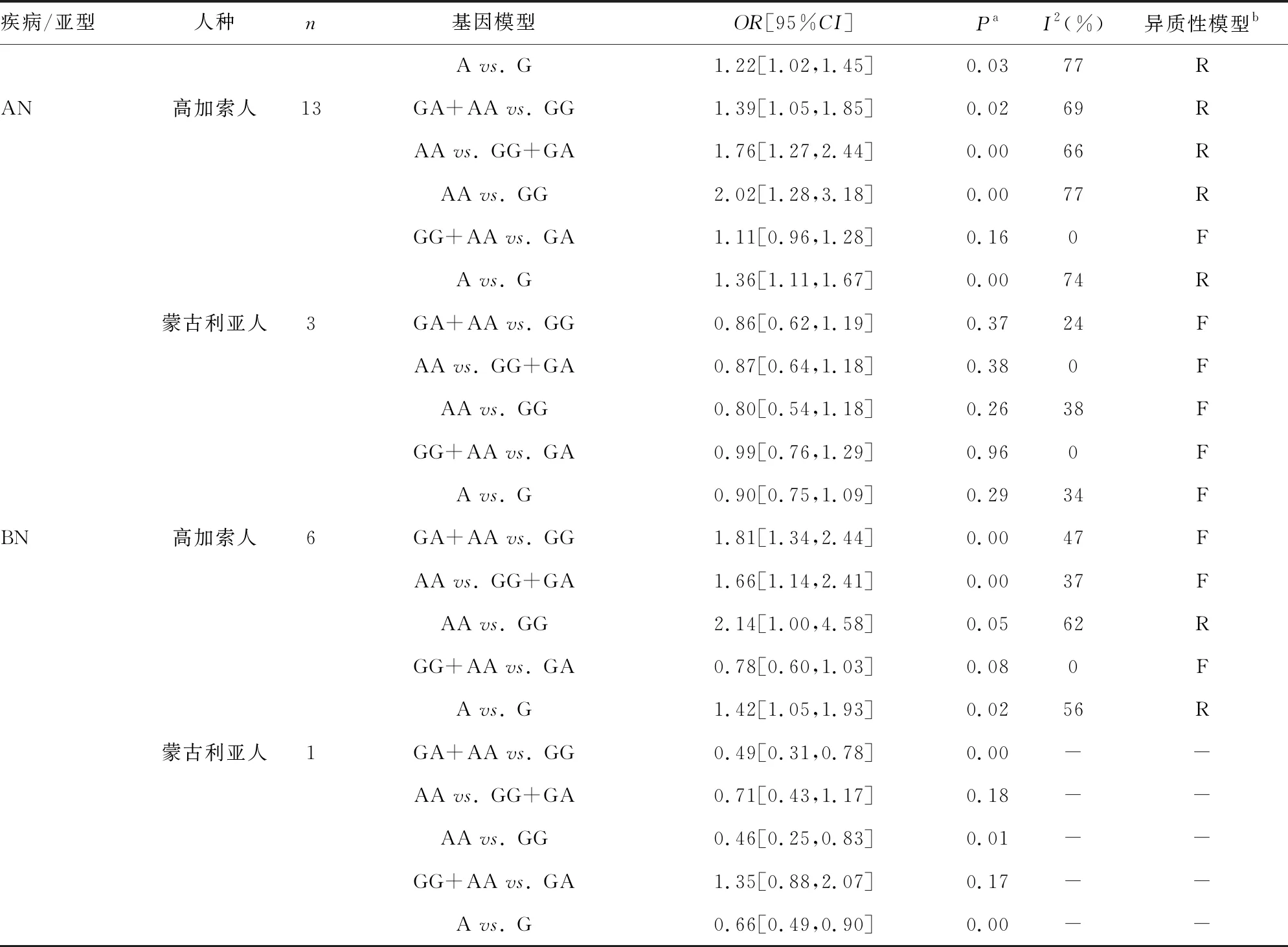
续表2 不同基因模型下疾病亚型和人种的亚组分析
a:OR值的P值。R:随机效应模型;F:固定效应模型
对BN组进行亚组分析,7篇相关文献的异质性系数(I2)为80%,仍采用随机效应模型。结果表明,-1438A基因携带者罹患BN的风险并未显著增加或降低[OR=1.22,95%CI(0.83,1.80),Ζ=1.02,P=0.31]。但将来自蒙古利亚人种的1篇研究排除后发现,高加索人携带-1438A等位基因是罹患BN的风险因素[OR=1.42,95%CI(1.05,1.93),P=0.02],见图4。针对蒙古利亚人种-1438A/G基因多态性与BN发病相关性的病例对照研究仅1篇,无法进行OR值合并,但是该文章提示携带-1438A等位基因并未增加蒙古利亚人BN的发病风险。以上结果全部基于等位基因模型进行分析,其他基因模型分析结果汇总,见表2。
2.4敏感性分析 采用逐一排除各研究的方法进行敏感性分析,重新估计合并效应量,并与排除前的合并效应量进行分析比较。采用任何基因模型进行分析时,本文纳入的任何单个研究的保留与删除并没有对合并后的OR值产生决定性的影响。这说明本文结果较为稳定,并没有受到单一研究结果的影响。
2.5发表偏倚 采用漏斗图以评价纳入文献的发表偏倚,纳入的所有文献并无明显发表偏倚,见图5。
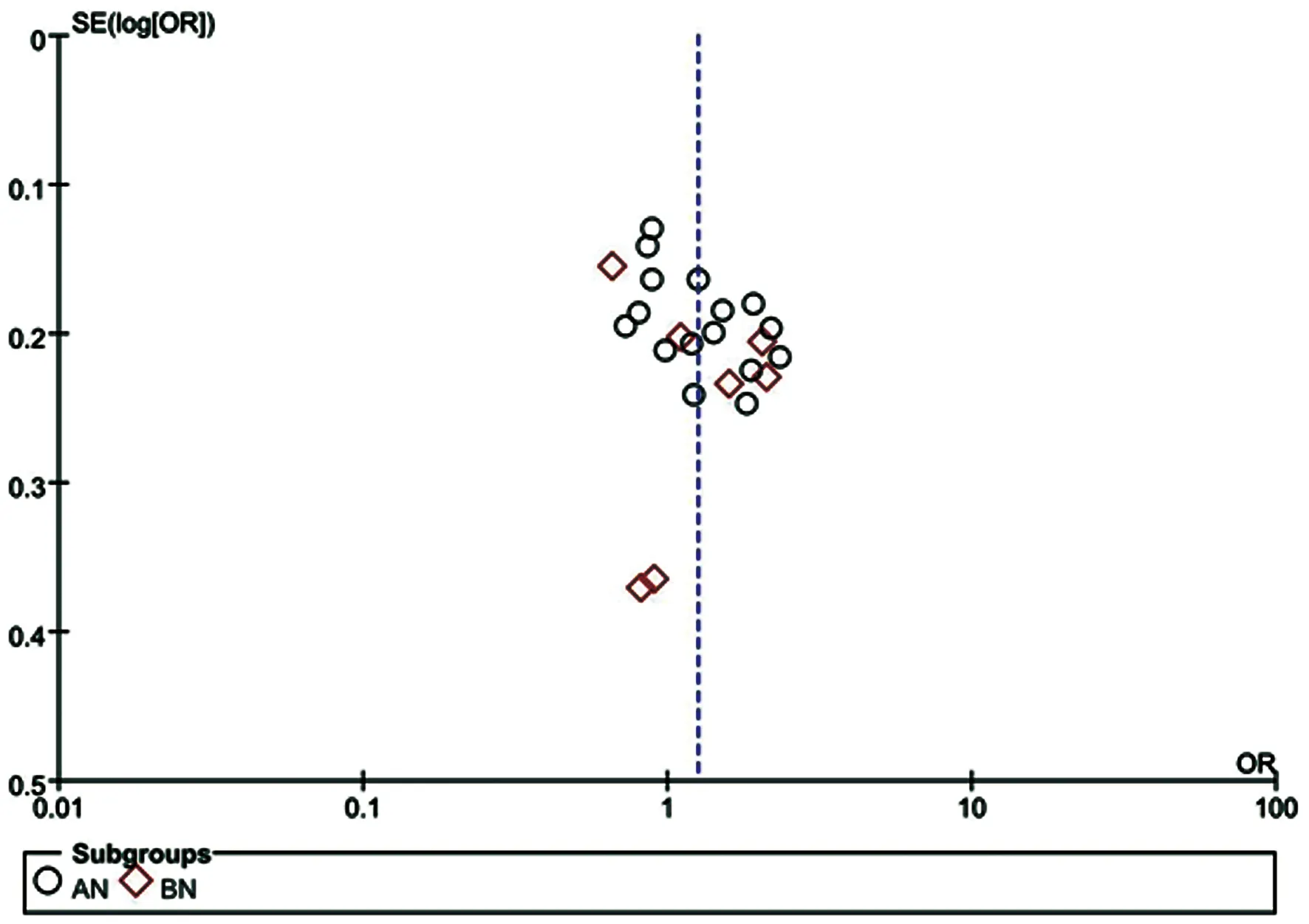
图5 纳入文章发表偏倚漏斗图
3 讨 论
目前的观点认为进食障碍是一组多种病因导致的复杂疾病。介于5-羟色胺在食欲控制中发挥的重要作用,过去的20年间,研究者们对5-HT相关基因进行了较为深入的研究。总的来说,5-HT2ARs -1438位点上携带 A等位基因是进食障碍发病的风险因素。在根据疾病类型进行分组后发现,该基因增加了AN的患病风险,但却与BN发病无显著相关。更重要的是,在疾病分型的基础上对不同人种进一步进行亚组分析发现,该等位基因显著增加了高加索人种罹患AN和BN的发病风险,但没有增加蒙古利亚人种罹患AN的风险。
1999年发表的一篇Meta分析[15],纳入了6篇文章,结果显示-1438 A等位基因病与AN发病无相关,OR值为1.31[0.99,1.73]。2003年,GORWOOD等[27]纳入9篇文章进行Meta分析,OR值为1.20[1.07,1.35],因此结论是该基因是AN发病的风险因素。之所以结论有所出入,是因为后者纳入了3项前者未纳入的研究,其中一项来自亚洲[17]。遗憾的是,后者仍然并没有对人种差异进行亚组分析。最近的一篇相关Meta分析同样也只评价了AN与-1438 A/G多态性的相关性,并没有纳入BN的相关研究。相较于2003年的Meta分析,他们增加了两组斯拉夫人种的研究[24-25],但结论与GORWOOD等的研究一致。同样该研究也没有对亚洲人种进行单独分析,因此也并没有反映出欧亚人种之间的差异性。据本研究检索到的所有文献,目前为止还没发表过关于-1438 A/G基因多态性与BN发病风险的相关性的Meta分析。
本研究首次发现欧亚人种在进食障碍与-1438A/G 基因多态性的相关性方面的差异。那么,由于致病基因的差异,选择性5-HT再摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs)等目前用于该病治疗的主要药物的疗效在不同人种中是否有差异?有Meta分析表明SSRIs并不能达到使AN患者体质量增加的治疗目的[28]。原因之一可能是进食障碍是多基因共同作用的,单一基因的研究并不能解释疗效。但该文只纳入了高加索人种的被试,有关蒙古利亚人种的Meta分析由于缺乏病例对照研究至今未见发表。因此,需要更多高质量的针对亚洲人种的病例对照研究去关注进食障碍的发病基因和疗效评价。
然而,本文仍存在一些不足之处。(1)纳入的研究的异质性较高,这可能是由于地域的差异,因此本研究采用亚组分析来解决异质性较高的问题。(2)除了列出的信息外,缺少其他的原始数据来评价基因与环境之间的相互作用,在目前生物-社会-心理的医疗模式背景下,无法完全解释发病的全部原因。(3)纳入文献的发表偏倚仍可能存在。鉴于欧亚人种在进食障碍致病基因中的差异,亚洲人种的相关研究应当受到更多关注。
