慢性应激所致焦虑/抑郁状态对哮喘小鼠气道炎性反应的影响
2019-05-27王丽娇李国平史雅旭杨小琼
王丽娇,李国平,戴 曦,史雅旭,伍 娟,杨小琼△
(1.西南医科大学附属医院呼吸内一科,四川泸州 646000;2.四川省眉山市人民医院呼吸内科 620010;3.四川省成都市第三人民医院/西南交通大学附属医院呼吸内科 610000;4.澳门科技大学中药质量研究国家重点实验室/澳门药物与健康应用研究院 999078;5.四川省第二中医医院呼吸内科,成都 610000)
支气管哮喘(简称哮喘)是由多种细胞及细胞组分参与的气道慢性炎症性疾病。据统计,全世界约有2.35亿哮喘患者,每年约有18万人因哮喘死亡。其逐渐升高的发病率以及严重影响患者生活质量和肺功能的疾病状态带来了极大的社会、经济负担。城市社区的哮喘负担最为严重,特别是存在有典型环境暴露、缺乏医疗资源的低收入国家[1]。哮喘除了典型的气流受限症状外,常合并肥胖、胃食管反流性疾病、焦虑症和抑郁症、过敏性疾病等。根据研究报道,焦虑症和抑郁症在哮喘患者中已较为普遍。
既往研究认为精神应激与类风湿性关节炎、心血管疾病、加速生物老化和过早死亡都有一定关系[2]。焦虑和抑郁与难治性哮喘、药物依赖以及哮喘相关生活质量恶化关系密切[3],在很大程度上增加了哮喘患者急性加重的风险和急诊就医的频率。目前国内外针对哮喘合并焦虑/抑郁的相关研究认为可以从认知行为、心理教育和生物反馈等方向进行心理干预治疗,但研究结果具有较大争议。因此,本研究通过建立经典小鼠哮喘模型探讨慢性应激导致的焦虑/抑郁状态对哮喘的影响,同时,选择性5-羟色胺(5-HT)再摄取抑制剂帕罗西汀(Paroxetine)在本实验中被用于治疗慢性应激所致的焦虑/抑郁状态,以评估抗焦虑/抑郁治疗对合并焦虑/抑郁状态的哮喘小鼠的治疗效果。
1 材料与方法
1.1实验动物 8~10周龄SPF级健康雌性C57BL小鼠购自重庆腾鑫生物有限公司,实验前用糖水偏好测试筛选出30只符合实验要求的小鼠(具体方法见糖水偏好测试)。将30只小鼠分为6组(n=5)并饲养于本校实验动物中心SPF级动物房,每组饲养环境均一致,即光照节律12 h∶12 h(光照时间7:00~19:00),室温维持(23±3)℃、相对湿度50%~60%。所有小鼠均在安静状态下饲养,可自由进食及饮水。
1.2仪器与试剂 Buxco小动物全身体积描记检测系统(Buxco,美国);DM4000 Leica 光学显微镜(Leica,德国);Allegra X-22R 低温离心机(Beckman Coulter,美国);电子天平(良平电子天平FA1004,上海);海尔4 ℃冰箱等。鸡卵清蛋白(Ovalbumin,北京Solarbio科技有限公司,A8040);氢氧化铝[Al2(OH)3,成都科龙化工试剂厂];乙酰-β-甲基氯化胆碱(美国Sigma公司);蔗糖(天津致远化学试剂有限公司);苏木素-伊红染液(HE,北京化学试剂公司);1×PBS;4%多聚甲醛。
1.3方法
1.3.1实验分组 将小鼠分为对照组(CTRL组)、哮喘组(OVA组)、应激组(CTRL/R组)、哮喘应激组(OVA/R组)、帕罗西汀组(CTRL/R+P组)、哮喘+帕罗西汀组(OVA/R+P组)。
1.3.2哮喘模型制备 OVA、OVA/R、OVA/R+P组小鼠在第0、7、14天分别腹腔内注射0.2 mL致敏液[100 μg/mL OVA与10 mg/mL Al2(OH)3的混悬液],CTRL组和CTRL/R组予以等体积1×PBS腹腔注射。第21~27天,CTRL/R、OVA/R、CTRL/R+P组和OVA/R+P组小鼠同时每天给予持续束缚应激,并且在束缚应激后以1%的戊巴比妥按50 mg/kg下肢肌肉注射麻醉OVA、OVA/R组和OVA/R+P组小鼠,分别将50 μL激发液(2 mg/mL OVA-PBS溶液)以微泵注射器经鼻缓慢滴入,其余组给予等量1×PBS处理(图1)。
1.3.3慢性束缚应激模型 将小鼠置于实验环境适应48 h,维持12 h光照和12 h黑暗的昼夜节律,小鼠可自由饮水、进食。在第21天称量小鼠束缚前体质量。第21~27天,CTRL/R+P、OVA/R+P组小鼠在束缚前30 min按照10 mg/kg体质量予以帕罗西汀溶液(1 mg/mL)腹腔注射,然后将 CTRL/R、CTRL/R+P、OVA/R、OVA/R+P组小鼠置于50 mL锥形离心管中限制其身体自由移动,离心管管壁开密集通风口保持良好通气,离心管置于镂空的饲养架上,试验中远离食物及水,避免各种噪音,以控制实验干预因素以外的应激因素,每天8:00~15:00束缚2 h。对照组同时禁食、禁水。束缚2 h后将各组小鼠放回笼中自由进食、饮水。

图1 动物模型制备操作流程
1.3.4糖水偏好测试 糖水偏好测试分为适应期和测试期。适应期内,将小鼠分别放在独立的笼子中,同时给小鼠1瓶纯水和1瓶2%的蔗糖水,为避免位置偏好,每隔24 h交换两瓶水的位置,连续适应3 d。适应期结束后所得的糖水偏好指数用于筛选小鼠,以确保每只小鼠对糖水的偏好基本正常,低于65%的小鼠不纳入实验。造模第26天小鼠自由进食饮水后移除所有笼子的水,禁水17 h后(需束缚的小鼠在第26天禁水15 h后开始束缚2 h,束缚后放回笼子)再同时给予小鼠1瓶2%蔗糖水,1 瓶纯水,测试24 h,每隔12小时将两瓶水的位置互换。结束后计算糖水偏好指数,并称量束缚后体质量。糖水偏好指数=糖水消耗(g)/总液体消耗(糖水+纯水)×100%。
1.3.5气道反应检测 用1×PBS将乙酰-β-甲基氯化胆碱配制成浓度梯度为6.25、12.5、25、50 mg/mL的溶液,分别对小鼠进行气道雾化,雾化同时用Buxco小动物体积描记测试系统测试并记录每只小鼠从雾化到反应结束期间的Penh值。每组小鼠测试开始时均适应5 min,每种浓度分别雾化1 min,反应2 min,恢复1 min。
Penh气道缩窄指数=呼气峰压力(PEP)/吸气峰压力(PIP)×呼气间歇(Pause),其中Pause=(呼气相时间-呼气相松弛时间)/呼气相松弛时间。Te表示呼气相时间;Tr表示呼气相松弛时间。
1.3.6标本收集 (1) 肾上腺湿重与体质量测量:第28天处死实验小鼠,测量小鼠体质量后手术分离双侧肾上腺并称量湿重,计算得出肾上腺/体质量(mg/g)。(2) 肺泡灌洗及细胞分类计数:暴露气管,结扎气管近端,将1 mL在4 ℃冰箱中提前预冷的生理盐水缓慢注入气管并反复抽吸3次,收集总的肺泡灌洗液,1 500 r/min 4 ℃低温离心10 min,将离心后的细胞沉淀用1 mL PBS重悬,取10 μL用于细胞计数。剩余的细胞悬液再次离心,留50 μL上清液重悬细胞,制作细胞涂片。HE染色后用显微镜计数200个白细胞并进行分类。(3)肺组织HE和PAS染色:将未行肺泡灌洗的小鼠左肺用4%多聚甲醛固定后送病理科行HE及PAS染色,镜下观察并行肺组织炎症评分和中型气道PAS阳性细胞丰度评分。

2 结 果
2.1慢性应激导致小鼠体质量降低,糖水的摄取减少和肾上腺/体质量比值显著升高 应用了慢性束缚应激成功构建了焦虑/抑郁小鼠模型,小鼠在应激后出现对糖水的兴趣缺失,体质量不增反降等表现,且抑郁状态小鼠糖水偏好指数明显下降。在给予帕罗西汀治疗后,小鼠的体质量下降以及糖水偏好变化有所改善,肾上腺/体质量比值下降。同时,结果显示OVA/R组小鼠实验前后体质量变化和糖水偏好指数变化较OVA组小鼠和CTRL/R组小鼠更为明显,并且肾上腺/体质量比值最高,验证了动物模型的成功构建(图2、图3A)。
2.2焦虑/抑郁状态导致哮喘模型小鼠气道高反应加重 本实验采用小动物体积描记仪完成小鼠支气管激发试验,动态观察并记录小鼠吸入支气管激发剂乙酰胆碱后的气道反应性。OVA/R组小鼠较OVA组小鼠在吸入乙酰胆碱后气道高反应更为严重,但给予了帕罗西汀的OVA/R+P组小鼠气道高反应较OVA/R组小鼠有所缓解(图3B)。

A:小鼠束缚前后体质量,*:P<0.05,#:P>0.05;B:小鼠束缚前后糖水偏好指数,*:P<0.05,#:P>0.05
图2 应激对小鼠体质量和糖水偏好指数的影响
2.3焦虑/抑郁状态导致哮喘模型小鼠气道炎症加重和炎症细胞浸润增加 本研究通过对小鼠肺组织病理切片作HE染色后可见OVA组小鼠肺组织气道、气道旁、血管旁及肺泡内有大量炎症细胞渗出,部分区域肺泡间隔明显增宽,而OVA/R组小鼠上述表现更为明显。按炎症评分标准(表1)评分可知,OVA/R组小鼠肺组织炎症较OVA组严重(图4)。
通过肺泡灌洗液中炎症细胞计数和炎症细胞分类分析发现,OVA/R组小鼠肺泡灌洗液中炎症细胞显著增多,以嗜酸性粒细胞和中性粒细胞增加较为明显(图5)。值得注意的是,使用了抗抑郁药的OVA/R+P组小鼠与OVA/R组小鼠比较,其气道炎症评分以及肺泡灌洗液中炎症细胞计数均降低。

A:小鼠肾上腺/体质量比,*:P<0.05,#:P>0.05;B:小鼠气道反应Penh值
图3 小鼠肾上腺/体质量质量比与气道反应Penh值
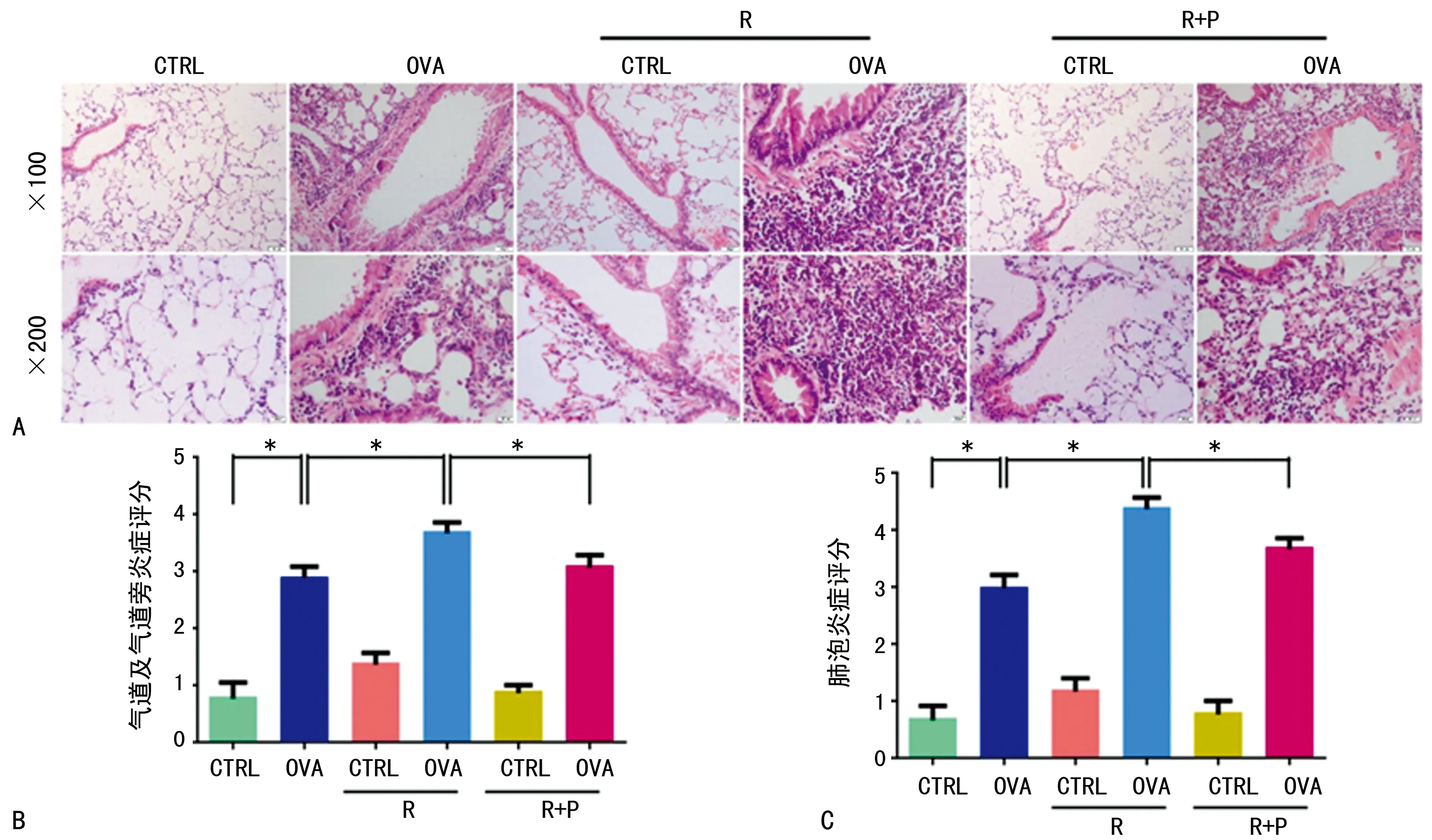
A:肺组织切片HE染色;B:气道及气道旁炎症评分,*:P<0.05;C:肺泡炎症评分,*:P<0.05
图4 肺组织HE染色及炎症评分
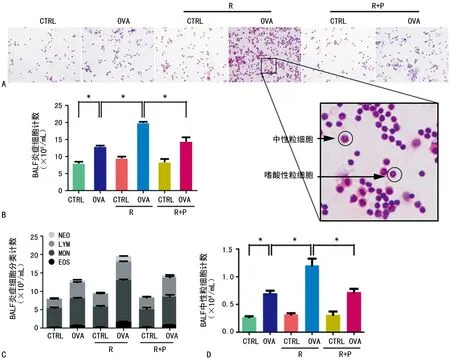
A:肺泡灌洗液细胞涂片HE染色;B:BALF炎症细胞计数;C:BALF炎症细胞分类计数,*:P<0.05;D:BALF中性粒细胞计数,*:P<0.05
图5 BALF细胞分类计数
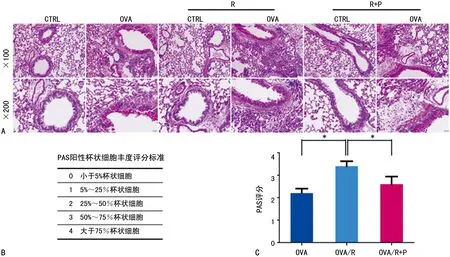
A:气道杯状细胞PAS染色;B:PAS阳性杯状细胞丰度评分标准;C:PAS评分,*:P<0.05

图6 气道PAS染色及杯状细胞丰度评分
2.4焦虑/抑郁状态促进哮喘小鼠气道上皮杯状细胞增生和黏液高分泌 本研究在对小鼠肺组织进行PAS染色观察气道上皮杯状细胞增生情况的发现,OVA/R组小鼠PAS评分较OVA组小鼠明显增加,帕罗西汀治疗后的OVA/R+P组小鼠PAS评分则较OVA/R组小鼠有所降低(图6)。
3 讨 论
哮喘是一种以慢性气道炎症为特征的异质性疾病。它常伴有随着时间和强度变化的呼吸道症状,如喘息、呼吸急促、胸闷和咳嗽及可变的呼气气流受限。据世界卫生组织报道,全世界大约有2.35亿哮喘患者,约占总人口的4.3%,其中亚洲患者约占总人口的2.9%,据估计,在未来十年里全球哮喘患病人数将增加一亿人,超过80%的哮喘死亡病例发生在低收入和中下收入国家,仅2015年全球就有33.8万人死于哮喘[4]。心理精神障碍中的焦虑症和抑郁症是哮喘患者的常见并发症,既往曾用“心因哮喘”来描述因心理和情绪因素而加重疾病严重程度的哮喘病例。哮喘患者比普通人更易患焦虑症和抑郁症,与此同时,如果早期(如青少年期)受到心理精神问题的困扰,则成年后哮喘发作的风险将显著增加[5]。
炎症通常被认为是机体对物理损伤和感染的主要反应,心理应激可以提高免疫系统中参与炎性反应的成分,从而使炎症成为与多种疾病状态相联系的一种潜在共同途径。有研究报道,应激不仅可引起血浆炎症标志物的增加,还可增强哮喘患者对致敏源的反应,有20%~35%的哮喘患者在应激期间出现病情加重。虽然有研究报道称急性应激通过激活HPA轴升高内源性皮质激素水平,从而降低气道FeNO水平。但慢性或者长期持续的应激可导致HPA轴对应激的适应,出现糖皮质激素受体表达下调,下丘脑和垂体分泌促皮质激素释放因子和促肾上腺皮质激素的负反馈消失,皮质类固醇反应的减弱。此外,连续7 d的应激(长期应激)表现出与糖皮质激素反应无关的炎细胞数量增加。而促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)敲除的小鼠也表现出气道炎性反应的增强和杯状细胞的增生[6-7]。说明慢性应激可使炎性反应对糖皮质激素抵抗,导致促皮质激素释放因子负反馈的消失,由此可促进炎性反应。这或许能解释为何伴有焦虑/抑郁的哮喘患者对激素治疗不敏感。
慢性应激能引起HPA轴的激活,导致相应腺体增生,通过减弱皮质类固醇反应加重气道炎性反应。实验中发现应激导致小鼠肾上腺增生,肾上腺与体质量之比也较非应激小鼠增高,同时加重了哮喘小鼠气道对乙酰胆碱的反应,表现出明显的气道高反应性。而且,无论是BALF炎细胞的分类计数,肺组织HE染色炎症评分还是气道PAS阳性杯状细胞丰度评分均表明应激可加重肺组织炎症细胞的浸润,促进气道杯状细胞增生和黏液高分泌。与既往研究报道的早期应激可加重成年小鼠气道炎性反应和气道高反应一致[8]。
据报道,应激产生的激素可通过多种途径调节免疫反应,如糖皮质激素和儿茶酚胺通过抑制抗原提呈细胞和Th1细胞的产生,同时上调Th2细胞因子的分泌介导Th2转化,而哮喘正是一个以Th2细胞因子(IL-4、IL-5、IL-13)产生为主的炎性反应,能促进嗜酸性粒细胞在气道炎症部位和外周血中的聚集[9]。实验发现哮喘小鼠BALF分类计数中除嗜酸性粒细胞升高以外还伴随中性粒细胞的增多,且哮喘应激小鼠这两种细胞增多更显著,其机制尚不清楚。已知IL-17是由Th17细胞、中性粒细胞、巨噬细胞等细胞分泌的细胞因子,是重症哮喘的独立危险因素。近年来发现高水平的IL-17(尤其是IL-17A和IL-17F)与中性粒细胞在肺组织的过度聚集、气道高反应、气道重塑有关。IL-17A还能增加乙酰胆碱引起的气道平滑肌收缩,并诱导气道平滑肌的迁移[10-11]。在致敏阶段,肺源性Th17细胞不仅增强了中性粒细胞气道炎症,还增强了Th2细胞介导的嗜酸性气道炎症。并且MCKINLEY等[13]发现,Th17细胞介导的气道炎症和气道高反应在小鼠体内表现出激素抵抗性,提示Th17细胞在激素抵抗哮喘中的潜在作用[12-13]。笔者猜想,应激或许能促进Th17细胞分泌IL-17,从而诱导哮喘应激小鼠中性粒细胞升高,这有待进一步的研究证实。
5-HT是一种主要在胃肠道和中枢神经系统合成的单胺类神经递质,除了对胃肠道和神经系统的影响外,非神经元性5-HT还调节包括炎症在内的其他生理过程。帕罗西汀是近年来应用较多的5-HT再摄取拮抗剂,它通过阻碍突触前神经元表面的5-HT转运体的表达来抑制5-HT再摄取,在治疗焦虑症和抑郁症方面疗效显著。研究发现,中枢和外周组织中促炎因子(IL-6和TNF-α)水平的升高促进了抑郁症的发展,而帕罗西汀能促进巨噬细胞产生TNF-α同时抑制IL-6的生成,并且在神经元和非神经元细胞中均具有抗炎作用。此外,帕罗西汀能减轻T淋巴细胞的活化,减少该细胞向胶原诱导性关节炎关节的浸润[14]。正常情况下,肺泡灌洗液以单核巨噬细胞和淋巴细胞为主。在实验中,经帕罗西汀治疗后小鼠的气道反应与哮喘应激小鼠相比明显减轻,且嗜酸性粒细胞和中性粒细胞数量较哮喘应激小鼠下降,单核细胞和淋巴细胞数量有所升高,但仍较对照组减少。有研究发现,束缚应激小鼠气道炎症的增加与Th2细胞因子水平升高有关,并证明了中枢神经系统的μ-阿片受体(μ-opioid receptor,MOR)参与应激性哮喘的发作。MOR也在炎细胞中表达,包括T细胞、B细胞、单核巨噬细胞、多核白细胞和树突状细胞,淋巴细胞表面的MOR的激活能诱导Th2细胞分化及Th1细胞向Th2细胞的转化。慢性心理应激可通过激活MOR刺激HPA轴和交感-肾上腺髓质系统(SAM)分别释放皮质醇和儿茶酚胺,从而加重过敏性气道炎症[15-16]。由此猜测帕罗西汀或许能通过抑制淋巴细胞和单核细胞表面MOR的表达从而减轻哮喘应激小鼠气道炎症,具体机制有待进一步研究。
