基于GA优化的MIV-BP神经网络连续血压无创监测方法研究
2019-05-27张亚丹
谭 霞,季 忠,2,张亚丹
(1.重庆大学 生物工程学院,重庆 400044;2.重庆市医疗电子工程技术中心,重庆 400044)
血压是人体重要的生命体征之一,能直观反映出人体心脑血管的功能状况,是临床上诊断疾病、观察疗效和预后判断的重要依据。人体血压受诸多因素如情绪、生理周期、身体状况和外在环境等的影响,单次或间断测量的结果存在较大差别,而连续测量可监测每个心动周期的血压,因此其在临床和医学研究中具有极为重要的意义。
现有的无创连续血压测量方法主要有动脉张力法、容积补偿法、脉搏波传导时间法和脉搏波特征参数法,其中动脉张力法[1]测量血压时需长时间保持压力传感器的精确定位,同时于传感器上施加一个大小合适且持续可调的下压力,由于测量的不便以及长时间压迫动脉给被测者带来极强的不适感,从而阻碍了动脉张力法的发展[2];容积补偿法测量血压,其预置参考压力的设置是一大难点,对被测者的持续施压使静脉充血,给被测者带来痛苦,同时测量的血压值离散性较大[3];脉搏波传导时间(Pulse Wave Transit Time,PWTT)法测量血压对传感器定位要求较低,不适感较少,PWTT与血压存在一定的相关性,其中与收缩压(Systolic Blood Pressure,SBP)的相关性较强,因而所建立的基于PWTT的收缩压模型的预测精度较高,而与舒张压(Diastolic Blood Pressure,DBP)的相关性较低,因此预测舒张压值时误差较大[4-5];脉搏波特征参数(Pulse Wave Parameter,PWPs)能较好地反映血压变化与脉搏波之间的关系,利用PWPs法测量血压时操作方便且测量装置简单,因此诸多学者[6-9]引入PWPs对脉搏波和血压的相关性进行探究,进而进行血压测量,由于个体差异性,模型的测量精度还有待提高。
现有的关于PWTT法或PWPs法的血压测量大都采用统计分析的方法,先粗选出PWPs(其中不同学者粗选的PWPs不尽相同),然后选取PWTT或与血压相关性较好的PWPs,建立与血压的回归模型从而实现血压的测量。但是,只有在血管弹性保持不变的情况下,血压的变化才与PWTT成正比[10];脉搏波波形变化不仅受血压影响还受血液黏性和管壁弹性等因素的影响[11],因此PWTT或PWPs与血压值之间不仅是简单的线性关系,还具有非线性关系。而现有基于PWTT法或PWPs法所建立的线性回归模型难以描述PWTT或PWPs与血压之间复杂的非线性函数关系,导致模型的普适性差且不能很好地克服个体差异。针对上述基于PWTT法或PWPs法的血压测量模型存在的不足,本文提出一种基于PWTT和PWPs相结合的连续血压无创测量模型——GA-MIV-BP神经网络模型。本文在总结和分析前人经验的基础上,粗选了PWTT和时间及幅度类共16个PWPs,尽可能涵盖更多的参数,利用平均影响值[12](Mean Impact Value,MIV)分别从提取的PWTT和PWPs中优选出对收缩压值和舒张压值影响较大的参数作为输入量,以血压计测量得到的收缩压值或舒张压值为相应的输出量,训练得到MIV-BP神经网络收缩压模型和MIV-BP神经网络舒张压模型;由于人体各项生理参数对血压值均有影响,而PWTT和PWPs能反映血压的变化,并且每个个体的血压值与相应的PWPs和PWTT之间的函数关系是不同的,因此本文采用遗传算法[13](Genetic Algorithm,GA)对模型的个性化参数进行优化,从而得到单个个体的连续血压无创测量模型—GA-MIV-BP神经网络收缩压模型和GA-MIV-BP神经网络舒张压模型。
1 实验数据采集与处理
1.1 实验数据采集
根据脉搏波信号和心电信号的特点,实验基于计算机平台,组合使用桡动脉脉搏传感器(HK-2000B型传感器,合肥华科电子技术研究所),心电电极和心电检测导联线,以及数据采集卡(USB-D1280型,上海聚星仪器)来实现脉搏波和心电信号的同步采集,其中脉搏波和心电信号的采样频率都设置为400 Hz,系统结构框图如图1所示。
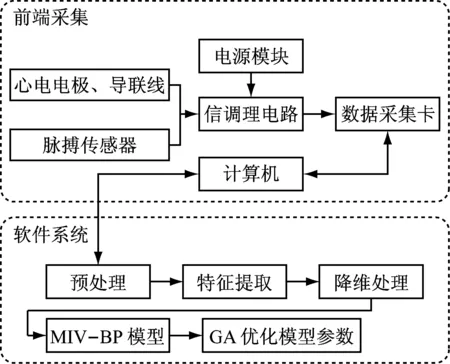
图1 系统结构框图Fig.1 Diagram of the system structure
被测者为年龄在21~28岁之间的健康男性5名和女性7名,被测者的招募基于自愿和知情同意的原则,研究内容和研究结果与之不存在利益冲突。室温下分别采集被测者运动前静息数据和运动后数据,记录被测者的脉搏波和心电信号,同时使用欧姆龙HEM-6131型电子血压计测量被测者的收缩压和舒张压各三次,取平均值作为血压计测量值。共采集记录到294组数据,具体数据情况如表1所示。

表1 采集到的脉搏波和心电数据详情Tab.1 Collected pulse wave and ECG data
1.2 实验信号处理
在脉搏波和心电信号的体表采集过程中,工频干扰、肌电干扰等高频噪声和基线漂移等低频噪声严重地影响了信号的检测结果;不同个体处于不同的生理病理状态下,其脉搏波和心电信号波形特征变化复杂,本文在MATLAB R2014a平台上,对实验室采集的脉搏波信号和心电信号进行去噪和特征点识别,具体情况如下。
1.2.1 脉搏波信号去噪和特征点识别
人体脉搏波一般被认为有六个特征点分别为b、c、d、e、f、g,如图2所示。本文提出双树复小波[14]和三次样条插值法[15]相结合的脉搏波信号去噪方法,首先采用双树复小波阈值法滤除信号中的高频噪声;然后将得到的滤除了高频噪声的脉搏波信号采用三次样条插值法拟合出近似基线漂移曲线,最后用滤除了高频噪声的脉搏波信号减去拟合出的基线漂移曲线,从而得到滤除了高频噪声和基线漂移的脉搏波信号。
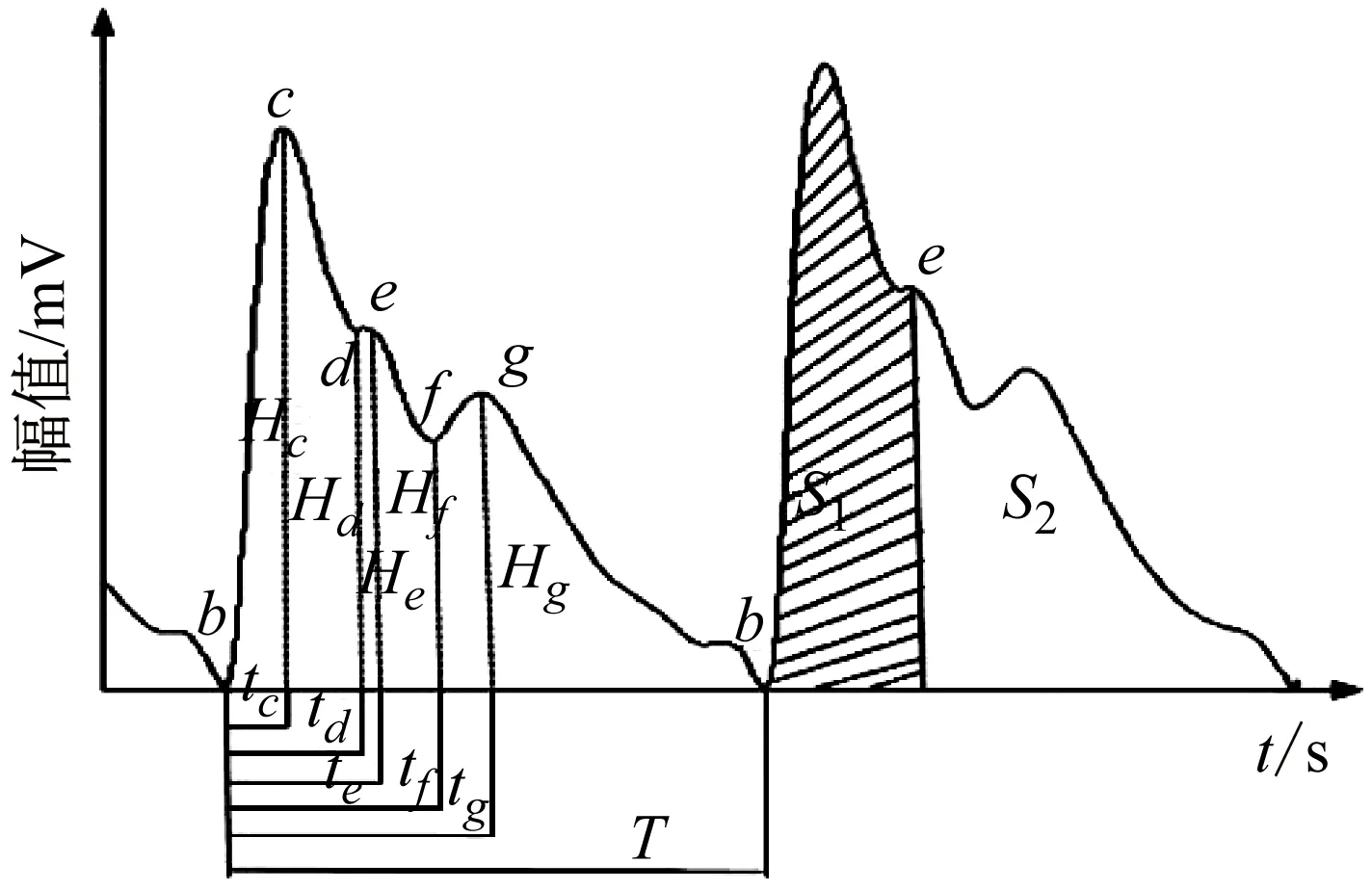
图2 脉搏波信号特征Fig.2 Characteristics of pulse wave signal
不同个体处于不同生理状态下的脉搏波形特征不尽相同,采用单一方法不能准确可靠地识别脉搏波的特征信息。因此本文结合双树复小波、微分法和滑窗法的脉搏波特征点识别方法,根据脉搏波特征点位置信息,逐步缩小脉搏波特征点的识别范围。首先采用滑窗法识别b、c点,再采用微分法在一定范围内识别f、g点,然后采用微分法在c和f点之间识别d点,最后根据双树复小波d5层信号d、f点之间对应的最大值点识别e点。图3(a)为一段含噪脉搏波信号,图3(b)为去噪后脉搏波信号的特征点识别情况。
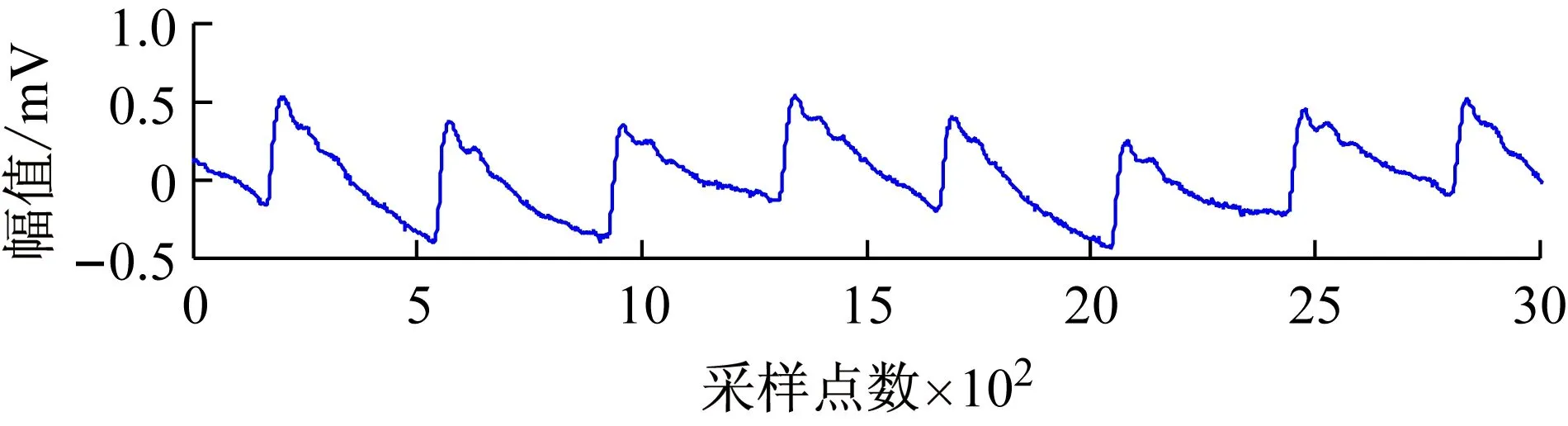
(a)原始脉搏波信号

(b)去噪后脉搏波信号
1.2.2 心电信号去噪和特征点识别
结合双树复小波变换对心电信号高频波段和形态学滤波对心电信号低频波段[16]的处理优势,本文首先采用形态学滤波器滤除含噪心电信号中的基线漂移等低频噪声,进而对信号进行双树复小波阈值去噪滤除信号中的高频噪声,从而实现心电信号中高频噪声和基线漂移的滤除。
双树复小波变换具有突出信号奇异点或瞬变点的能力,经过实验探索发现,双树复小波变换的d4层小波系数模极大值的最大值点对应原始心电信号的R波。采用滑窗法识别出d4层心电信号的模极大值的最大值点,对应回原心电信号中,从而实现心电信号R波的识别。图4(a)为一段含噪心电信号,图4(b)为去噪后心电信号的双数复小波变换的d4层小波系数,图4(c)为去噪后心电信号R波的识别情况。

(a)原始心电信号

(b)d4层信号
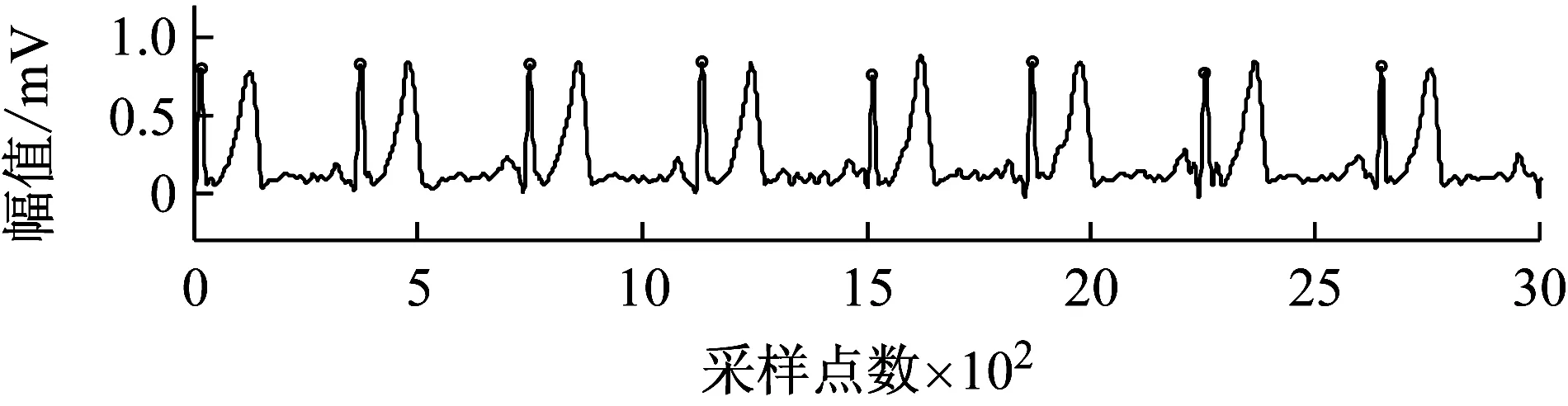
(c)去噪后心电信号
1.3 PWTT和PWPs的提取
通过计算同一心动周期中ECG信号的R波到脉搏波信号主波波峰c点的时间得到PWTT,如图5所示。为减小各种变化的影响以及比较不同被测对象之间的参数,本文采用归一化的方法对脉搏波特征参数进行处理,脉搏波时域特征参数如图2所示。
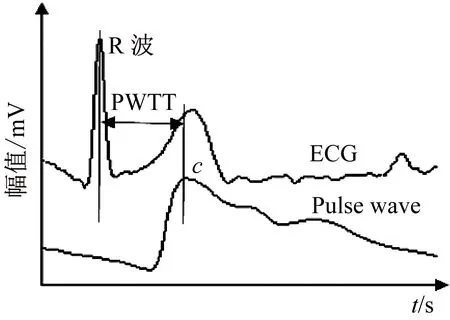
图5 基于心电信号和脉搏波信号测量PWTTFig.5 PWTT measurement from ECG and pulse wave signals
选取PWTT和时间及幅度类共16个PWPs为研究对象,具体包括:PWTT、升支相对时间(tc/T)、特征点d相对时间(td/T)、特征点e相对时间(te/T)、特征点f相对时间(tf/T)、特征点g相对时间(tg/T)、周期T、特征点d相对高度(Hd/Hc)、特征点e相对高度(He/Hc)、特征点f相对高度(Hf/Hc)、特征点g相对高度(Hg/Hc)、波形特征量K、主波上升斜率V、心输出量Z、收缩期相对面积(S1/S)、舒张期相对面积(S2/S)、收缩期与舒张期面积之比(S1/S2)。
2 MIV-BP神经网络模型的构建
在MATLAB R2014a中,利用神经网络工具箱中提供的函数以及图形用户界面完成MIV-BP网络的训练和仿真,具体步骤如下。
2.1 单纯BP神经网络模型的训练
BP神经网络[17]是MIV-BP神经网络构建的基础,是一种包含输入层、中间层(隐层)和输出层的多层前向神经网络。由于BP神经网络既能很好地刻画线性关系,又能很好地刻画非线性关系,因此本文以BP神经网络为基础建立血压模型。
分别选取数据量较多的被测者Test_1、Test_4和Test_7的数据,共129组数据,提取相应的PWTT和PWPs共17个参数为输入量,以血压计测量得到的SBP或DBP为输出量,分别训练出一个关于收缩压的BP神经网络(Nets0)和一个关于舒张压的BP神经网络(Netd0),具体步骤如下。
由BP神经网络的原理可知:三层前馈人工神经网络可任意精度逼近任意连续函数[18],为了提高网络的训练速度,简化网络的结构,本文采用单隐含层。
(1)输入参数和输出参数的初步确定,如表2所示。
表2 Nets0和Netd0网络输入和输出参数的确定Tab.2 Determination of the input and output parameters of Nets0 and Netd0 networks

输入参数(17个) 输出参数(1个)Nets0PWTT和PWPsSBPNetd0PWTT和PWPsDBP
(2)BP神经网络参数的设置,包括学习速率、激励函数和学习算法等。学习速率设置为0.03,隐含层和输出层的激励函数分别设置为TANSIG和PURELIN,学习算法采用收敛性较好的Scaled Conjugate Gradient算法[19]。
(3)隐含层节点数的设置,根据经验公式,如式(1)所示,确定BP网络隐含层节点数的范围为[5,15],然后采用尝试法以网络的均方根误差和复杂度确定各网络的隐含层节点数。
(1)
式中:m为隐含层节点数,n为输入层节点数,l为输出层节点数,∂为1~10之间的常数。
经过多次实验在隐含层节点数范围内寻找合适的节点数,表3为隐含层节点数不同时,Nets0和Netd0网络的预测均方根误差。以均方根误差和复杂度为选择指标,最后确定Nets0和Netd0网络的隐含层节点数分别为:14和13。
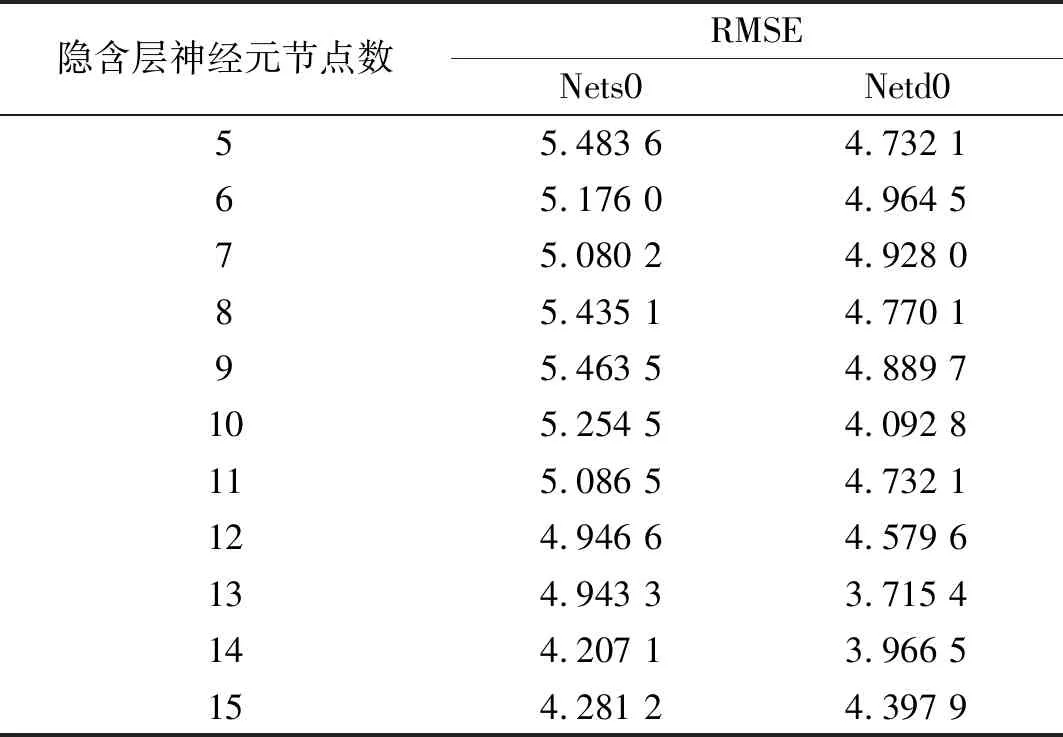
表3 Nets0和Netd0网络的均方根误差Tab.3 RMSE of Nets0 and Netd0 networks
2.2 基于MIV的BP神经网络模型输入参数的选择
利用PWPs和PWTT与血压值训练模型时,由于过多地输入参数会使得BP网络的输入数据庞杂,系统的负荷增加以及网络的性能下降,因此选取适当数量的输入参数有利于简化模型的结构并提高网络的效率。本文采用平均影响值(Mean Impact Value,MIV)法对输入数据作降维处理,具体过程如下:①在训练好BP神经网络后,将训练样本(设为X)中每个输入变量分别在原值的基础上做加10%与减10%运算,构成两个新的训练样本X1和X2;②分别将X1和X2输入到训练好的网络中进行仿真,得到两个仿真结果Y1和Y2;③计算Y1与Y2的差值,即为该变量变化后对输出的影响变化值(Impact Value,IV);④将IV按观测数目平均求出该自变量对因变量的平均影响值(MIV)。
按照上述步骤分别计算各自变量的MIV值。最后根据式(2)计算出第i个自变量对于因变量的相对贡献率。
(2)

以2.1构建的BP神经网络为基础,通过MIV分析各输入参数对输出结果的影响程度,选出对输出影响累计贡献率大于85%的前几个输入参数,作为BP神经网络的输入参数。收缩压模型和舒张压模型的各输入参数的MIV值大小排序如表4和表5所示。经过MIV方法筛选后,选出收缩压计算模型的输入参数为:K、PWTT、Hg/Hc、tg/T、T、te/T、td/T、Hd/Hc、He/Hc和S2/S,舒张压计算模型的输入参数为:He/Hc、te/T、S2/S、PWTT、tf/T、Hd/Hc、S1/S、tg/T、T和K。
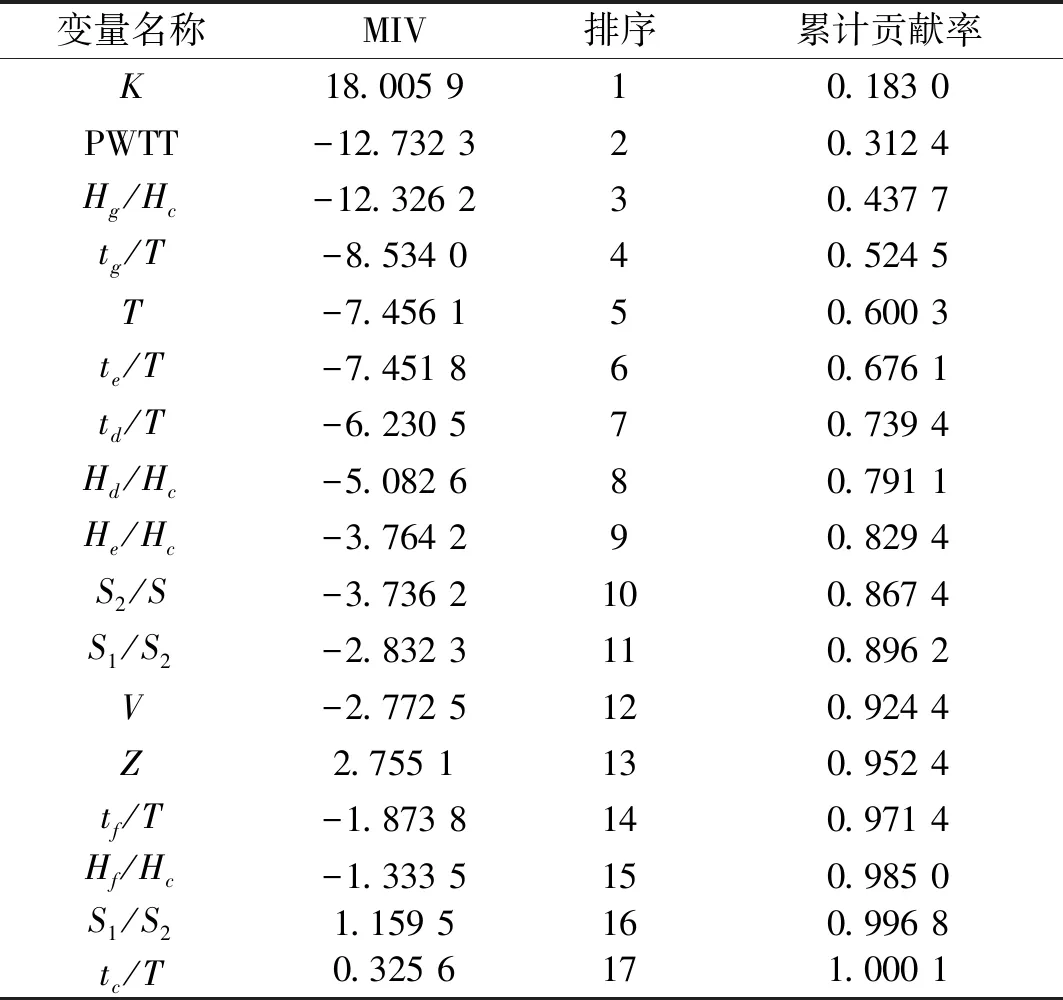
表4 各输入参数对收缩压的MIV值大小排序Tab.4 Ordered MIVs for SBP value input parameters
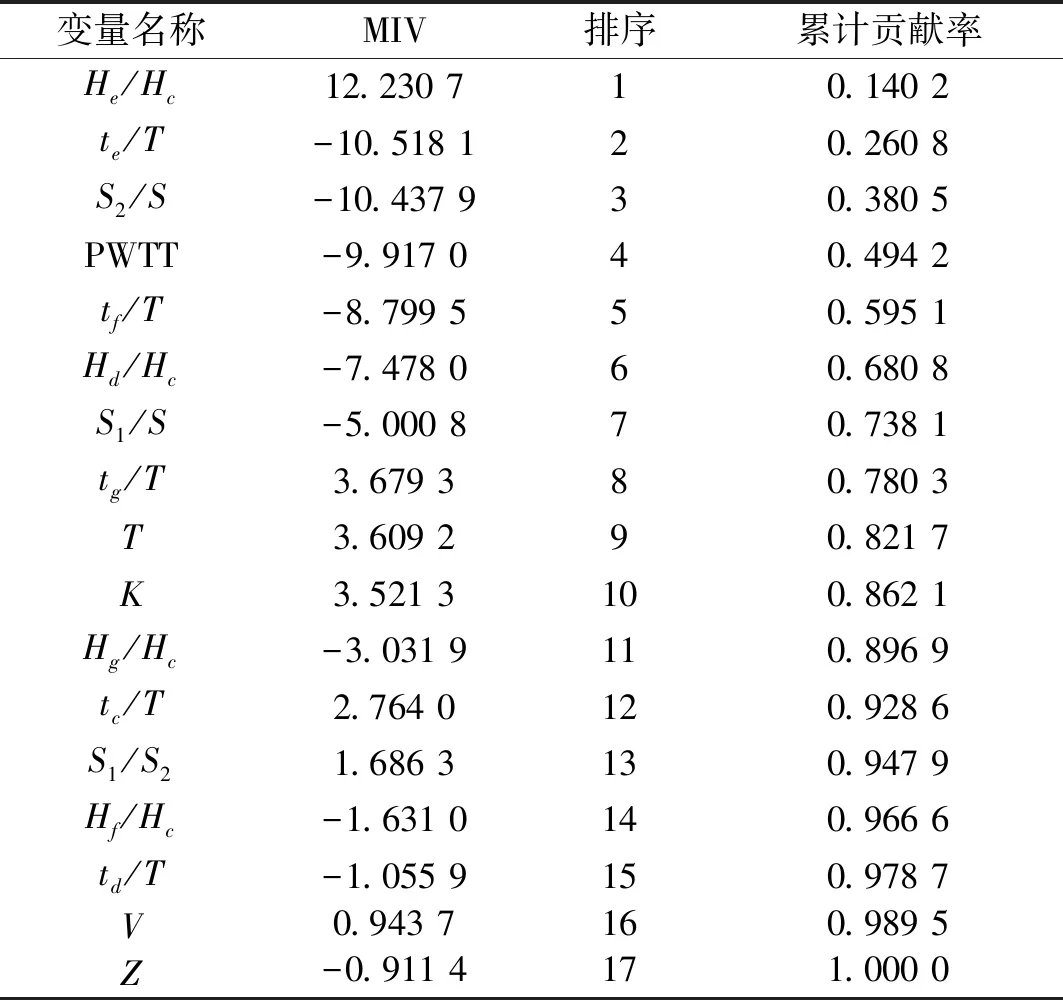
表5 各输入参数对舒张压的MIV值大小排序Tab.5 Ordered MIVs for DBP value input parameters
2.3 MIV-BP神经网络模型的训练和评价
以MIV优选的输入参数作为BP神经网络的输入量,设置学习速率、隐含层和输出层的激励函数分别为0.03、TANSIG和PURELIN。根据经验公式(1)和尝试法以均方根误差和复杂度为选择指标,最终确定NETs0和NETd0网络的隐含层节点数分别为10和11。这两个网络的训练时间均少于5 s。
训练好NETs0和NETd0网络后,选取12名受试者的数据作为测试集,以均方根误差(RMSE)和平均相对误差(MRE)来对比分析原输入参数组(17个输入参数)所训练的 Nets0和Netd0网络,与MIV优选输入参数所训练的NETs0和NETd0网络的性能,具体结果如图6和图7所示,图6和图7的横轴“T-i”,表示受试者Test_i的数据。通过对比原输入参数组和MIV优选输入参数组所训练网络的输出结果误差,以及简化模型结构的角度,本文选取MIV优选的输入参数组所训练的预测误差更小的NETs0和NETd0网络来分别构建收缩压预测模型和舒张压预测模型。
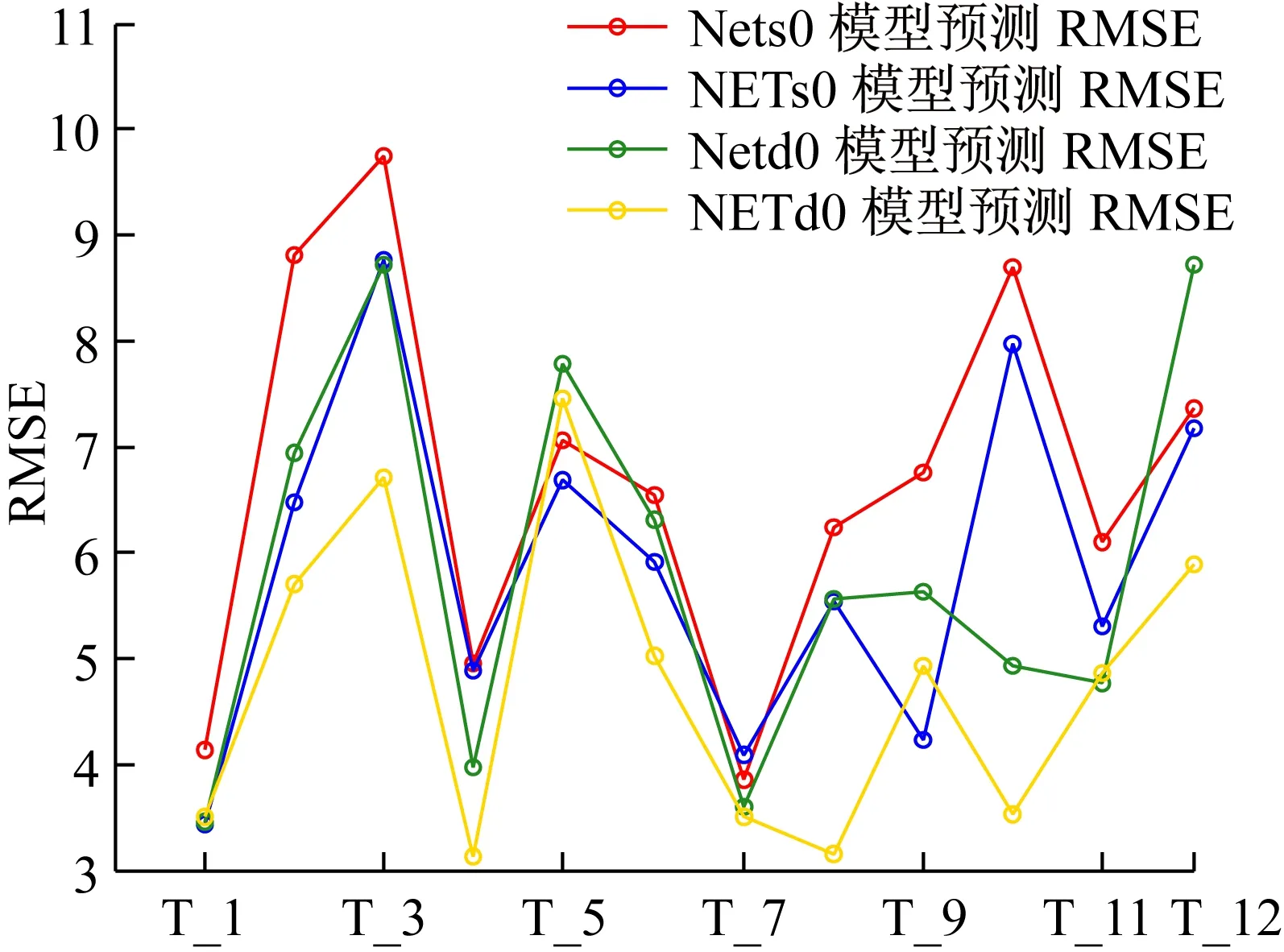
图6 BP神经网络和MIV-BP神经网络模型的血压预测均方根误差对比Fig.6 Comparison of the predictive RMSE of blood pressure model based on BP neural network and MIV-BP neural network
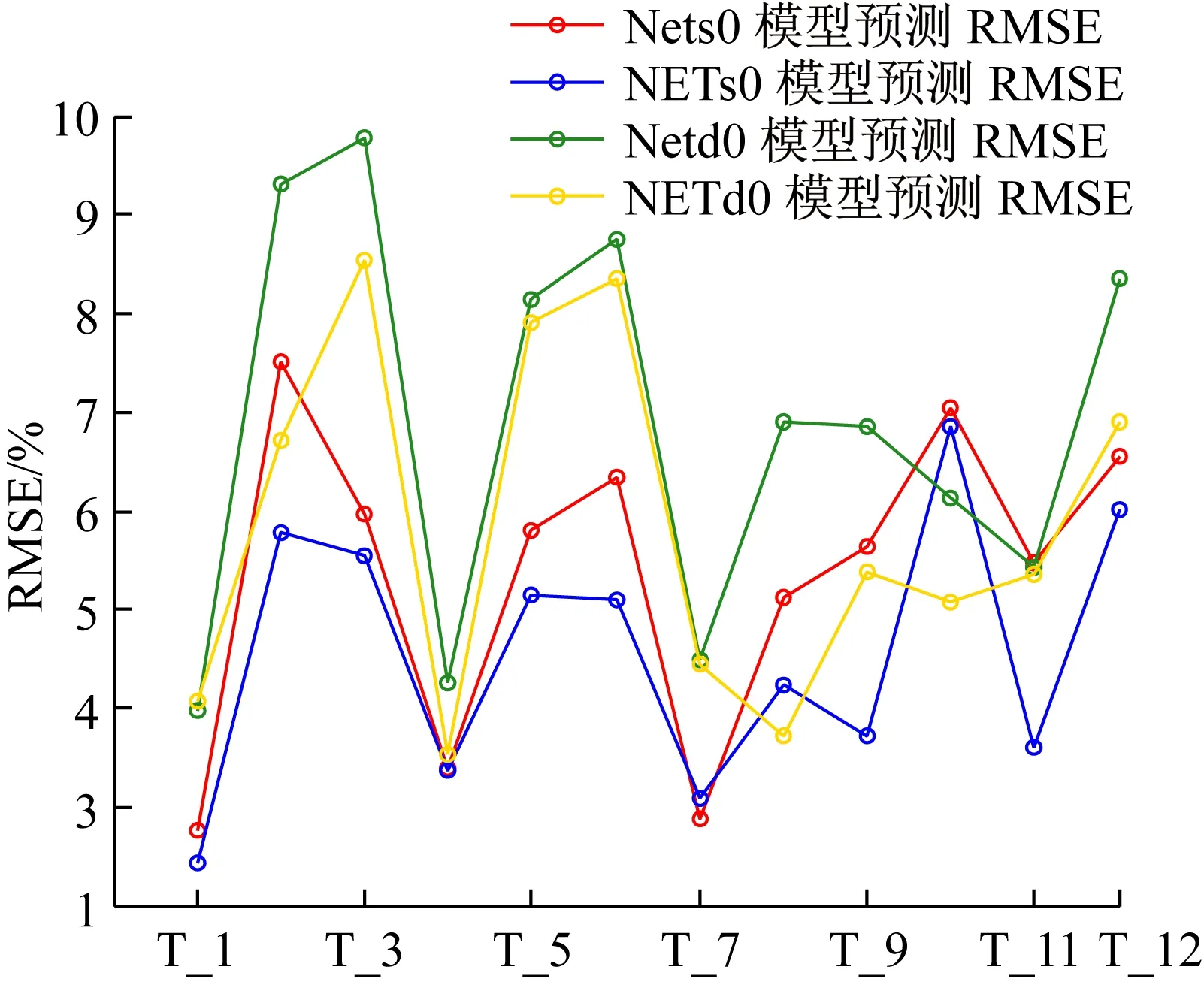
图7 BP神经网络和MIV-BP神经网络模型的血压预测平均相对误差对比Fig.7 Comparison of the predictive MRE of blood pressure model based on BP neural network and MIV-BP neural network
3 GA-MIV-BP神经网络模型的构建与分析
3.1 GA-MIV-BP神经网络模型的构建

图8 基于GA优化的MIV-BP神经网络连续血压无创监测模型Fig.8 Flow chart of the non-invasive continuous blood pressure measurement models based on the GA-MIV-BP neural network
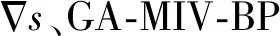
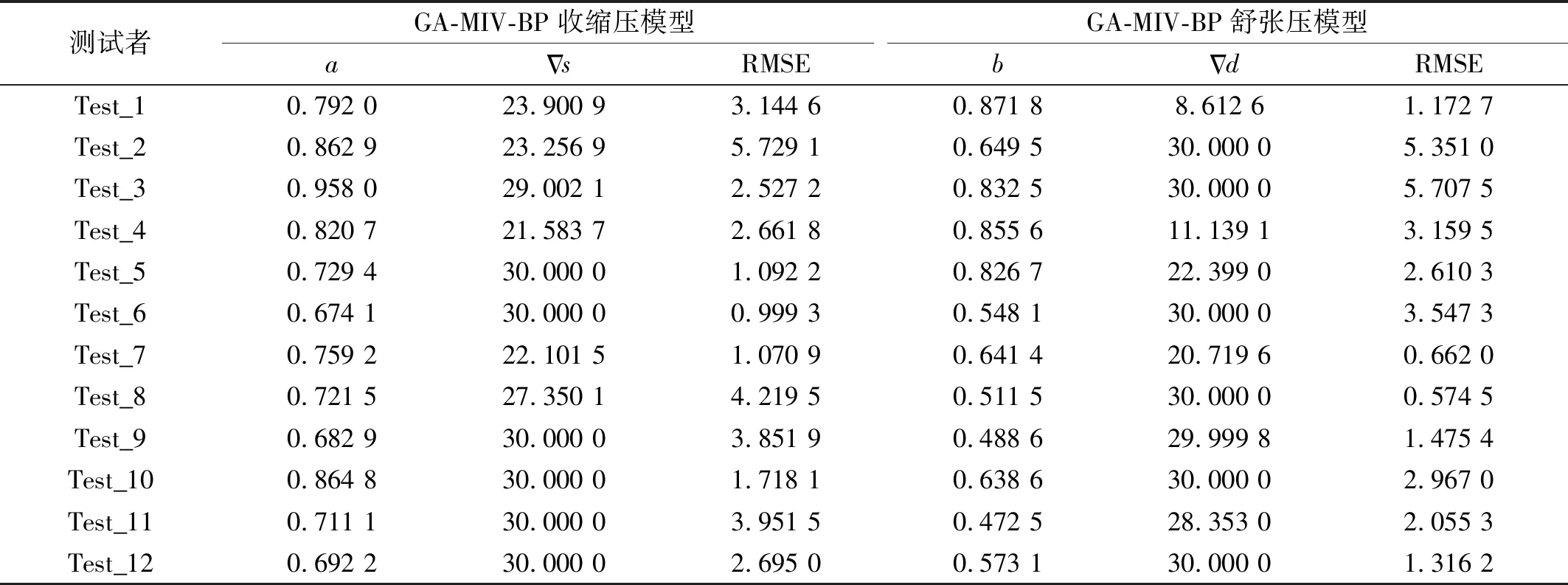
表6 不同测试者GA-MIV-BP收缩压和舒张压模型的优化参数Tab.6 Optimization parameters for GA-MIV-BP neural network SBP and DBP model for different subjects
3.2 与其他血压模型的对比
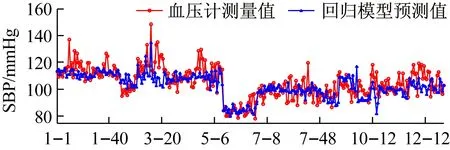
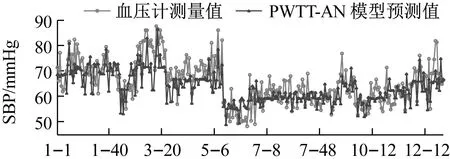
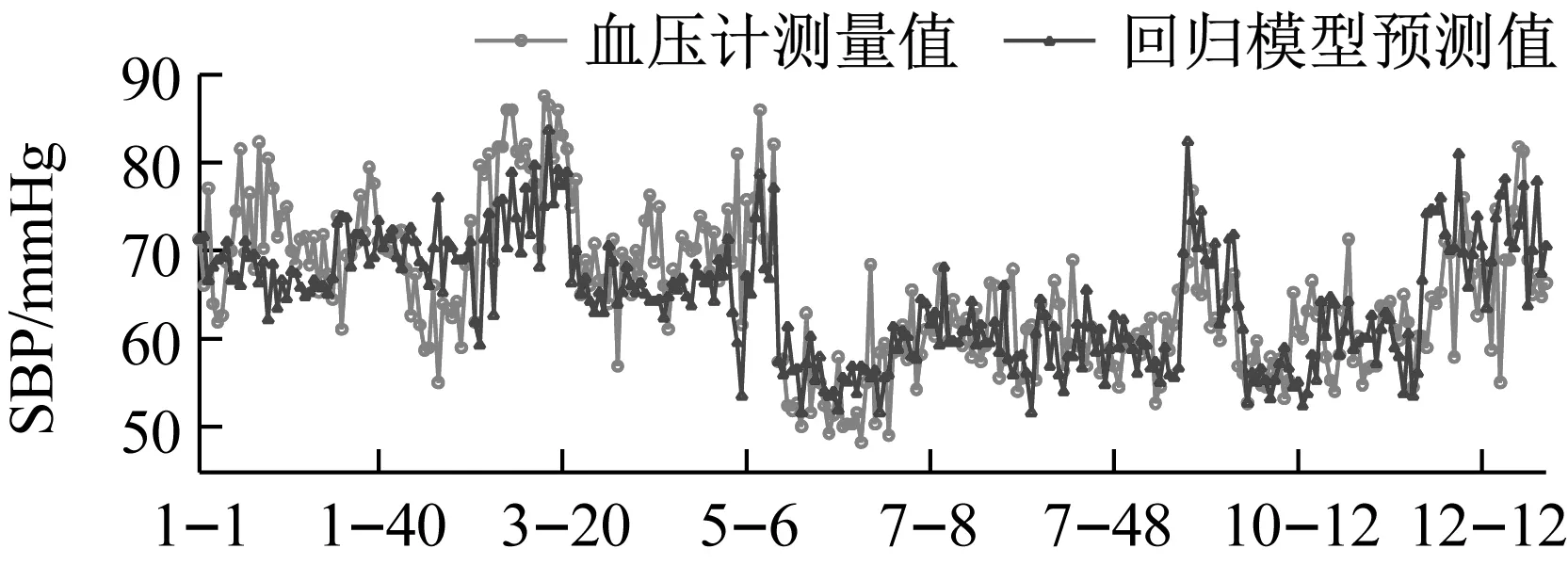
利用GA-MIV-BP神经网络模型、文献[8]中的线性回归模型和文献[20]中基于PWTT的人工神经网络模型对12名被测者的血压值进行预测,三个模型的血压预测值与血压计测量值的对比情况如图10和图11所示,图10和图11的横轴“i-j”,表示受试者Test_i的第j组数据。从图10和图11可以看出,使用GA-MIV-BP神经网络模型的预测结果比使用线性回归模型和基于PWTT的人工神经网络模型的预测结果更加逼近真实的血压测量值,可以初步得出结论:GA-MIV-BP模型的预测性能优于线性回归模型和基于PWTT的人工神经网络模型。
为了进一步分析本文所提出模型相比其它几种模型的预测性能,本文使用均方根误差(RMSE)、平均相对误差(MRE)来比较分别使用GA-MIV-BP模型、回归模型和基于PWTT的神经网络模型的预测结果。
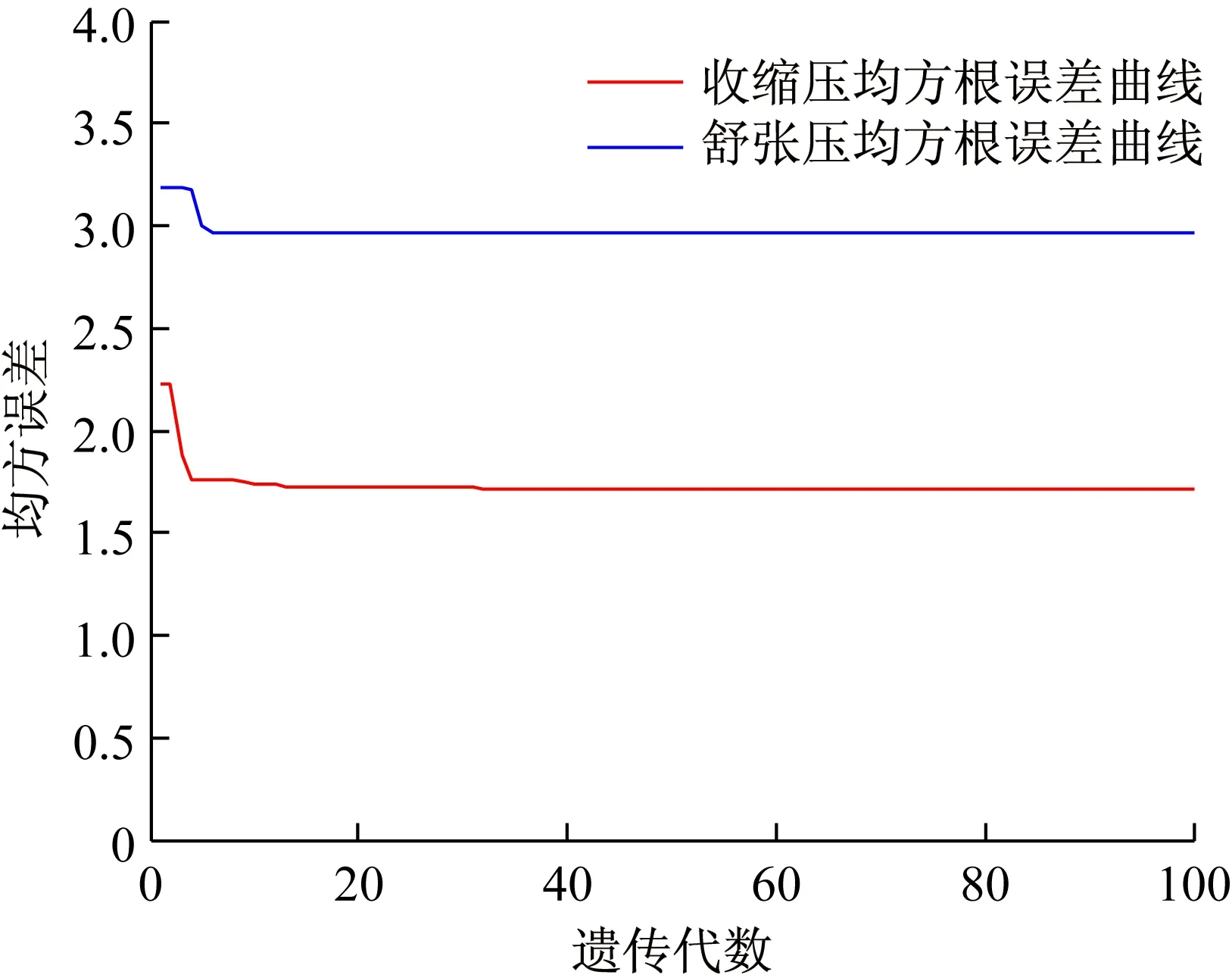
图9 遗传算法均方根误差曲线图Fig.9 RMSE curve using the GA
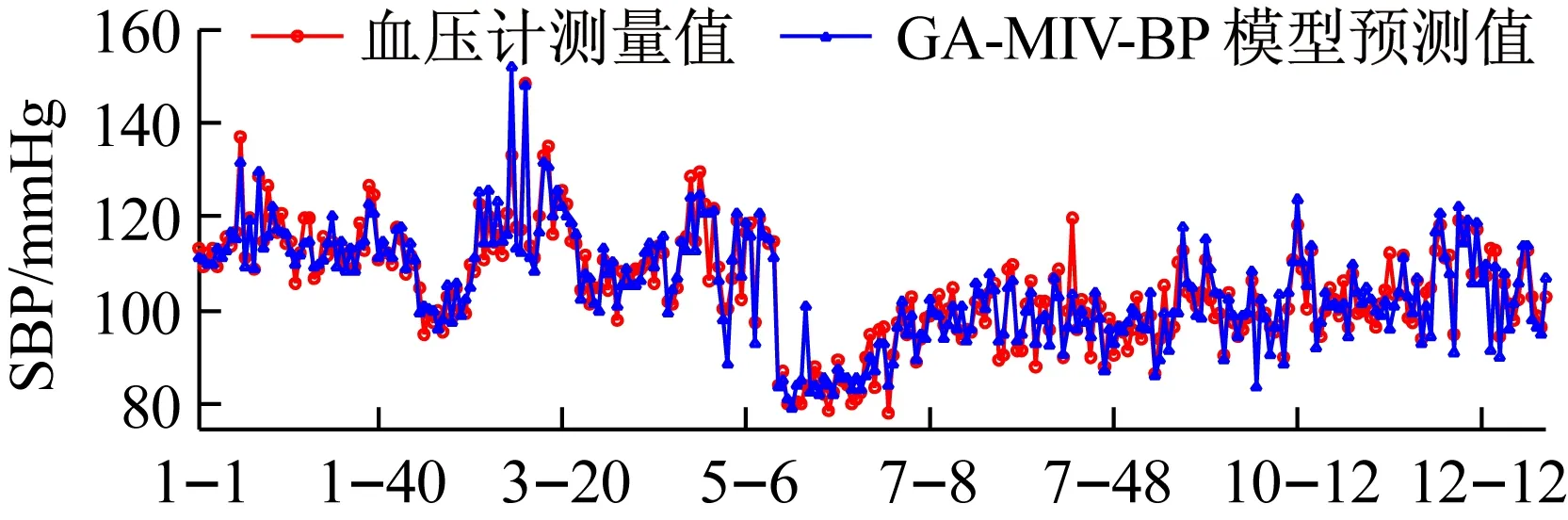
(a)
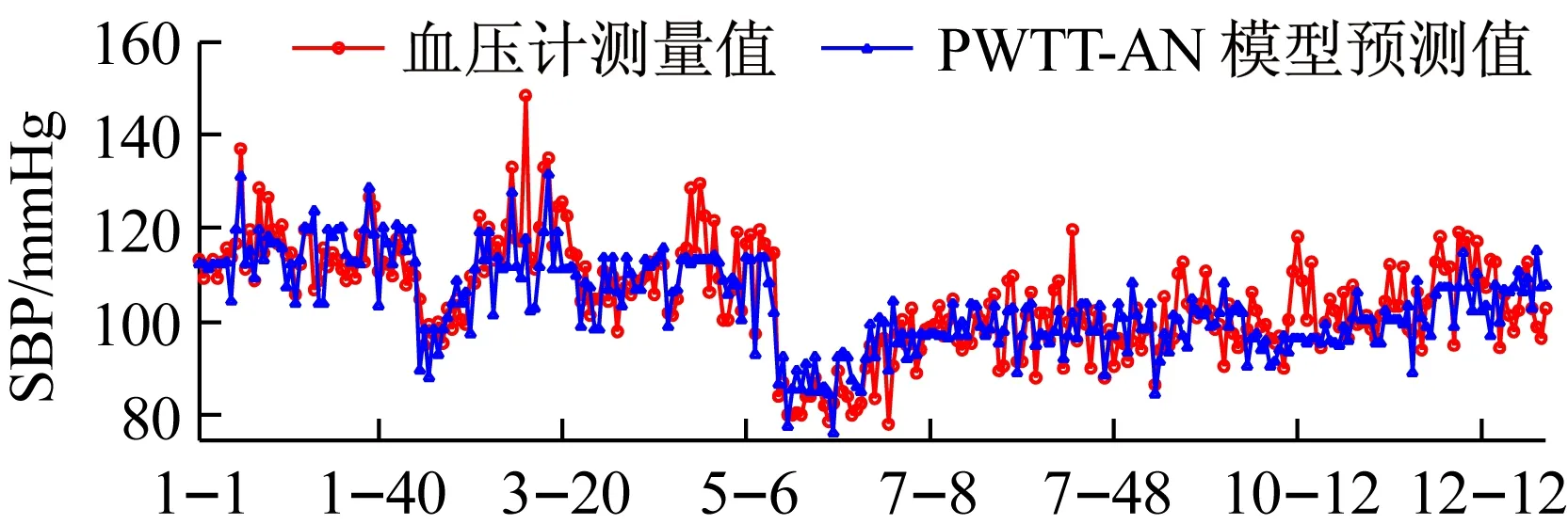
(b)
(c)
使用三种模型的血压预测值与血压计测量值的RMSE和MRE如表7和表8所示,可以看出使用GA-MIV-BP模型所计算的收缩压和舒张压的RMSE和MRE均低于回归模型和基于PWTT的神经网络模型。因此,可以得出相对于回归模型和基于PWTT的神经网络模型,GA-MIV-BP模型所计算的收缩压和舒张压的预测精度更高,其MRE均在5%以内。
3.3 GA-MIV-BP模型预测值与血压计测量之间的Bland-Altman一致性分析
对GA-MIV-BP模型血压预测值与欧姆龙血压计测量值进行Bland-Altman分析,如图12和图13所示。从图12可以看出96.26%的点在95%一致性范围内,一致性范围内的所有差值绝对值的最大值为6.805 9 mmHg;从图13可以看出95.92%的点在95%一致性范围内,一致性范围内的所有差值绝对值的最大值为7.107 9 mmHg。从实际测量考虑和临床要求出发这种差异是可以接受的,因此GA-MIV-BP模型的血压预测值与欧姆龙血压计测量值具有较好的一致性,可互换使用。

(a)
(b)
(c)
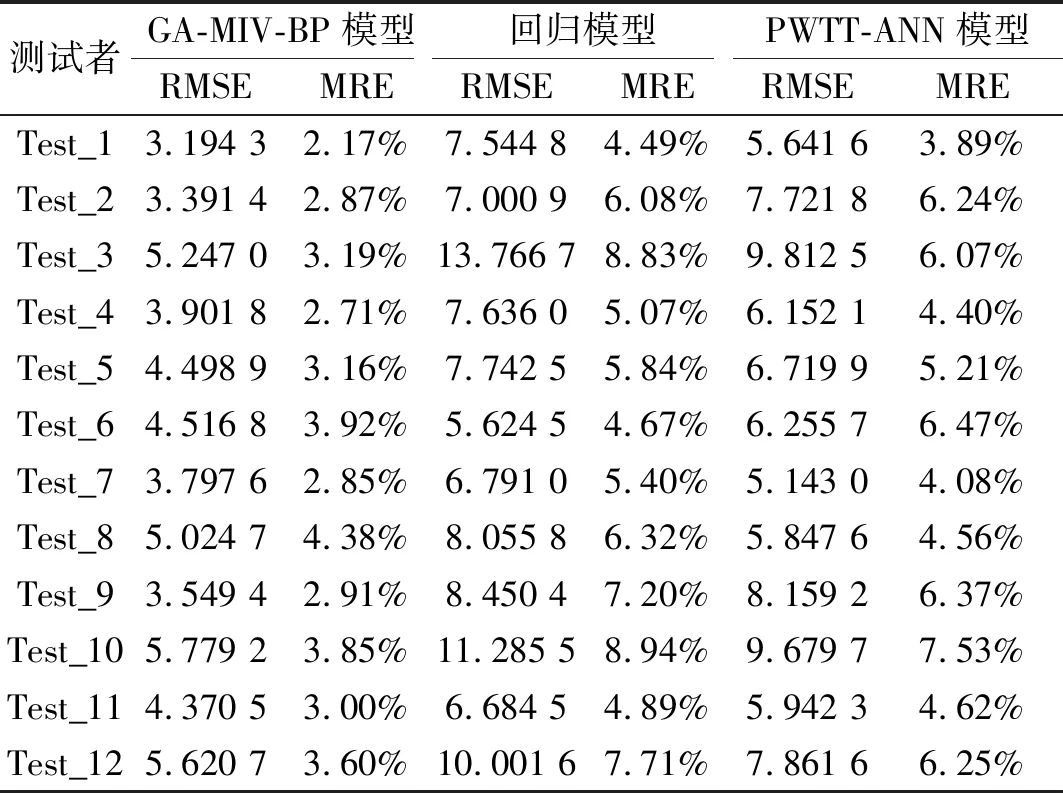
表7 收缩压预测结果的均方根误差和平均相对误差Tab.7 RMSE and MRE of the SBP prediction results from different models
3.4 GA-MIV-BP神经网络模型的优势与不足
对比本文提出的血压模型与其它血压模型对12名被测者的血压预测结果,该模型本身与血压计测量值的差异性比较,该模型具有以下优势:
(1)GA-MIV-BP模型相比于文献[8]中的线性回归模型,不仅拟合了PWTT和PWPs与血压之间的线性关系,还刻画了其与血压之间的非线性关系,更符合实际情况;
表8 舒张压预测结果的均方根误差和平均相对误差Tab.8 RMSE and MRE of the DBP prediction results from different models
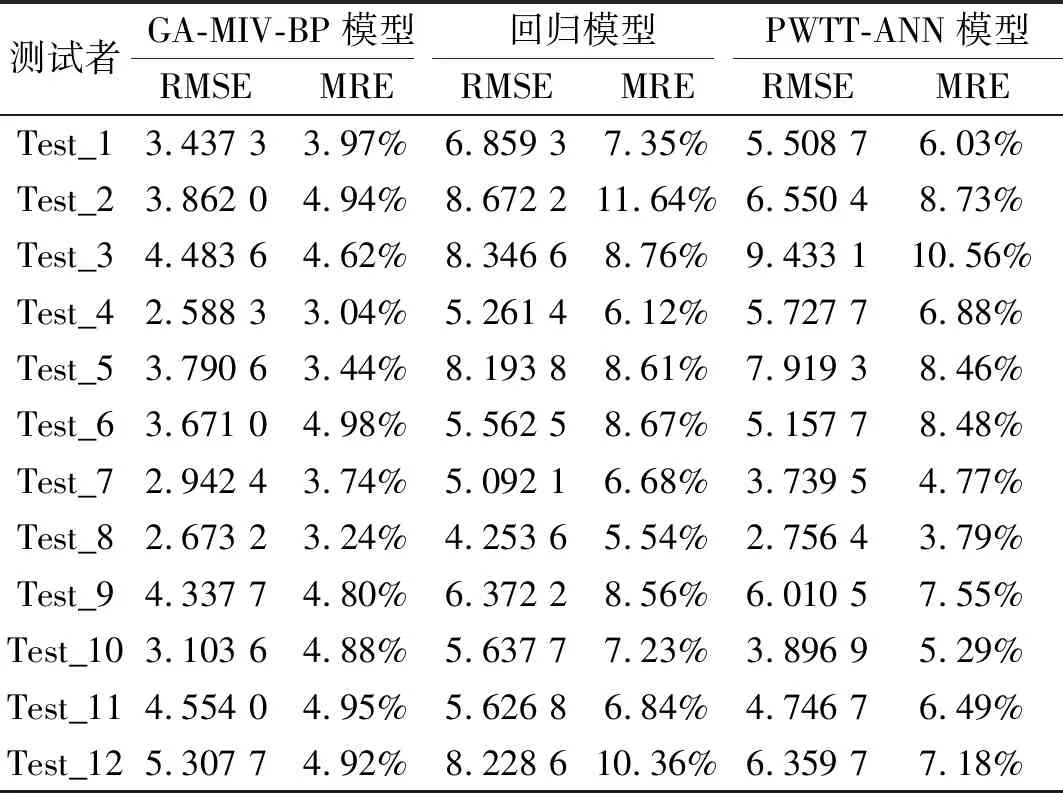
测试者GA-MIV-BP模型回归模型PWTT-ANN模型RMSEMRERMSEMRERMSEMRETest_13.437 33.97%6.859 37.35%5.508 76.03%Test_23.862 04.94%8.672 211.64%6.550 48.73%Test_34.483 64.62%8.346 68.76%9.433 110.56%Test_42.588 33.04%5.261 46.12%5.727 76.88%Test_53.790 63.44%8.193 88.61%7.919 38.46%Test_63.671 04.98%5.562 58.67%5.157 78.48%Test_72.942 43.74%5.092 16.68%3.739 54.77%Test_82.673 23.24%4.253 65.54%2.756 43.79%Test_94.337 74.80%6.372 28.56%6.010 57.55%Test_103.103 64.88%5.637 77.23%3.896 95.29%Test_114.554 04.95%5.626 86.84%4.746 76.49%Test_125.307 74.92%8.228 610.36%6.359 77.18%

图12 收缩压预测值与测量值的Bland-Altman分析Fig.12 Bland-Altman analysis of predicted and measured SBP values
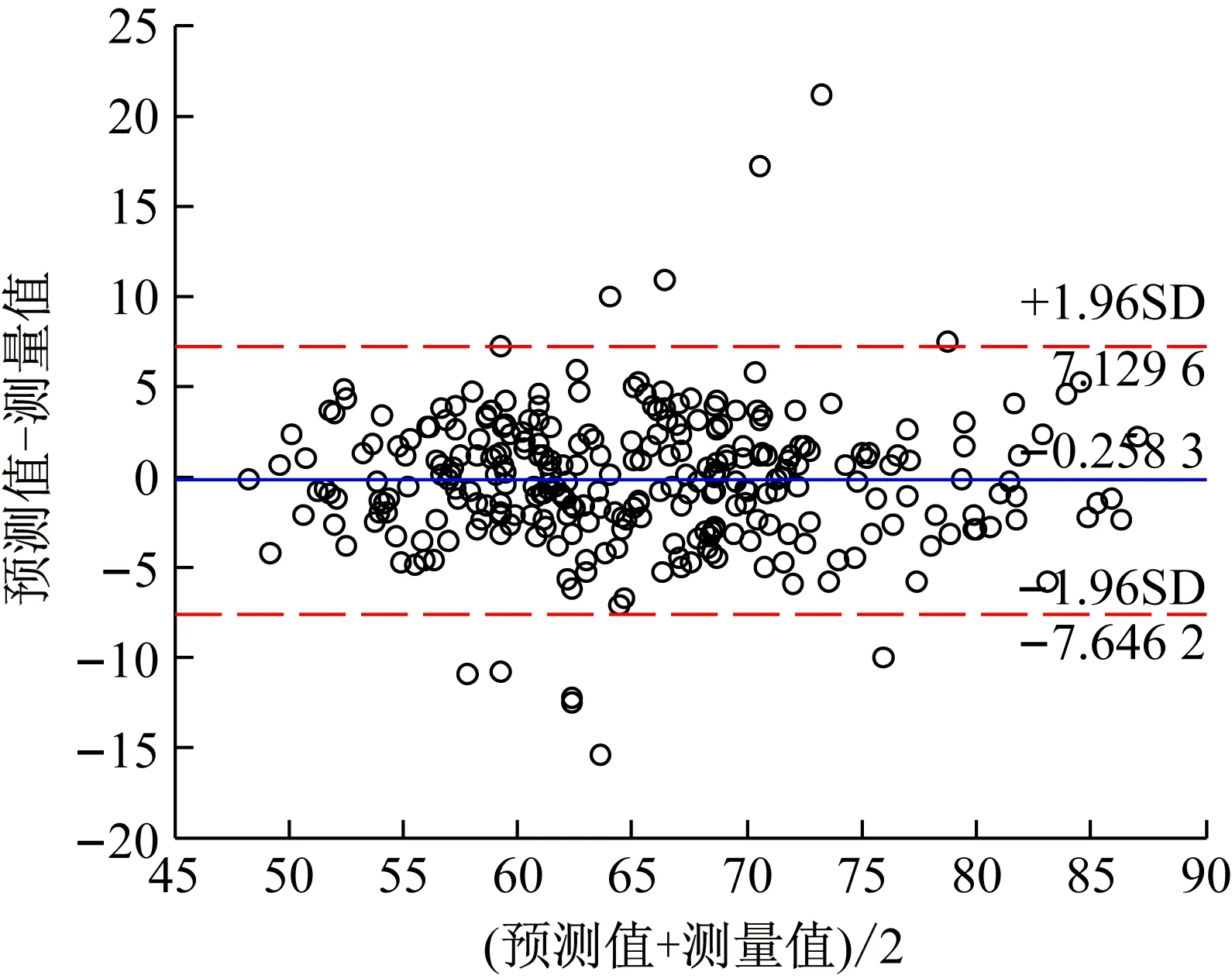
图13 舒张压预测值与测量值的Bland-Altman分析Fig.13 Bland-Altman analysis of predicted and measured DBP values
(2)GA-MIV-BP模型相比于文献[20]中提出的基于PWTT的神经网络模型,除了PWTT还引入了更多对血压值影响较大的参数作为输入量,增加了模型的精度和稳健性;另外分别将收缩压或舒张压作为输出量所训练的GA-MIV-BP收缩压模型和GA-MIV-BP舒张压模型更能刻画输入参数与输出参数之间的关系,因此相比文献[20]将收缩压和舒张压作为输出量训练的单个神经网络模型的血压预测效果更好;
(3)不同的个体由于其生理系统等的差异性,其与PWTT或PWPs的函数关系存在一定的差异性。本文提出的模型相比于传统的线性回归模型和基于PWTT的神经网络模型,增加了对个体差异性进行校正的方法,只需调节两个参数便可对收缩压或舒张压模型进行校正,对血压的预测精度更高。
但本文的模型也存在一定的不足:
(1)实验受试者的数量较少,年龄分布范围较窄,且实验数据都是来自于健康个体,因而该模型对不同年龄段以及血压异常(比如高血压或动脉粥样硬化)等受试者的适用性有待进一步验证;
(2)本文模型的输入参数PWTT和PWPs的准确提取是血压预测的关键。实际测量中,对脉搏波或心电信号严重变形或失真的情况,难以有效提取PWTT和PWPs,从而造成模型的预测误差较大。除了PWTT和PWPs这17个参数,接下来的研究将会引入更多反应个体生理差异性的参数,比如年龄、身高、体重、体温和身体质量指数等参数,来进一步提高血压预测的准确性,克服模型的个体差异性;
(3)相比于传统的血压模型,本文的模型训练时间更长,运算复杂度增加。但是GA-MIV-BP模型的具体运用中,MIV-BP模型的结构、权值和阈值确定后就是一个固化的模型,后续无须再训练。对受试者进行血压预测时,只需采用GA校正个体差异性系数,其中对单个个体的GA-MIV-BP收缩压或舒张压模型的优化时间均少于2分钟。
4 结 论
本文提出了GA-MIV-BP神经网络连续血压无创监测模型,相比于文献[8]中的回归模型和文献[20]中基于PWTT的神经网络模型,其血压预测值的均方根误差和平均相对误差更小,模型的预测性能更好。利用Bland-Altman一致性分析对GA-MIV-BP模型预测值与血压计测量值进行一致性检验,结果表明两种测量方法具有很好的一致性,可以替代使用。GA-MIV-BP神经网络连续血压无创监测模型是基于PWTT和PWPs对血压进行测量,彻底摆脱了袖带的束缚,增强了被测者的舒适感。GA-MIV-BP模型有效降低了个体差异性对模型预测精度的影响,可保证具有良好的预测性能,因而为连续血压无创监测设备的临床应用提供了有力的算法支持。
