原料药研发项目管理中危害分析和关键控制点风险分析工具的应用
2019-05-27黄娟,杨悦
黄 娟 ,杨 悦
(1.沈阳药科大学,辽宁 沈阳 110016; 2.华北制药集团先泰药业有限公司,河北 石家庄 050021)
原料药研发项目从工艺研究、技术转移到生产与注册,投入相对于企业来说投资是巨大的,风险也是极高的。项目管理和风险管理在原料药研发方面发展较晚,且管理能力尚不足,很多企业仍在运用传统的管理方式[1-4]。项目是为创造独特的产品、服务或成果进行的临时性工作。原料药研发项目是以原料药为对象,为达到既定的成本质量水平进行的一系列活动,受到资源调配、时间控制和资金成本的约束。危害分析和关键控制点(hazard analysis and critical control point,HACCP)风险管理工具广泛应用于多个国家食品药品行业和其他行业[5-8]。本研究中以项目管理知识体系为指导拆解分化原料药研发项目工作范围与内容,将HACCP方法运用于原料药研发项目的工作流程中,运用鱼骨图分析风险点,梳理风险项,提出风险管理的措施,归纳并总结运用HACCP方法对原料药研发项目实施风险管理的措施。现报道如下。
1 HACCP应用于生命周期质量风险管理的流程
1.1 HACCP概述
HACCP最初于20世纪60年代初由美国食品生产者与美国航天规划署合作创建[9],我国卫生部2002年颁布了《食品企业HACCP实施指南》,世界卫生组织(WHO)2003 年发布了《Application of Hazard Analysis and Critical Control Point(HACCP)methodology to Pharmaceuticals》,人用药物注册技术要求国际协调会(ICH)2005年发布ICHQ9,HACCP工具是药品生命周期质量风险管理[10]的推荐工具。2008年3月1日起人用与兽用药品生产企业正式实施根据ICH Q9制订的名为《EU Guidelines to Good Manufacturing Practice Medicinal Products for Human and Veterinary Use Annex 20 Quality Risk Management》的指南,欧盟专家指出,HACCP的方法完善工艺研发,明确关键工艺参数。HACCP的方法也逐渐为国内制药行业采用[11-14]。
药品生命周期,包括工艺研究、技术转移、生产与注册和产品停止流通4个阶段。研发质量管理系统应覆盖原料药的研发工作,包括工艺研究与技术转移;技术转移阶段应同时满足研发质量体系和《药品生产质量管理规范》(GMP)的管理要求;知识管理和质量风险管理贯穿各体系,管理范围示意图见图1。

图1 风险管理贯穿原料药研发周期
1.2 运用HACCP的7个原则
原则 1:组织危害分析(conduct a hazard analysis),收集和评估原料药研发项目中潜在的对产品质量有不利影响的政策环境、公司制度、人员资质、资源配置、成本投入及导致这些危害发生的原因,可将确定的危害按等级划分。
原则2:确定关键控制点(determine the critical control point,CCPs),针对确定的危害采取控制措施,预防和消除危害,或将其减少到可接受水平,如使用精密度更高的仪器替换老旧设备。
原则 3:制订关键限值[(establish target levels and critical limit(s)],建立关键控制点的可接受水平的标准值,如制订原料药研发项目的工作计划量化指标表。
原则4:建立监测体系(establish a system to monitor the CCPs),制订监测计划,按计划检查每个关键控制点与既定关键限值的符合情况。
原则5:建立纠偏措施(establish the corrective action to be taken when monitoring indicates that a particular CCP is not under control),当关键控制点超出限值时应采取措施使之符合关键限值。
原则6:建立确认程序(establish procedures to verify that the HACCP system is working effectively),除了监测体系,还需采取其他方法来确定HACCP系统实施的有效性。
原则 7:建立程序记录(Eestablish documentation concerning all procedures and keep records appropriate to these principles and their application),HACCP 运行的整个过程应形成记录,保证数据的完整性和可追踪性。
2 HACCP应用于原料药研发项目的流程
2.1 ICH Q9风险质量管理程序
程序包括启动风险管理程序(initiate risk management process)、风 险 评 估 (risk assessment)、风 险 控 制(risk control)、风险沟通(risk communication)、风险回顾(risk review)[4]。HACCP 的实 施步骤[2]包括组织建立HACCP工作小组、描述产品和过程、确定产品用途、绘制流程图、研讨流程图,加上HACCP的7个原则共12个步骤,详见图2。

图2 HACCP应用于风险管理流程图
2.2 HACCP的12个步骤
2.2.1 启动风险管理程序(initiating risk management process)
组织建立HACCP工作小组:原料药研发项目组或原料药制药企业在选择HACCP工作小组时应首先明确所需专业知识、对应经验丰富的人员及各成员的职责与权限范围。组建HACCP小组参与项目各个阶段的风险沟通、决策时应结合原料药研发流程的特点,明确HACCP范围、目标、进度。先从小范围开始逐步扩大,循序渐进贯穿整个原料药研发项目过程。也可以分阶段着手,如原料药研发项目前期,着重关注工艺研究,随着研发项目的进展,将HACCP范围逐渐延伸到技术转移、生产与注册。
描述产品与生产过程、确定产品用途:原料药研发项目HACCP小组应根据确定的HACCP范围详细描述项目涉及相关信息,包括项目研究对象(原料药产品)的名称、质量目标、包装方式、有效期、贮藏运输、客户需求等;项目开展所需的资源包括物料、设备、场所;项目干系人包括决策者、项目负责人,各相关专业相关部门的参与者、技术转移接受方、顾客等;项目运行等外部环境如药品法律法规、环保、安全方面的规定。
绘制、讨论流程图:HACCP小组应详细讨论原料药研发项目的流程,流程图可从不同角度来绘制。原料药研发项目流程分为启动(Initiation)、规划(Planning)、执行(Execution)、控制(Controlling)、收尾(Closing-Out)5个步骤,即IPECC项目管理流程,这是一个宏观的宽范围的流程图。具体到项目阶段性目标,也可有针对性、有侧重地绘制流程图。如工艺研究阶段,HACCP工作小组应依据ICH Q11制订流程图。
基于QbD原料药研发项目流程:评估目标产品的质量概况;辨识潜在的关键质量属性;确定关键质量属性可接受的水平和范围;根据关键质量属性选择合适的制备工艺路线;采用合适的DOE设计实验方案;开展实验研究;采用合适的统计工具分析试验数据,辨识关键工艺参数和关键物料属性;确定关键工艺参数和关键物料属性的水平和范围,设计控制策略;回顾并修正关键质量属性、关键物料属性及其水平和范围,建立产品和物料质量标准和检测方法;逐级放大,根据放大效应,以保证产品合格率和收率为目标调整工艺参数控制范围;完成技术转移,注册报批,实现商业生产;根据销售地区法规制订放行法规;持续改进质量。
2.2.2 风险评估(risk assessment)
危害分析(hazard analysis)HACCP原则1:原料药研发项目HACCP小组应就流程图的各个环节进行充分讨论,根据确定的流程图尽可能地分析每一个步骤可能出现的潜在危害。利用合适的工具(如鱼骨图)进行分析,见图3。首先,分析危害的种类,按显著程度分级,去除不会发生的危害;其次,分析确定的危害产生的依据,按发生频次或难易程度对危害原因进行分级,确定主要原因、次要原因。
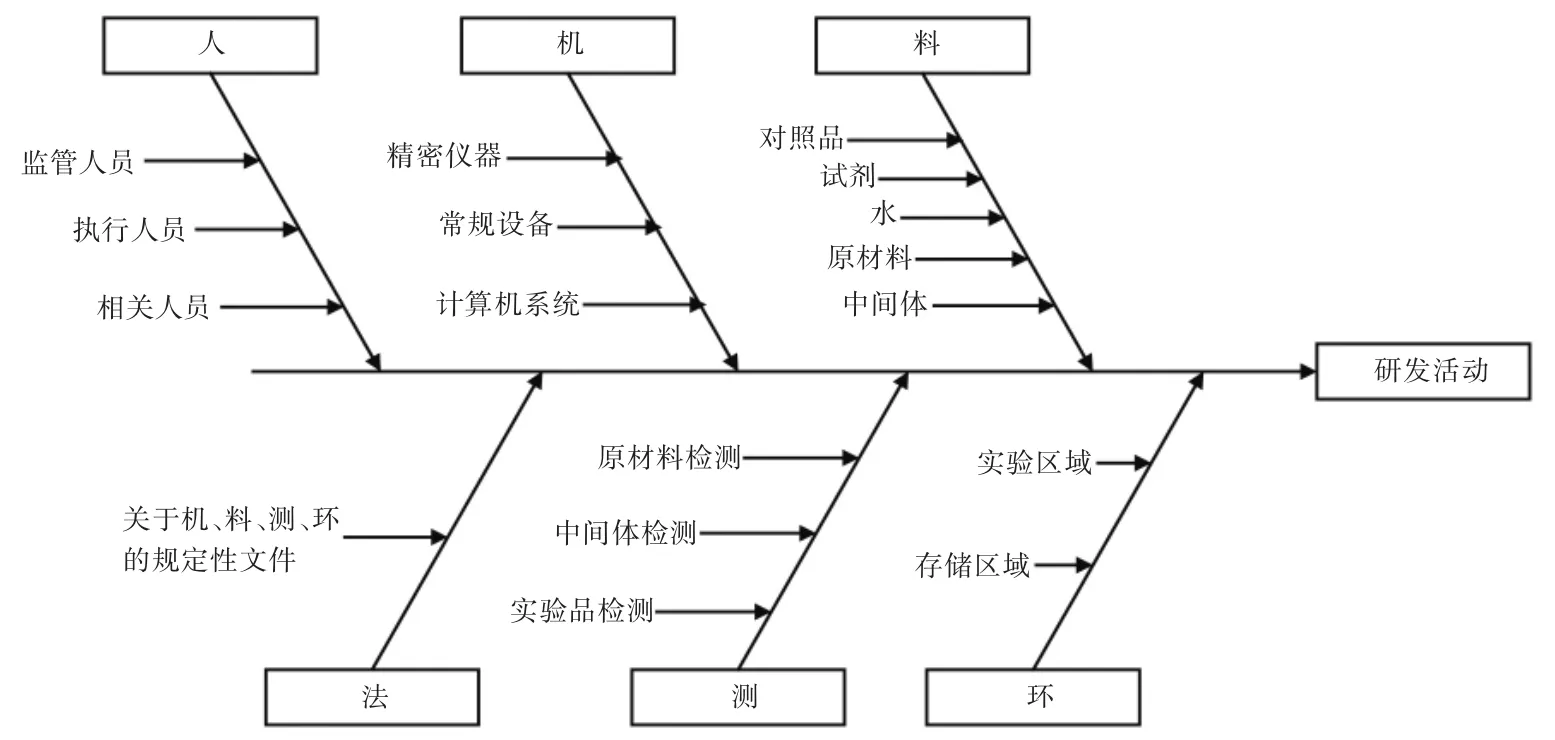
图3 原料药研发活动潜在危害分析鱼骨图
常见危害产生情况:设备故障,包括检测设备精度不够、数据完整性不符合法规要求,阀门、泵、混合器故障等;未按操作要求操作,如未按SOP对精密仪器进行检定校验,公用设施如超纯水、氮气、氢气等系统故障;人为差错,如信息沟通不畅,口头传递信息发生偏误、操作失误、误开阀门、配料错误等;自然因素,如雷击、突然断电、高温天气、高湿天气、大风、阳光等。
2.2.3 风险控制(risk control)
确定关键控制点(critical control point,CCP)HACCP原则2:根据危害分析结果,确定每个危害及危害的显著性和危害发生原因,编写“危害分析单”,HACCP小组对每个确定的危害制订有针对性的控制措施。对于如何判断关键控制点,可借鉴图4的决策树来进行逻辑推理。分析的结果均应填入“危害分析单”。
确定关键限值(critical limits)HACCP 原则 3:“危害分析单”还应包含关键控制点的指标,即关键限值。关键限值是一项或几项控制指标(如成本、质量等),用于评价是否可消除危害或降低危害至可接受水平的指标。关键限值是来源于统计分析、法律法规、行业指南、药品标准、专家建议、研究数据、文献等的具有科学依据的综合分析得出的结论。
建立监测(monitor)HACCP 原则 4:编织“HACCP 计划表”,明确每个监测点的 5W1H(what,why,how,where,when,who),制订操作限值表,操作限值可严于关键限值。如制订的季度考核成本限值低于计划成本,以加强原料药研发项目资金的使用控制。
建立纠偏措施(corrective action)HACCP原则 5:“HACCP计划”应包含对每个关键控制点预先建立的纠偏措施,便于出现偏差(超过关键限值)时实施。纠偏措施包括偏离的原因和纠正措施,偏离时期项目成果或产品的处理方法,全过程的记录。
2.2.4 风险沟通(risk communication)
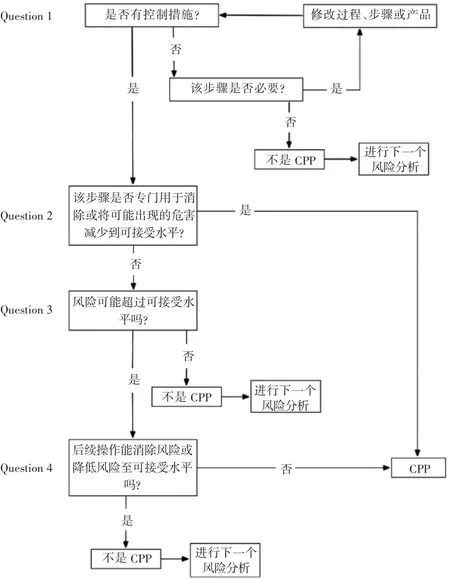
图4 关键控制点CPP评估决策树
建立程序记录HACCP原则6:应保存运用HACCP过程的沟通记录和文件记录,如危害分析单报告、流程图、CCP评估报告、HACCP工作小组会议记录、HACCP计划表、员工培训记录、CCP监控记录、纠正于预防措施记录等,形成档案文件,由原料药研发项目所属公司或企业指派专门部门统一归档保存,保存期限应符合相关药事法规的要求。
2.2.5 风险回顾(risk review)
建立确认(verification)程序HACCP原则7:经常回顾跟踪评估审核风险程序运行的有效性。考察风险水平是否已经消除或降低至可接受水平。如风险不可接受,须重新履行HACCP流程,最终目的是确保确定的风险始终处于受控状态,并得到持续改进。定期确认CCP是否处于受控状态,定期评估HACCP工具的使用是否正确,应将确认和评估计划列入“HACCP 计划表”。
3 结语
药品是一种特殊商品,药品质量直接关系到患者的人身安全。在质量源于设计QbD指导下,原料药研发项目更应从药品生命周期之初切实抓好药品质量的设计、降低质量风险;由于制药研发的高风险性,制药企业加大力量实施原料药研发项目的风险管理已迫在眉睫。将HACCP工具、ICHQ9风险管理程序与项目管理知识体系结合应用于原料药研发项目的管理,具有高效、实用、有效的特点,有助于提高原料药制药企业研发项目风险管理水平,提高药品质量。
