引起血流感染的耐万古霉素肠球菌基因型、毒力及MLST分型研究
2019-05-24杨靖娴刘雪凯邵冬华梁国威
杨靖娴 刘雪凯 邵冬华 梁国威
近年来,肠球菌已从过去公认的致病性低的肠道定植菌逐渐演变为引起院内感染的重要病原菌之一,可引起菌血症、心内膜炎、腹盆腔感染、泌尿生殖系统和皮肤软组织等多部位感染。耐万古霉素肠球菌 (vancomycin-resistant enterococci,VRE) 自20世纪80年代末出现后,迅速蔓延至整个美国、欧洲及全世界,加剧了肠球菌感染的治疗难度[1,2]。研究显示,在世界范围内由肠球菌引起的菌血症约占全部病原菌的10%,病死率达25%~50%[3]。在美国,18%的导管相关血流感染的病原菌为肠球菌,而VRE所致菌血症的病死率是万古霉素敏感肠球菌所致菌血症的2.5倍[4]。
在笔者医院由肠球菌引起的血流感染占全部病原菌的7%,排名第5位(前4位依次为凝固酶阴性葡萄球菌、大肠杆菌、鲍曼不动杆菌和肺炎克雷伯菌)。了解引起血流感染的VRE菌株的耐药基因型和分子流行病学特征可为VRE的预防和控制提供重要依据。本研究收集了2012年7月~2015年7月期间航天中心医院检验科血培养阳性标本中分离的68株屎肠球菌和28株粪肠球菌作为研究对象,调查VRE的检出情况,并对其进行耐药基因型、毒力基因和多位点序列分型 (multilocus sequence typing,MLST)研究。
材料与方法
1.菌株来源:收集自2012年7月~2015年7月期间从笔者医院检验科血培养阳性标本中分离的68株屎肠球菌和28株粪肠球菌作为研究对象,全部菌株均为患者首次入院首次分离株。所有菌株于-80℃冰箱冻存备用。
2.仪器与试剂:哥伦比亚血琼脂平板、MH琼脂平板以及万古霉素和替考拉宁的E-test试条均为法国生物梅里埃生物有限公司产品;PCR扩增试剂购于北京天根生化科技有限公司;全部引物由北京赛百盛基因技术有限公司合成。标准菌株粪肠球菌ATCC29212、粪肠球菌ATCC51299购自中国普通微生物菌种保藏管理中心。Vitek全自动微生物分析仪购自法国生物梅里埃公司;PCR System 9700购自美国ABI公司;Alpha Innotech凝胶成像仪;电泳仪购自美国Bio-rad公司。
3.菌株确认和VRE筛选:全部菌株复苏后经Vitek 2 Compact全自动微生物分析仪进行重新鉴定和药敏试验,质控菌株为粪肠球菌ATCC29212。采用含6μg/ml万古霉素的脑心浸液平皿筛选VRE,点种5μl浓度为0.5麦氏浊度的菌液,37℃温箱孵育24h,有菌落生长者为VRE。万古霉素敏感菌株对照为粪肠球菌ATCC29212,万古霉素耐药菌株对照为粪肠球菌ATCC51299。
4.VRE的耐药表型测定:采用E-test法检测筛选出的VRE对万古霉素和替考拉宁的最低抑菌浓度 (minimum inhibitory concentration,MIC),药敏判断标准参照2015CLSI-M100-S25文件[5]。
5.细菌DNA提取:挑取血平板上经纯培养后的VRE菌落适量,置入装有200μl 去离子水的1.5ml离心管中,混匀。100℃煮10min,迅速4℃冷却20min,12000r/min离心5min,取上清液作模板,-20℃保存备用。
6.耐药基因检测:采用本课题组之前报道的多重PCR法检测vanA、vanB及粪肠球菌和屎肠球菌特异的ddl基因片段(ddl-efa、ddl-efm),该法能同时检测菌株耐药基因以及在基因水平上进行菌种鉴定[6]。
7.毒力基因检测:目前,研究较多并认为与肠球菌致病性相关的因子主要包括肠球菌表面蛋白 (enterococcal surface protein,esp)、透明质酸酶 (hyaluronidase,hyl)、明胶酶 (gelatinase,gelE)、聚集物质 (aggregation substance,asa1) 和溶细胞素 (cytolysin,cylA)[7~9]。采用本课题组之前报道的多重PCR法检测上述5种毒力基因在粪肠球菌和屎肠球菌之间的分布频率及特征。
8.多位点序列分型 (MLST):根据已建立的MLST分型方法,分别对屎肠球菌 (adk、atpA、ddl、gdh、gyd、purK、pstS) 和粪肠球菌 (gdh、gyd、pstS、gki、xpt、aroE、yiqL)的7个管家基因进行扩增和测序分析,反应条件及引物序列参考MLST网站 (http:∥www.mlst.net)。所有PCR产物进行双向测序,并通过MLST数据库 (http:∥www.mlst.net) 和 eBURST v.3 软件(http:∥eburst.mlst.net) 进行序列型 (sequence type,ST) 和克隆复合群 (clonal complex,CC)的比对分析。
结 果
1.菌株确认和药物敏感度:经Vitek 2 compact微生物分析仪和种特异性基因双重鉴定后,从笔者医院血培养阳性标本中共收集到96株肠球菌,其中屎肠球菌68株(68/96, 70.8%),粪肠球菌28株(28/96, 29.2%)。所有菌株对11种抗菌药物的药敏试验结果见表1,其中屎肠球菌和粪肠球菌对氨苄西林的耐药率分别为88.2%和35.7%,对万古霉素的耐药率分别为29.4%和7.1%,提示屎肠球菌比粪肠球菌更易产生耐药株。多数菌株对临床常用抗菌药物大部分表现为耐药,但对利奈唑烷和替加环素均为敏感。粪肠球菌对奎奴普汀/达福普汀天然耐药,而屎肠球菌对奎奴普汀/达福普汀的耐药率为零。
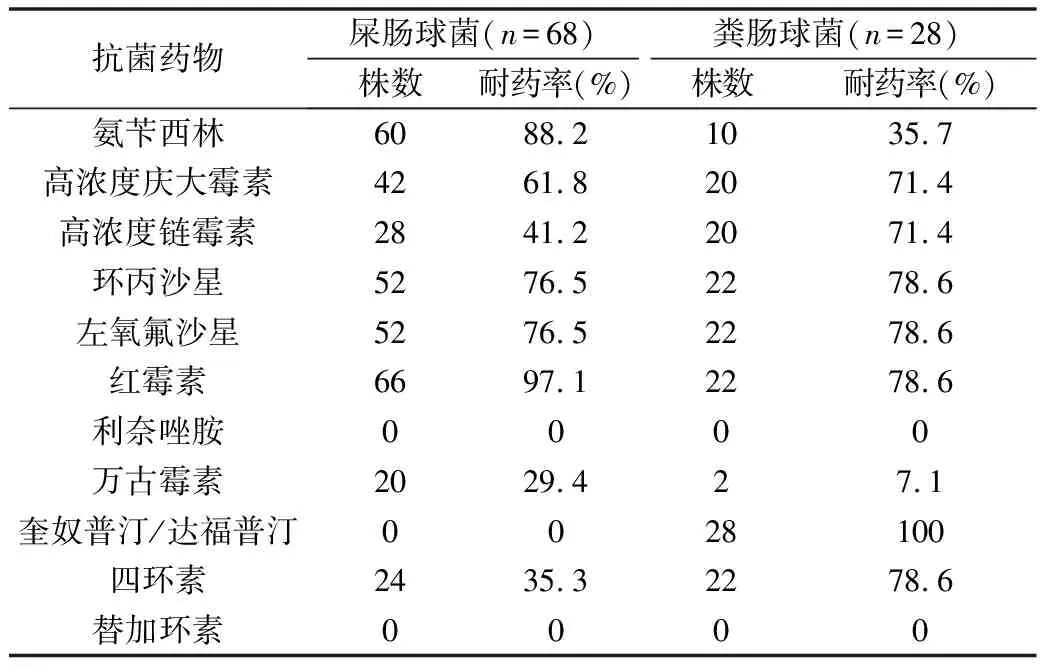
表1 血标本中分离的96株肠球菌对11种抗菌药物的耐药性
2.VRE筛选结果:经VRE筛选确认后,共检出22株VRE,包括20株屎肠球菌 (29.4%,20/68) 和2株粪肠球菌 (7.1%,2/28)。全部菌株分布于不同科室,其中老年病科和血液科分布最多,详见表2和表3。
3.VRE耐药表型和耐药基因检测结果:表型检测结果显示,22株VRE对万古霉素高度耐药,MIC均 ≥ 256μg/ml,对替考拉宁呈现不同水平耐药,MIC介于 16~256μg/ml。基因型检测结果显示,22株VRE均为vanA基因型,未检测出vanB基因。所有VRE耐药表型与基因型一致,属高水平耐药[8]。结果见表2和表3。
4.VRE毒力基因检测结果:20株屎肠球菌VRE仅检测到esp (16/20,80.0%) 和hyl (10/20,50.0%) 两种基因,其余3种均未检出;且10株hyl阳性菌株中,仅1例单独阳性,其余9例均与esp联合阳性。两种基因的4种分布模式检出情况分别为esp+/hyl+(9/20,45.0%),esp+/hyl-(7/20,35.0%),esp-/hyl-(3/20,15.0%)和esp-/hyl+(1/20,5.0%)。这种分布规律与本课题组前期报道的结果基本一致[5]。结果见表2。5种毒力基因在2株粪肠球菌VRE中的分布情况见表3,仅gelE和asa1阳性。其分布规律有待提高样本量后进一步研究。
5.VRE菌株MLST分型结果:经MLST和eBURST进行同源性分析后,20株屎肠球菌VRE共分为7个ST型,其中ST78 (8/20,40.0%) 和ST17 (6/20,30.0%) 为优势型别,其余6株分别为2株ST18型和 ST389、ST414、ST571、ST564型各1株;7种ST型均属于同一个克隆复合群CC17。2株粪肠球菌VRE为ST6型,属于CC2。结果见表2和表3。值得一提的是,8株ST78屎肠球菌VRE中,有5株的毒力基因分布模式为esp+/hyl-,占62.5%;6株ST17屎肠球菌VRE中,有5株的毒力基因分布模式为esp+/hyl+,占83.3%。这种特征未见其他文献报道,有待提高样本量后进一步确认。

表2 20株耐万古霉素屎肠球菌的表型、基因型、毒力基因和MLST分型结果
van.万古霉素;TEI.替考拉宁;ST.序列型;CC.克隆复合群
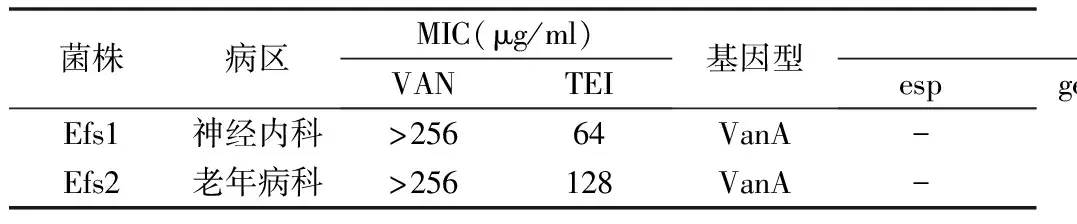
表3 2株耐万古霉素粪肠球菌的表型、基因型、毒力基因和MLST分型结果
van.万古霉素;TEI.替考拉宁;ST.序列型;CC.克隆复合群
讨 论
VRE的出现和迅速增多已成为全球公共卫生的重要威胁。在美国,屎肠球菌VRE的分离率已从1980年的0增长到2007年的80%,而粪肠球菌VER的分离率不到7%。欧盟耐药监测网2011年的数据显示屎肠球菌VRE和粪肠球菌VRE在29个国家的平均检出率分别为7.2%和1.0%,但不同国家间屎肠球菌对万古霉素的耐药率差异很大,最高可达34.9%。2010年澳大利亚耐药工作组的数据显示其屎肠球菌和粪肠球菌对万古霉素的不敏感度分别为36.5%和0.5%[9]。2015年中国细菌耐药监测网 (CHINET) 数据显示,粪肠球菌对万古霉素耐药率为0.8%,屎肠球菌对万古霉素耐药率为2.9%,其中耐药率最高的是北京市,达到11.2%[10]。而笔者医院屎肠球菌VRE和粪肠球菌VRE的分离率分别高达29.4%和 7.1%,远高于全国平均水平(表1)。基于以上背景,本研究对2012年7月~2015年7月期间分离自笔者医院血培养标本中的22株VRE进行耐药基因型、毒力基因和MLST分析,以期为应对VRE感染提供支持和参考。
目前,根据耐药性连接酶结构基因的主要序列不同,将VRE分为vanA、vanB、vanC、vanD、vanE、vanG、vanL、vanM和vanN共9种耐药基因型,其中van (A、B、D、G、L、M和N) 属于获得性耐药,而vanC和vanE属先天性耐药。上述不同基因型在不同地区不同时期流行率不尽相同,医院内流行的主要是vanA和vanB型,vanA型对万古霉素和替考拉宁均耐药,vanB型对万古霉素耐药而替考拉宁敏感[8,9,11]。本研究中全部VRE菌株均为vanA型,占主导地位,与国内外报道一致[9,11,12]。CHINET在2014年可分型的101株VRE中,共检出vanA、vanB和vanM 3种基因型,分别占37.6%、39.6%和22.8%[13]。VanM型自2006年于上海一所教学医院首次分离后,逐渐在上海地区占据主导地位,但在我国其他地区和其他国家仍未见报道,可能与目前的检测技术多针对vanA和vanB型,而未针对vanM型有关[11,12]。本研究所用方法亦未检测vanM型,北京和上海人员交流往来频繁,极有可能发生vanM型的传播,提示在今后研究中应重视vanM型VRE的检测。
MLST技术是一种基于核酸序列测定的基因分型方法,选用6~10个管家基因 (多数为7个) 进行序列分析,通过序列的变化反映菌株之间的进化关系,具有较高的分辨率,可通过网络实现实验室间数据共享及比对,且该法具有一套标准化的技术,在不同实验室间重复性较好,已广泛用于细菌基因分型研究[14]。应用MLST技术对屎肠球菌和粪肠球菌进行同源性分析已非常成熟,研究发现,存在与医院内感染密切相关的克隆复合群,屎肠球菌为CC17,粪肠球菌为CC2和CC9[9,15]。属于CC17的屎肠球菌具有如下特征:①对氨苄西林和喹诺酮类药物高水平耐药;②可通过获得vanA或vanB基因对万古霉素产生耐药;③大多数携带esp和(或)hyl毒力基因;④上述耐药和毒力基因可在细菌间水平传播。因此,CC17群屎肠球菌可高度适应医院内环境,引起全球范围内广泛流行,应引起高度重视[15]。本研究的MLST结果显示,20株屎肠球菌VRE共检出7个ST型,且均属于CC17,以ST78 (8/20,40.0%) 和ST17 (6/20,30.0%) 为优势型别,与国内外报道一致[15,16]。本研究仅检出2株粪肠球菌VRE,MLST分型为ST6 (CC2),并未检出亚洲流行型别ST4 (CC4)[9]。由于粪肠球菌对万古霉素的耐药率较低,对该类菌株分子特征的研究资料有限,有待于扩充样本量后进一步研究。
VRE已成为院内感染的重要致病菌,临床感染以粪肠球菌和屎肠球菌多见。尽管临床上肠球菌属感染具有一些共性,但越来越多的研究者认为,屎肠球菌和粪肠球菌具有不同的感染模式。有研究发现,由屎肠球菌引起的血流感染比粪肠球菌引起的血流感染具有更高的病死率,这与屎肠球菌对万古霉素耐药率高有密切关系[17]。因此,应加强对VRE耐药机制和分子特征的研究,为预防和控制VRE的感染和传播提供数据支持。
