长链非编码RNA HOTAIR在宫颈癌中的研究进展
2019-05-24黄迪南
李 欣 侯 敢 黄迪南
宫颈癌(cervical cancer,CC)作为最常见的妇科恶性肿瘤之一,在女性癌症相关的死亡中仅次于乳腺癌。在诊断的时候,80%的患者已经发展浸润性癌,而且患病的年龄也在年轻化。由于复发和转移,宫颈癌仍具有很高的发生率和病死率[1]。因此,寻找可靠的肿瘤标志物以及新的靶向治疗手段对于提高患者的生存率意义重大。许多长链非编码RNA(long non-coding RNA,lncRNA)已被证实在宫颈癌和其他癌症中起着重要的调控作用。
一、lncRNAs作为宫颈癌的新型主要调节剂
lncRNA是由RNA聚合酶Ⅱ转录,非蛋白编码RNA(non-coding RNA,ncRNA)家族中长度> 200个核苷酸的长ncRNA。起初被认为是基因组转录的“噪音”,不具有生物学功能。但近年来的研究表明,lncRNAs已经成为新型的主要调节剂,活跃于各种实体瘤和血液恶性肿瘤的治疗起始、进展和反应等[2]。截至2018年5月,使用lncRNA和宫颈癌作为关键词在PubMed和中国知网中搜索产生了十几种已在宫颈癌中单独检测的lncRNAs(表1)[3~21]。它们具有很大的描述性和相关性,这些文章突出了lncRNA在宫颈癌中的关键作用。被探讨的这些lncRNAs调节宫颈癌的关键细胞过程,如凋亡、增殖和侵袭。此外,这些lncRNA表达失调与宫颈癌患者的转移,晚期病理分期和预后不良等相关。其中,lncRNA 同源盒基因转录物反义RNA(homeobox gene transcript antisense RNA,HOTAIR)对宫颈癌作用的吸引了研究者们的强烈关注[3~10]。在此笔者回顾HOTAIR在宫颈癌中的最新文献,强调其在宫颈癌中的表达意义及调节的分子机制。宫颈癌相关lncRNAs生物学功能以及与这些lncRNAs相关的临床特征见表1。
二、发现HOTAIR基因
人类同源盒基因(homeobox gene, HOX)编码转录因子的调节基因,主要包括HOXA、HOXB、HOXC及HOXD 4类,在胚胎发育中起重要作用。HOTAIR是由Rinn等[22]首次发现的一条以反式作用沉默染色质调控基因表达的特殊lncRNA。人HOTAIR基因位于第12号染色体上HOXC簇中HOXC11和HOXC12之间的基因间区域(图1)[23]。其主要转录物是从6449bp基因座转录,并由6个外显子(5个短外显子和1个长外显子)组成的2364bp RNA。
HOTAIR在5′端能够招募多克隆抑制复合物2(polyclonal inhibition complex,PRC2)来抑制同源框基因D簇(HOXD)的表达[24]。组蛋白修饰对于转录激活至关重要,PRC2含有zeste homolog 2(EZH2)增强子,这是一种组蛋白甲基转移酶,可通过组蛋白H3第27位赖氨酸三甲基化(histone H3 27th lysine trimethylation,H3K27me3)标记转录抑制基因。HOTAIR与基因组中富含GA的基序结合,以形成PRC2占位的广泛结构域和随后的H3K27me3。其3′端结合到含有赖氨酸特异性脱甲基酶1(lysine-specific demethylase 1,LSD1)的复合物上,LSD1是一种组蛋白脱甲基酶,并通过组蛋白H3第4位赖氨酸二甲基化(histone H3 4th lysine demethylation,H3K4me2)作用使基因表达失活。HOTAIR功能详情见图2。小鼠HOTAIR基因的缺失导致HOXD簇的去阻遏,其与HOXD基因启动子处H3K27me3的占据减少以及由EMT.上皮间充质转化; MALAT1.肺腺癌转移相关转录本;ANRIL.位点反义非编码RNA;UCA1.尿路上皮癌抗原l;SRA.类固醇受体RNA激活因子转录本;H19.母系印记基因转录本;lincRNA-p21.大基因间非编码RNA;MEG3.母系表达基因3;TUSC8.抑癌候选基因8;GAS5.生长停滞特异性转录本5;lncRNA-LET.肿瘤低表达的lncRNA。↑表示增加,↓表示降低于HOTAIR介导的PRC2和LSD1募集的丧失而增加的H3K4me2的占据相关[25]。
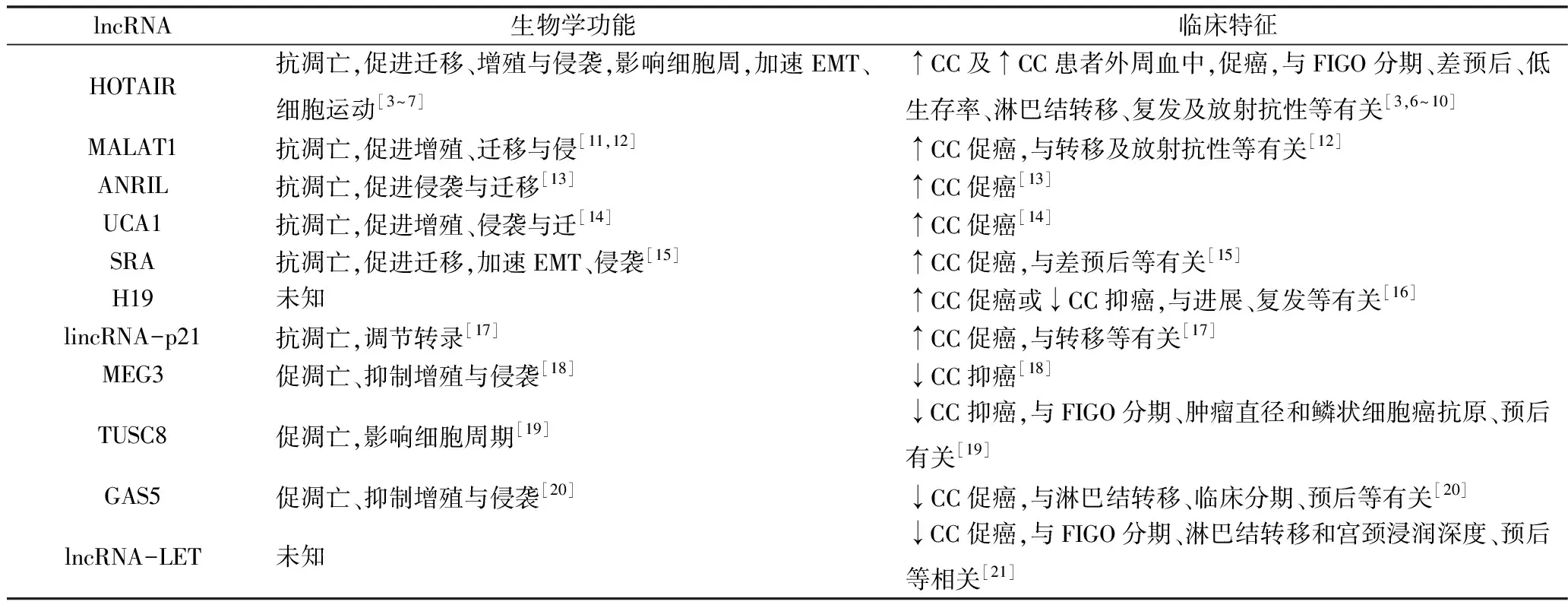
表1 lncRNAs调节宫颈癌的概况
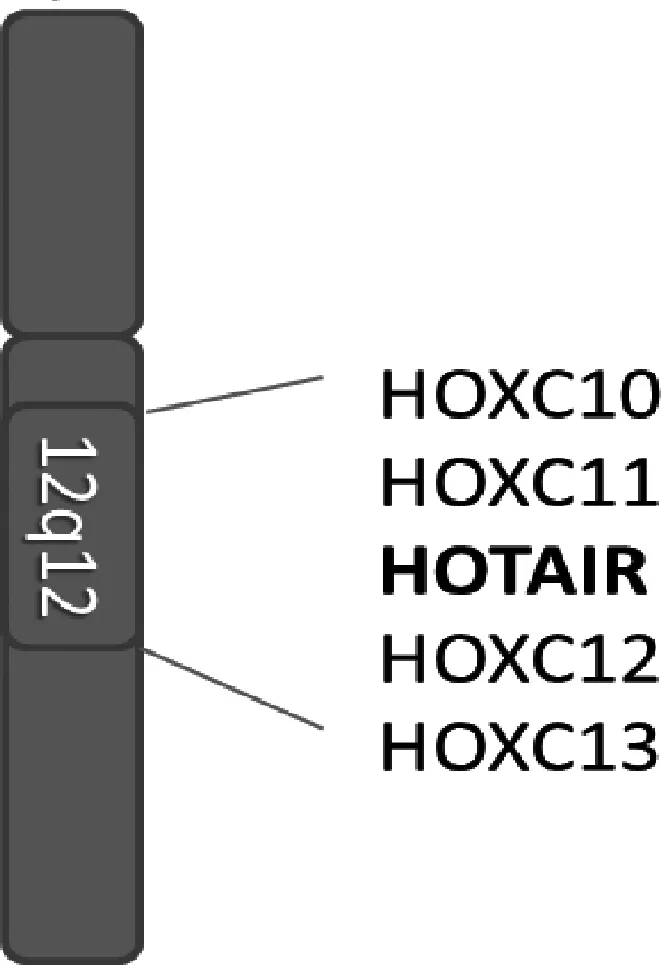
图1 HOTAIR在人类12号染色体上的位置
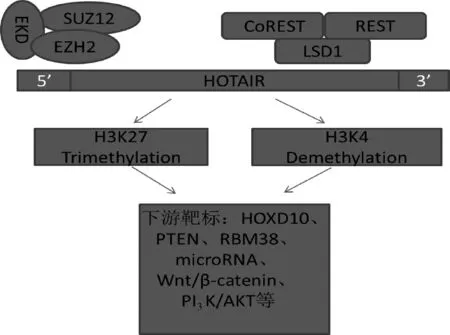
图2 HOTAIR功能的示意图SUZ12、EED和EZH2是PRC2综合体的3个组成部分; CoREST、REST和LSD1是LSD1 / CoREST / REST复合体的3个组件
三、HOTAIR在宫颈癌中的表达
国内外多项研究表明,无论与癌旁组织或细胞,还是与非肿瘤组织或细胞,亦或是与宫颈上皮内瘤变的组织比较,HOTAIR在宫颈癌组织和细胞系中均显著高表达。HOTAIR在组织与细胞中的升高抑制细胞凋亡并促进细胞增殖、迁移和侵袭并影响细胞周期进程,并诱导放射抗性[3~6,8~10]。Jing等[26]表明了在宫颈癌HeLa细胞株中诱导HOTAIR的过表达可通过抑制p21的表达增加放射抗性,而在C33A细胞株中干扰HOTAIR的表达可上调p21并增加其放射敏感度。宫颈癌细胞中上调HOTAIR表达促进宫颈癌细胞的增殖,迁移和侵袭,而敲低HOTAIR表达则抑制细胞侵袭和细胞活力,诱导细胞凋亡并在体内和体外抑制生长。例如,郑婷华等[3]在宫颈癌HeLa细胞中干扰HOTAIR的表达后,HeLa细胞增殖明显减慢,48、72和96h的抑制率分别为20%、24.6%和33.1%;细胞周期被阻滞于G0/G期;HOTAIR干扰组细胞凋亡比例为12.37%±2.74%,高于对照组的5.94%±1.27%(P<0.01)。HOTAIR不仅癌组织和细胞中表达水平升高,而且血清中表达水平亦升高,且术后较术前、放化疗后较放化疗前表达均显著下降[7,10,27]。血清中增加的HOTAIR表达与FIGO分期,淋巴结转移,淋巴血管间隙侵犯,宫颈浸润深度,肿瘤直径和年龄密切相关,且患者的总体存活和无病存活显著低于具有较低HOTAIR表达的那些患者[7, 8, 10]。Zhang等[28]还发现,宫颈癌患者阴道灌洗液外泌体中的HOTAIR水平也较正常人升高,使得无创法检测宫颈癌患者的HOTAIR水平成为可能。
四、HOTAIR调节宫颈癌生物学功能的机制
1.HOTAIR与宫颈癌细胞增殖、迁移及侵袭的机制:HOTAIR调节血管内皮生长因子(vascular endothelial growth factor,VEGF),基质金属蛋白酶-9(matrix metalloprotein 9,MMP-9)和EMT相关基因的表达,和Notch-Wnt信号转导途径相关基因的表达,这些基因对细胞运动和转移至关重要。因此,HOTAIR可能通过上调VEGF和MMP-9和EMT等相关基因来促进肿瘤侵袭性[7]。巨核细胞白血1(megakaryocyte leukemia 1,MKL1)作为转录共同因子诱导宫颈癌细胞迁移和侵袭。作为miR206的靶向基因的MKL1的表达水平在HeLa细胞中HOTAIR受抑制后减少。HOTAIR抑制也可以加速MKL1在细胞质中的表达,而且,MKL1可以通过结合HOTAIR启动子中的CArG盒来激活HOTAIR的转录。表明HOTAIR和MKL1之间存在正反馈回路。总之,这些发现表明MKL1是HOTAIR在癌细胞迁移和侵袭中功能的重要参与者[29]。HOTAIR启动子的分析揭示,信号转导子及转录激活子3(signal transducer and activator of transcription3,STAT3)可能调节HOTAIR在宫颈癌细胞中的活性,STAT3的抑制对宫颈癌细胞的增殖,迁移和侵袭具有与HOTAIR相似的作用。STAT3和HOTAIR可协同抑制细胞的增殖、迁移和侵袭[6]。
2.HOTAIR作为竞争性内源RNA的机制:HOTAIR通常通过竞争性内源RNA(competitive endogenous RNA,ceRNA)机制在宫颈癌中起作用。HOTAIR通过竞争性结合miR-148a调节人类白细胞抗原-G(human leukocyte antigen-G,HLA-G)的表达[4]。HLA-G分子使肿瘤细胞能逃避NK细胞和CTL细胞的杀伤,从而间接促进肿瘤细胞。在宫颈癌组织和细胞系中HOTAIR表达升高而miR-143-3p表达降低。 HOTAIR通过靶向调节B淋巴细胞瘤-2基因 (B-cell lymphoma-2,Bcl-2)促进宫颈癌的进展,Bcl-2过表达减弱了miR-143-3p在宫颈癌中的肿瘤抑制效应,从而促进宫颈癌细胞生长[30]。在宫颈癌组织和细胞系中,miR-17-5p表达下调,Pearson相关分析表明,miR-17-5p的表达与HOTAIR呈负相关,HOTAIR通过扩大miR-17-5p在宫颈癌中的促肿瘤作用, HOTAIR可以竞争性结合miR-23b并间接调节宫颈癌细胞中丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)的表达,后者可调节肿瘤细胞凋亡与增殖等[5,31]。
五、HOTAIR与单核苷酸多态性
单核苷酸多态性(single nucleotide polymorphism,SNP)可影响性肿瘤中的HOTAIR表达和癌症倾向性,Qiu等[32]研究了中国人群中rs920778状态与宫颈癌易感性之间的关联,发现rs920778的TT基因型与HOTAIR的上调显著相关,还发现rs920778的TT基因型与晚期肿瘤分期,高度组织学分级,淋巴结转移和高危HPV有关,而且在接受同步放化疗的患者中,TT基因型携带者对EBRT+ICBT+顺铂组合的耐药性显着。与GG/GC基因型比较,rs7958904 CC基因型与宫颈癌风险增加相关(OR=1.57,95% CI:1.10~2.25)。TCGA数据库显示rs7958904 CC基因型CC组织的HOTAIR表达高于GG基因型(P=0.046)。MTT分析显示rs7958904 C等位基因对CC细胞的生长促进作用。HOTAIR rs7958904可能通过调节CC细胞增殖影响CC易感性[33]。深入研究发现,HPV感染但低表达HOTAIR的宫颈癌患者多存在HOTAIR rs2366152C变异本[OR=2.58,95%CI:1.23~5.57,P=0.014],且这部分患者中miR22表达上调。rs2366152C转录本位于HOTAIR的LSD1结合区域,miR22特异性结合到rs2366152C导致HOTAIR表达降低可阻断HOTAIR介导的基因沉默。rs2366152C有潜力成为缺乏转HOTAIR的宫颈癌病例的标志物[34]。
六、HOTAIR在宫颈癌中的临床潜力及挑战
1.HOTAIR可作为宫颈癌的生物标志物:HOTAIR在宫颈癌患者的肿瘤组织中、肿瘤细胞中、阴道灌洗液中和外周血中均升高。使得HOTAIR有可能成为宫颈癌诊断、预后、复发和预后的生物标志物。检测阴道灌洗液和血清中HOTAIR有可能成为宫颈癌的筛查、随访监测及预后评估的有效方法,同时可依据血清中及组织中的HOTAIR表达水平判断FIGO分期,淋巴结转移,淋巴血管间隙侵犯,宫颈浸润深度,肿瘤直径等。以HOTAIR作为预后的生物标志物为例,受试者工作特征曲线 (receiver operating characteristic curve,ROC)分析显示HOTAIR表达是区分肿瘤组织与非肿瘤组织以及是否存在淋巴结转移(敏感度85.1%,特异性64.9%)的良好候选者。ROC曲线下面积分别为0.803(95%CI:0.762~0.839,P=0.000)和0.802(95%CI:0.742~0.852,P=0.000)[8]。但HOTAIR的表达水平与宫颈癌进展、预后及复发之间的精细关系仍待进一步深入研究,还有如何灵敏、便捷的检测HOTAIR表达量也待进一步研究。
2.HOTAIR作为宫颈癌的治疗靶点:通过RNA干扰技术干扰宫颈癌中HOTAIR的表达可以有效诱导凋亡,抑制癌细胞增殖、侵袭和细胞活力等。因此HOTAIR有望成为治疗宫颈癌的有效靶点,结合单核苷酸多态性的检测可以指导患者的化疗用药。有研究表明,丙泊酚可通过抑制宫颈癌HOTAIR介导的mTOR/p70S6K通路抑制肿瘤直径,细胞活力,促进细胞凋亡[35]。但类似丙泊酚这种HOTAIR抑制剂对正常细胞是否有影响及高敏感度、特异性的靶向HOTAIR的药物尚未见报道。目前对HOTAIR引起宫颈癌生物学功能变化的机制研究虽取得一定进展,但精细的调节方式仍待进一步研究。总之,虽然HOTAIA在宫颈癌的临床应用上展现良好的前景,但距离临床实践仍任重而道远。
