TAMIS与传统术式治疗直肠肿瘤效果的临床对比研究
2019-05-24宋志岗连彦军薛志广宋炳辉
宋志岗 刘 帅 连彦军 薛志广 宋炳辉
直肠肿瘤是常见的消化道肿瘤,发生率仅次于胃癌和食道癌,在我国的发生率也逐年上升[1,2]。我国直肠肿瘤存在自身的流行病学特点,表现为青年人比例高、低位所占比例高等[3,4]。当前对于直肠肿瘤的治疗主张合理的综合治疗,其中手术切除仍然是直肠肿瘤主要的有效治疗方法,不过直肠中、上段肿瘤的治疗一直是一个难题[5,6]。传统的经肛门手术只能对距离肛门6cm 以内的病变进行治疗,中上段直肠病变距离肛门较远,传统经肛门手术无法操作[7]。经纤维内镜切除手术只能对较表浅病变进行黏膜或黏膜下切除,切除的组织破碎不完整,不能实施肠壁全层切除。经肛门微创治疗直肠肿瘤(transanal minimally invasive surgery,TAMIS)是将单孔腹腔镜通道置入肛管,利用常规腹腔镜器械经肛门途径完成直肠肿瘤局部切除和根治手术,一种经肛门微创手术(不需经腹,体表无切口),提供了优良的肿瘤暴露视野[8~10]。TAMIS适用于距肛门12cm 以下的内镜不能切除的直肠腺瘤及早期直肠癌,具有创伤小、花费低、并发症小、恢复快的优势[11,12]。TAMIS 目前只在国内少数大型医院进行实验性开展。本研究收集在邢台市第三医院住院接受直肠肿瘤局部切除的患者100 例,比较TAMIS与传统术式治疗直肠肿瘤的临床治疗效果,希望为推广使用TAMIS提供参考,现报道如下。
对象与方法
1.研究对象:收集2016年1月~2017年9月在邢台市第三医院住院接受直肠肿瘤局部切除的患者100例。(1)纳入标准:患者与家属知情同意本研究;术前检查确认为肿瘤据肛缘12cm以内的直肠腺瘤或早期直肠癌;早期直肠癌经超声内镜确定位于黏膜层或黏膜下层,肿物基底宽度<1/2直肠管径;前胸片、腹部CT 提示直肠癌无远处转移;具有手术治疗指征;所有患者全身基础状态良好,未合并严重心脏、肺组织等器质性疾病;研究得到医院医学伦理学委员会的批准。(2)排除标准:多发性肿瘤;妊娠与哺乳期妇女;肠周组织受侵、明显淋巴结肿大或远处转移。根据手术方法的不同分为观察组与对照组各50例,两组患者的性别、年龄、体重指数、肿瘤直径、病理类型、临床分期等比较,差异无统计学意义(P>0.05),详见表1。

表1 两组一般资料比较
2.手术方法:观察组行TAMIS 术式治疗,对照组行传统手术方法治疗。常规肠道准备,选择全麻或椎管内麻醉,体位采取截石位或折刀位,消毒铺单后扩肛3 指,置入单孔多通道器械,调节气腹机维持二氧化碳压力12mmHg,经套管置入腹腔镜镜头,沿肿物边缘切除肿物(图1),将切缘及基底部送术中冷冻;传统经肛门直肠肿物切除,扩肛后沿肿物边缘切除肿物,将切缘及基底部送术中冷冻。直肠腺瘤采取黏膜下切除,早期直肠癌可切除肠壁全层,并缝合创面(图2)。

图1 定位病灶,并用电刀将肿瘤完整切除

图2 用倒刺线缝合切口
3.观察指标:记录两组的肿瘤位置与标本切缘阴性率;记录两组的手术时间、术中出血量、术后住院时间与术后胃肠道恢复时间等;记录两组术后尿潴留、出血、切口裂开、大便失禁等并发症情况;所有患者随访至今,记录两组的无病生存率与总生存率。
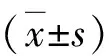
结 果
1.肿瘤位置与标本切缘阴性率比较:两组患者术后病理标本的切缘均未发现肿瘤细胞残留,标本切缘阴性率均为100%。观察组肿瘤距肛门距离平均为7.83±3.61cm,对照组为3.94±1.33cm,观察组多于对照组(t=9.834,P<0.05)。
2.围手术指标比较:两组手术时间与术中出血量比较差异无统计学意义(P>0.05),观察组术后住院时间与术后胃肠道恢复时间低于对照组(P<0.05),详见表2。
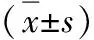
表2 两组围手术指标比较
3.并发症比较:观察组术后1个月的尿潴留、出血、切口裂开、大便失禁等并发症发生率为2.0%,对照组为20.0%,观察组低于对照组(χ2=8.763,P<0.05),详见表3。

表3 两组术后并发症比较[n(%)]
4.生存情况比较:通过门诊与电话随访,随访截止时间为2018年1月,所有患者都得到了随访,两组的无病生存率和总生存率比较,差异无统计学意义(P>0.05),详见表4。
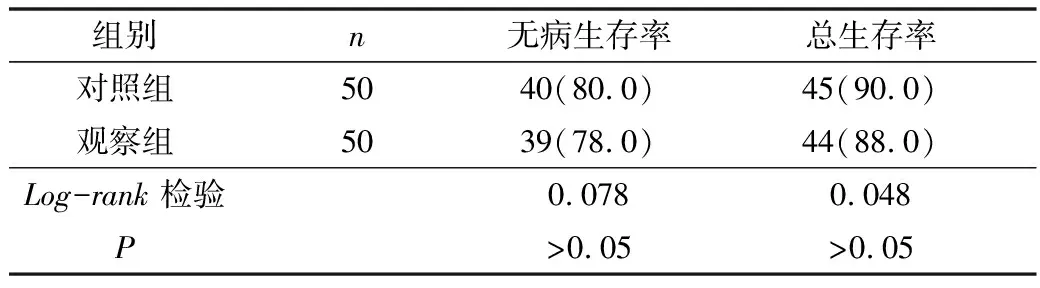
表4 两组随访生存率Kaplan-Meier法分析比较[n(%)]
讨 论
目前,直肠肿瘤的检出率越来越高,根治性切除手术为早期诊治直肠肿瘤的方法,但是手术范围比较大,对于患者的创伤也比较大[13]。直肠肿瘤是经肛门手术的适应证,但传统的经肛手术只能对距离肛门6cm以内的病变进行治疗,中、上段直肠病变距离肛门较远,已经超越了经肛手术能及的极限,因此,对于中、上段直肠肿瘤治疗往往只能通过肠镜进行黏膜或黏膜下切除,但切除的组织破碎不完整,而且不能实施肠壁全层切除,仅适用于直肠良性腺瘤,也容易导致患者手术创伤大,术后并发症发生概率高、住院花费相应也较高,患者的恢复时间和住院时间较长。
TAMIS是将单孔腹腔镜通道置入肛管,利用常规腹腔镜器械经肛门途径完成直肠肿瘤局部切除和根治手术一种经肛门微创手术[14]。其操作原理与经肛门内镜切除(transanal endoscopic microsurgery,TEM)术式类似,主要适用于中远段直肠早期癌、内镜不能切除的直肠腺瘤,具有根治性好,恢复快的优势[15,16]。TAMIS手术不但可以用于治疗直肠良性肿瘤、早期直肠癌、黏膜下肿瘤,还可以用于部分全身合并症较多无法耐受大手术的进展期直肠癌,以及直肠狭窄、吻合口瘘、直肠阴道瘘等疾病的治疗。
本研究显示两组患者术后病理标本的切缘均未发现肿瘤细胞残留,标本切缘阴性率均为100%。观察组肿瘤距肛门距离平均为7.83±3.61cm,对照组为3.94±1.33cm,观察组多于对照组。从机制上分析,对照组患者的术中病灶暴露差,特别是手术器械的触及范围被限制于直肠中下段,导致直肠上段的肿瘤多需经腹切除,不利于术后康复[17]。而TAMIS可清晰探查直肠各处甚至乙状结肠下段,使得距离肛门较远的肿瘤也得以在镜下准确切除,可避免肠段切除吻合[18]。
目前直肠肿瘤患者较多,多采用传统经直肠肿瘤切除或经腹切除,手术创伤大,并发症多,尤其传统经肛门切除操作空间小,容易导致出血等[19]。本研究显示两组手术时间与术中出血量比较,差异无统计学意义,观察组术后住院时间与术后胃肠道恢复时间低于对照组。观察组术后1个月的尿潴留、出血、切口裂开、大便失禁等并发症发生率为2.0%,对照组为20.0%,观察组低于对照组,表明TAMIS的应用能促进患者康复,减少术后并发症的发生。特别是TAMIS不必购买昂贵的TEM手术器械,具有腹腔镜手术基础的医疗机构均可开展,若熟练掌握此项技术并日益完善,使经肛门直肠肿瘤切除术野更广阔,操作更精确,可逐步应用于直肠腺瘤、早期直肠癌、性质不明确的直肠肿瘤或黏膜病变,甚至可应用于直肠癌全系膜切除[20,21]。也有研究表明TAMIS可能并不是对全段的直肠肿瘤都适用,对于距肛门20cm以上的肿瘤无法充分暴露和观察,可能会影响手术的正常操作[22]。
直肠肿瘤的术后疗效也可受病例选择、肿瘤分期、是否接受辅助放疗化疗以及随访时间的影响[23]。TAMIS术就是利用腹腔镜器械和摄像头,视野清晰,经肛门局部完整地切除直肠肿瘤,全层切除,再进行全层缝合,具有创伤小、恢复快,不影响术后肛门排便功能等优点。本研究显示所有患者都得到随访,两组的无病生存率和总生存率比较,差异无统计学意义。主要在于TAMIS提供了优良的肿瘤暴露视野,允许对距肛缘更远的直肠肿瘤行更准确的切除。TAMIS还可以用于环肠腔病变的节段性切除和吻合,也拓宽了TAMIS的手术适应证。不过在手术中,需要术者具备熟练的腹腔镜操作技术及配套设备;选择适合的二氧化碳气压,既能良好暴露,有不至于使结肠过度膨胀。沿肿物边缘0.5~1.0cm 切除肿物,创面精细缝合及止血。
综上所述,相对于传统术式,TAMIS与治疗直肠肿瘤效果可将直肠中下段肿瘤的局部切除,肿瘤切除切缘阳性率低,能促进患者康复,降低术后并发症的发生,且不会增加患者的病死率。
