水热法制备Zn0.2Cd0.8S/rGO材料及其光催化性能
2019-05-24殷立雄李慧敏白培杰宋佳琪
殷立雄, 张 峰, 李慧敏, 白培杰, 宋佳琪
(陕西科技大学 材料科学与工程学院, 陕西 西安 710021)
0 引言
在当今社会,能源危机和环境问题是人类创建环境友好型和可持续发展社会所面临的两大问题,这就需要对所制备的材料在储能与环境清洁中的应用进行开创性的研究[1-3],与此同时,由于对能源需求的不断增长亦同样迫切要求人类必须寻求新的清洁、可持续能源.与其他化石能源相比,氢能(H2)以其无毒性和高能量密度被认为是未来潜在的领导者[4-7].利用半导体光催化技术在可见光照射下将太阳能转化为化学能的这种方法具有绿色可持续且高效环保的优点,这为科研工作者们利用太阳能发掘新能源和治理环境污染问题提供了一个崭新的思路.
由于可见光在太阳能光谱中所占的比例远远大于紫外光,因此近些年来在光催化领域发展出了用于H2生产和降解有机染料的各种可见光驱动半导体光催化剂[8,9].在众多的光催化剂中,ZnxCd1-xS固溶体微纳米材料由于其具有较高的催化性能潜力,近年来成为研究热点.ZnxCd1-xS材料是一种典型的固溶体半导体材料,由于Zn2+的离子半径(0.74 Å)小于Cd2+(0.97 Å),可以使固溶体原子间的连接更强,提高CdS的光稳定性[10,11].其独特的物理和化学性质表现出可调的光学和电学性质,在光催化、二极管、高密度光记录等领域具有广泛的应用[12,13].
更重要的是,ZnxCd1-xS固溶体系的能带结构和可见光光反应活性可以通过调整Zn/Cd原子比来改变.Jin等[14]采用水热法,以CMC作为模板剂,通过氨水来调节反应体系的PH,得到了具有空心球结构的ZnxCd1-xS固溶体材料,在可见光下1 h内即可完全降解Rh B.Zhong hui Han等[15]采用TGA(巯基乙酸)来制备一维纳米线状的Zn0.2Cd0.8S固溶体材料,在可见光下产氢性能为157.46 umol h-1,展示出了良好的光催化产氢性能.Hong Liu等[16]通过将g-C3N4与Zn0.2Cd0.8S固溶体进行复合,来提升其光催化产氢性能,结果表明,当g-C3N4的加入量为Zn0.2Cd0.8S的20 wt%,其产氢性相较纯相Zn0.2Cd0.8S提升了1.6倍,降解Rh B性能提升了2.5倍.
石墨烯由于具有优异的电子输运性能和极高的比表面积,是一种非常理想的二维催化剂载体[17,18].近年来,人们尝试将石墨烯与半导体光催化剂结合,以提高光催化制氢性能.在此,本文采用石墨烯材料来作为载体进行反应,以期提升材料的光催化产氢性能.但是,三维棒状组装的微球装的Zn0.2Cd0.8S固溶体与石墨烯复合报道较少.本文报道了一种通过两步水热法合成制备的三维自组装Zn0.2Cd0.8S/rGO材料,来作为一种高效的可见光驱动光催化剂,进而应用于水裂解制氢反应.通过在反应体系中确定最佳的rGO的加入量,从而实现了Zn0.2Cd0.8S/rGO材料的光催化H2性能的提升,在rGO加入量为1.5 mg时,在一个反应周期其产氢性能较纯相的Zn0.2Cd0.8S固溶体提升了2.64倍,可以达到1 117.3μmol g-1.
1 实验部分
1.1 实验材料
实验中采用的原材料有:二水合醋酸锌(分析纯)、四水合硝酸镉(分析纯)、L-半胱氨酸(分析纯)、乙二胺(分析纯)、氧化石墨烯(分析纯)、无水亚硫酸钠(分析纯)、九水合硫化钠(分析纯).
1.2 表征测试
本实验采用日本Rigaku公司生产X射线衍射仪(D/max2200PC型X-Ray Diffractometer)对样品的晶相组成和物相定性测定.
采用场发射扫描电子显微镜(SEM,Hitachi S4800)和透射电子显微镜TEM(Tecnai G2 f20)观察样品的微观形貌.
采用美国安捷伦公司所产型号为Cary 5000的紫外-可见-近红外分光光度计对样品进行光学特性表征.其中,BaSO4被用来作为标准参考样.
显微共焦激光拉曼光谱(Raman)采用德国Renishaw公司的Renishaw-invia型拉曼光谱仪对材料中的碳成分的有序化程度进行分析.激光器波长为532 nm,光谱重复性为±0.2 cm-1,扫描范围为900~3 200 cm-1.
价带谱采用Kratos Axis Ultra DLD型X光电子能谱仪对材料的表面化学组成来进行测试,聚焦单频Al作为Kα辐射源
1.3 Zn0.2Cd0.8S/rGO材料的制备
反应中所有原料均为分析级,并没有经过进一步的纯化,以分析级的Zn(CH3COO)2·2H2O、Cd(NO3)2·4H2O、乙二胺(EN)、L-半胱氨酸、氧化石墨烯(GO)为原料.首先将GO在H2O和乙醇的混合溶剂30 mL(水和已醇的体积比2∶1)中进行超声处理6 h后转移至100 mL的聚四氟乙烯内衬的不锈钢高压釜.将釜密封在水热的条件下180 ℃反应6 h后自然冷却至室温.反应后的产物进行离心,在此过程中用去离子水和无水乙醇多次洗涤后在80 ℃的真空干燥箱中进行干燥8 h,干燥完成后的产物备用.
第二步将0.3 mmol Zn(CH3COO)2·2H2O和1.2 mmol Cd(NO3)2·4H2O溶于40 mL去离子水和10 mL EN的混合溶剂中.并在室温下磁力搅拌30 min,然后将3.0 mmol·L-半胱氨酸在剧烈搅拌30 min后缓慢分散到上述溶液中,搅拌下形成悬浮液体.而后各个所配溶液中加入第一步反应处理过所得到的还原氧化石墨烯(rGO), rGO加入量分别为0 mg、0.5 mg、1.5 mg、2.0 mg和4.0 mg.之后将悬浮溶液转移至100 mL的聚四氟乙烯内衬不锈钢的高压釜.将高压釜密封,在水热的条件下180 ℃反应12 h,反应完成后自然冷却至室温.最终,将反应的沉淀物进行抽滤,在此过程中用去离子水和无水乙醇多次洗涤后在80 ℃的真空干燥箱中进行干燥12 h,进行干燥后即可得到产物Zn0.2Cd0.8S/rGO材料.
Zn0.2Cd0.8S/rGO材料在下文中标记为ZCS-G(x),其中x代表rGO的加入量.因此,不同加入量ZCS-x分别记为ZCS-G(0)、ZCS-G(0.5)、ZCS-G(1.5)、ZCS-G(2.0)、ZCS-G(4.0).最终即可得到具有纳米球状形貌负载于片状结构上的的ZCS-G(x)材料粉体,并对合成产物进行一系列表征与测试.
1.4 光催化产氢性能测试
在常温常压200 mL耐热玻璃烧瓶中进行了水裂解光催化产氢,用硅橡胶隔层密封烧瓶开口.实验采用300 W氙灯(MICROSOLAR 300)与截止滤光片垂直辐照浆料,在实验过程中将光切断在420 nm以下,反应系统温度保持在6 ℃.
在一个典型的光催化制氢实验中,在含有0.35 M Na2S和0.25 M Na2SO3的100 mL浆液中,30 mg催化剂在强搅拌下分散0.5 h.在光催化实验进行之前,浆料被转移到石英烧瓶中.以确保反应系统(Labsolar-6A PerfectLight,北京)脱氧,它可以用吸尘器吸尘真空泵为0.3 h.10 mL标准N2和H2是间歇采样通过隔膜来制备校准线,然后将产生的与校准线相比,生成的氢气是由气相色谱仪测GC-7890B,安捷伦,美国(氮气作为载气和5 Å分子筛列).所有的玻璃器皿在使用前都要用蒸馏水仔细清洗.
2 结果与讨论
2.1 物相结构分析
图1展示了不同氧化石墨烯加入量后所制备的Zn0.2Cd0.8S/rGO样品的XRD图谱.当加入量为0 mg时,从图1可以清晰地看到,所有衍射峰都与JCPDS(41-1049)标准卡片的峰位置相对应,并且没有其他杂相的衍射峰出现,证明所合成的样品为Zn0.2Cd0.8S固溶体.相较于对比样品,随着rGO加入量的增加,Zn0.2Cd0.8S固溶体的峰形及峰强并无发生明显变化,这有可能是因为rGO加入量过少,因此在XRD图谱上难以观察到峰形的变化.
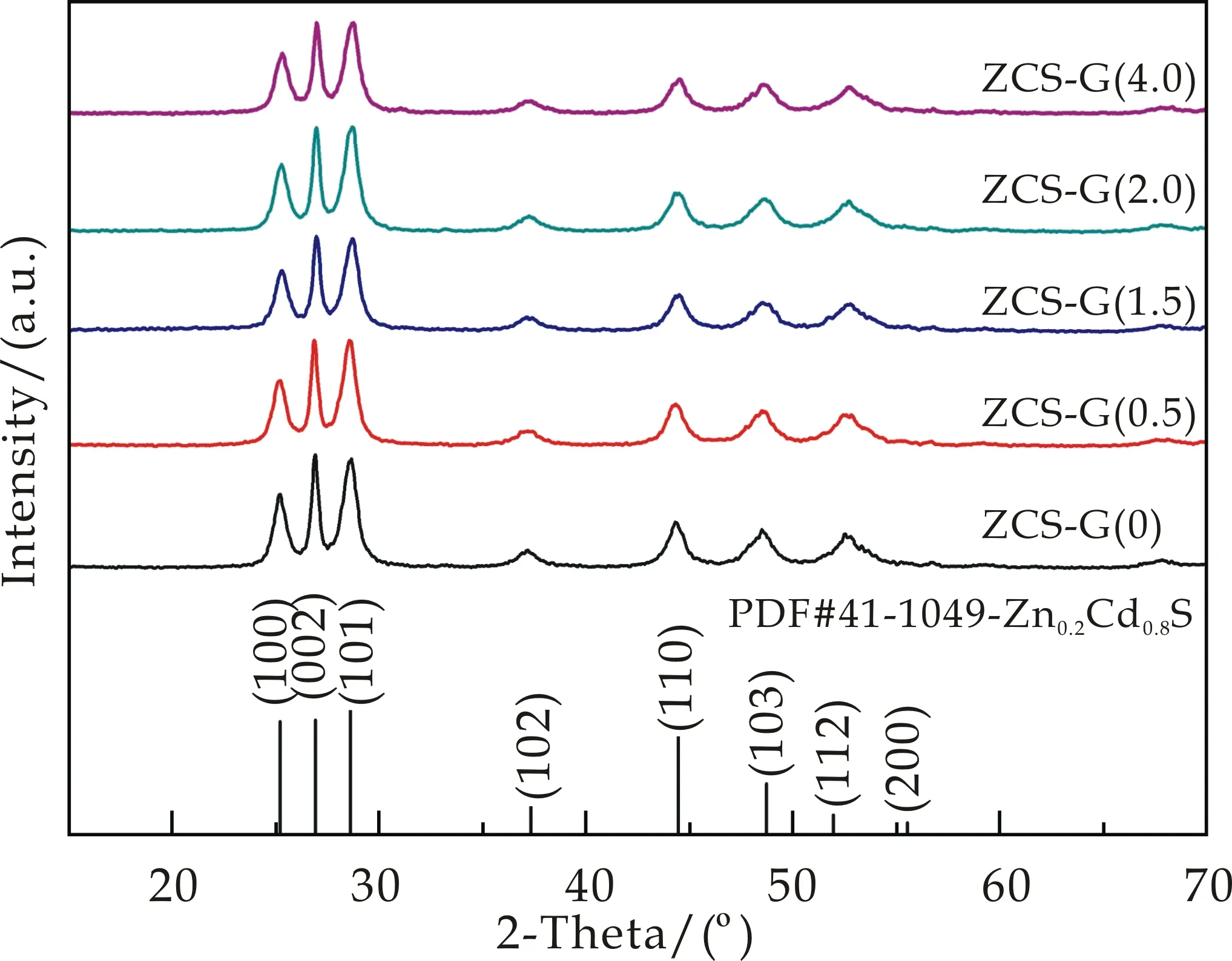
图1 不同rGO加入量的Zn0.2Cd0.8S/rGO固溶体的XRD图
2.2 拉曼光谱测试(Raman)
由于XRD图谱上并未观察到rGO的衍射峰,再进一步采用拉曼图谱来对GO,rGO,ZCS-G(0)和ZCS-G(1.5)样品进行表征,对复合前后所发生的变化进行分析证明.由图2可以明显地看出,具有一定石墨化结构的纯的GO在1 353 cm-1(D带)和1 590 cm-1(G带)处具有两个特征峰,其ID/IG=0.92,经过水热反应的rGO的ID/IG=1.01,说明反应体系中的GO的含量在降低.而对比样品ZCS-G(0)(Zn0.2Cd0.8S固溶体)的拉曼光谱并无特征峰存在.再对反应体系中添加了1.5 mg rGO的样品ZCS-G(1.5)材料进行分析,可以观察到在1 346 cm-1(D峰)和1 585 cm-1(G峰)处有两个特征峰,证明了复合后的样品Zn0.2Cd0.8S/rGO中有石墨烯的存在.但是与前三者对比,D峰与G峰都发生移动,分别移动到了1 346 cm-1和1 585 cm-1,与原始石墨(1 586 cm-1)的值是基本匹配的,说明反应体系中的GO逐渐被还原.另一方面,经过二次水热反应后ZCS-G(1.5)样品的ID/IG的比值为1.08,高于纯的GO(0.92)和水热后的rGO(1.01),其比值的增大表明sp2轨道的区域在继续减小[19].因此,根据上述分析结果,可以说明Zn0.2Cd0.8S/rGO复合材料被成功的合成.
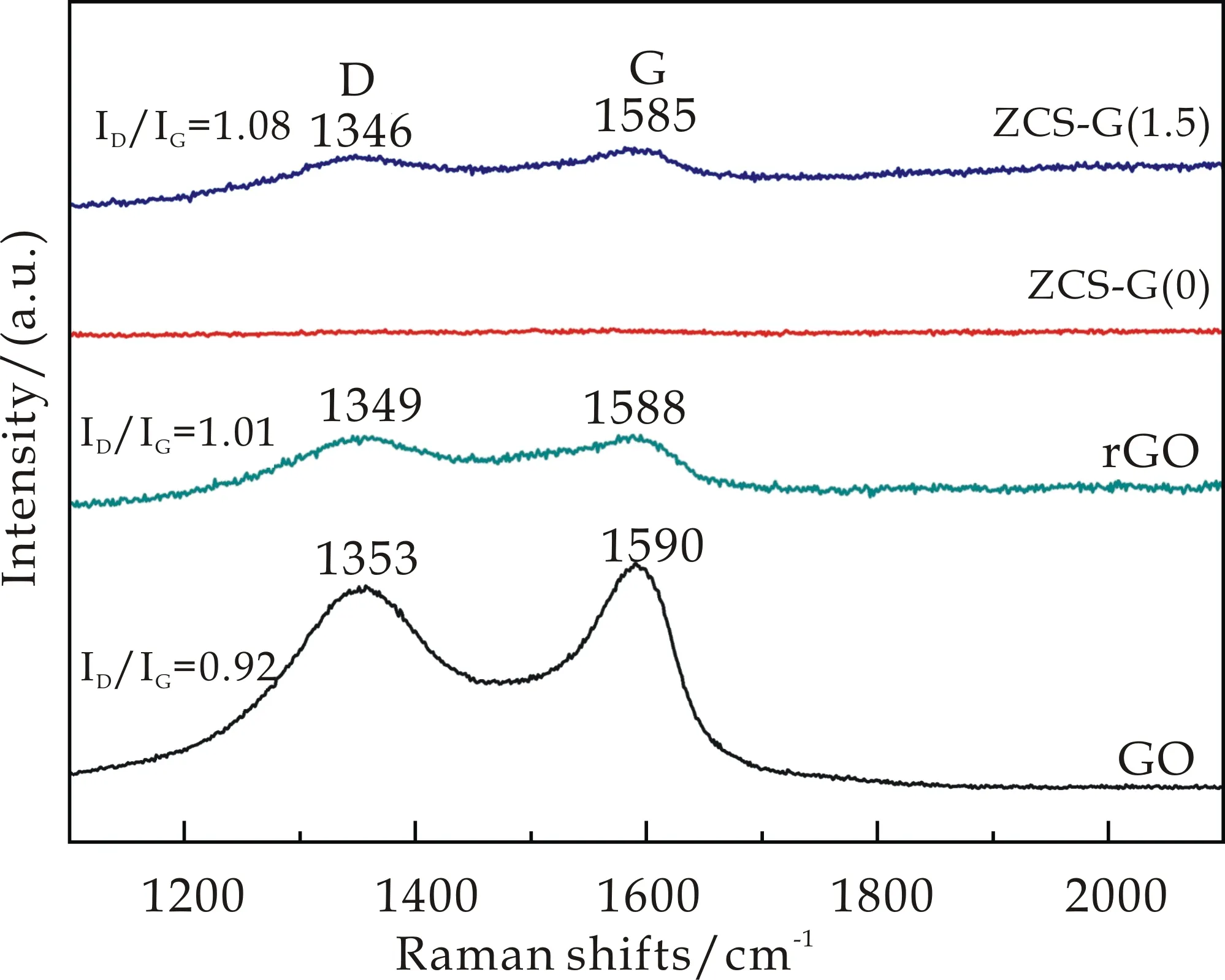
图2 GO、rGO、 ZCS-G(0)和ZCS-G(1.5)样品的拉曼光谱图
2.3 场发射扫描电子显微镜(SEM)
ZCS-G(x)样品的形貌和微结构采用扫描电镜(SEM)进行观察和分析.图3(a)~(e)为水热法所制备的不同ZCS-G(x)样品的SEM图像.图3(a)为ZCS-G(0)的SEM图,从图3(a)可以看到Zn0.2Cd0.8S的形貌为纳米球状,球的半径约为800 nm,并未出现明显的团聚现象.图3(b) ~(e)则为其他的ZCS-G(x)样品的SEM图像,可以明显看出,随着rGO加入量的增大,Zn0.2Cd0.8S固溶体材料负载在rGO上越来越多,rGO表面的Zn0.2Cd0.8S固溶体生长较为不均匀,Zn0.2Cd0.8S固溶体的半径基本保持不变,依旧为800 nm左右.

(a)ZCS-G(0) (b)ZCS-G(0.5)

(c)ZCS-G(1.5) (d)ZCS-G(2.0)

(e)ZCS-G(4.0)图3 不同ZCS-G(x)样品的SEM图
2.4 透射电子显微镜(TEM)
为了进一步观察ZCS-G(x)样品的形貌结构,可采用TEM来对材料进行表征.图4(a)为ZCS-G(1.5)的TEM图,可明显地看出球状的Zn0.2Cd0.8S固溶体在呈现卷曲的片层状的GO材料上面负载,其中纳米棒由簇核发展而来,并且Zn0.2Cd0.8S固溶体是由纳米棒组装在一起,形成具有径向突出的纳米棒的三维棒状类纳米微球.
此外,图4(b)为ZCS-G(1.5)的HRTEM图,从图4(b)中可以看出虚线包围处为Zn0.2Cd0.8S固溶体相,而虚线下方为rGO,通过HRTEM图像测量出ZCS-G(1.5)样品中所展示的晶面间距0.335 nm和0.358 nm,分别对应了ZCS-G(1.5)样品中的Zn0.2Cd0.8S固溶体相的(002)和(100)晶面间距.此分析表明与以上所讨论的XRD图谱的结果保持一致.

(a)TEM图 (b)HRTEM图4 ZCS-G(1.5)样品样品的TEM和HRTEM图谱
2.5 紫外可见漫反射及价带谱测试
图5(a)展示的是不同ZCS-G(x)样品的紫外可见漫反射图谱.从图5(a)中可以明显看到,ZCS-x样品在可见光区表现出较强的吸光度.随着x值从0到4.0的增加,ZCS-x固溶体样品的吸光度增大,材料的吸收波长发生了红移,吸光度边缘从527 nm到548 nm,因此,对于可见光的吸收能力增强.通过XRD图谱可以看出峰形及峰强基本无变化,所以Zn0.2Cd0.8S的尺寸基本没有变化,与SEM中所表述的结果是保持一致的.所以ZCS-G(x)样品的可见光吸收能力的差异是由于所加入的rGO的复合量的不同,随着rGO的加入量x值的增加,ZCS-G(x)样品向可见光范围发生红移.在此将所制备的ZCS-G(x)样品的可见光吸收能力的差异归因于rGO的复合量的不同[20].
根据实验中的Kubelka-Munk (KM)方法,利用紫外可见DRS图谱来估算ZCS-G(0)样品的带隙能(Eg值),通过下式计算:
αhυ=A(hυ-Eg)1/2
(1)
式(1)中:α是吸收系数,hυ是光子能量,Eg是材料的直接带隙值,A是一个常数[21,22].
纯相的Zn0.2Cd0.8S(ZCS-G(0))样品通过此公式进行计算,得到其带隙值为Eg= 2.23 eV(如图5(a)插图所示).这说明在可见光驱动材料的应用中,ZCS-G(0)以及复合后的ZCS-G(x)其他的样品是一种潜在的优秀光催化剂.
为了分析材料的带隙结构,本文进一步的对ZCS-G(0)的价带谱位置进行测试,如图5(b)所示,对于图中的曲线在横坐标上相截[23],可以看出测试曲线在横坐标上的截距值为1.0 eV,即Ev=1.0 eV,再根据以下公式:
Ec=Ev-Eg
(2)
式(2)中:Ec,Ev分别为半导体材料的导带和价带电势,Eg表示材料的带隙值.
在这里,将Ev=1.0 eV和Eg=2.23 eV代入公式(2)中,即可计算出ZCS-G(0)样品的导带电势值Ec=-1.13 eV,相对于标准氢电极(E0 H+/H2= 0 vs SHE)具有较负的导带电势,因此H+被还原成H2时具有较好的产氢活性.
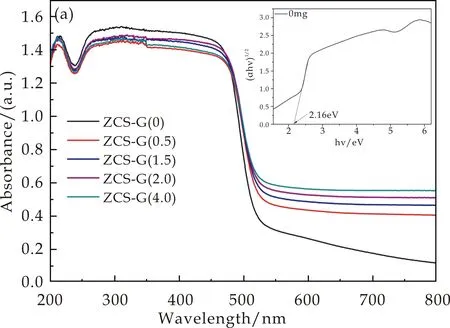
(a)ZCS-G(x)样品的紫外可见漫反射图谱(插图为ZCS-G(0)的带隙计算图)
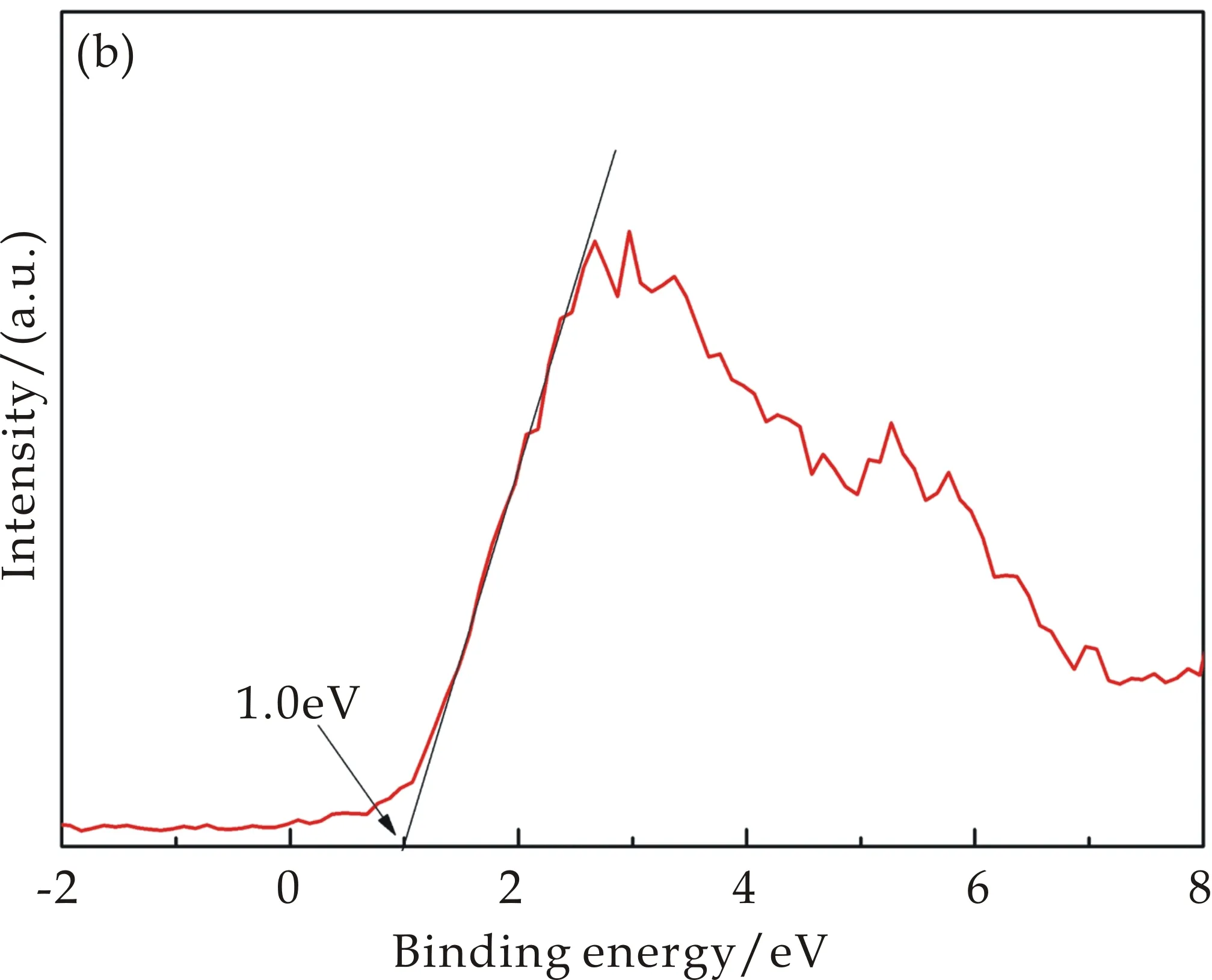
(b)ZCS-G(0)样品的价带图谱图5 ZCS-G(x)样品的紫外可见漫反射图谱及ZCS-G(0)样品的价带图谱
2.6 光催化产氢性能测试
为了研究在不同rGO加入量下所制备的Zn0.2Cd0.8S/rGO样品的光催化产生氢气的性能,研究了不同样品在碱性(0.35 M Na2S/0.25 M Na2SO3,pH=12.94)牺牲剂溶液条件下的光催化析氢活性.
图6(a)为ZCS-G(x) (x=0、0.5、1.5、2.0和4.0)在相同模拟太阳光的条件照射下光催化所产生H2性能的时间取向的性能对比.在此可以观察到在反应时间为4 h的条件下所测试出的ZCS-G(x)的光催化产生的H2的产量排序为ZCS-G(1.5)>ZCS-G(0.5)>ZCS-G(2.0)>ZCS-G (4.0)>ZCS-G(0),分别为1 117.3μmol g-1,856.8μmol g-1,691.9μmol g-1,564.55μmol g-1以及423.48μmol g-1其中ZCS-G(1.5)样品的H2产量最高,达到1 117.3μmol g-1.
图6(b)则为ZCS-G(x) (x=0、0.5、1.5、2.0、4.0)在相同的光照条件照射下的光催化析氢速率的单个小时的性能对比.在此可以发现ZCS-G(x)样品的光催化氢气的产率分别为279.25μmol h-1g-1,214.2μmol h-1g-1,173.0μmol h-1g-1,141.14μmol h-1g-1和105.87μmol h-1g-1,由此可以说明随着rGO的加入,ZCS-G(x)样品的性能呈现先增大再减小的现象,这个可能是因为rGO的加入会使得材料的光生载流子传输加快,但是过多的rGO则会使得材料表面的活性位点被覆盖,因此,造成产氢性能的下降.
为了证明ZCS-G(x)样品的稳定性,在模拟太阳光照射的条件下进行了光催化产氢循环实验.图6(c)为相同反应条件下ZCS-G(1.5)样品在可见光下产氢循环性能图谱.可以看到ZCS-G(1.5)产物经过3个循环周期后(12 h)其产氢性能依然可以达到1 114.3μmol·g-1.
进一步如图6(d)所示,很明显可以看出在可见光的照射下,ZCS-G(1.5)产物在碱性(0.35 M Na2S/0.25 M Na2SO3,pH=12.94)牺牲剂体系条件下循环3圈后的光催化产生氢气的性能由279.25μmol h-1g-1至278.58μmol h-1g-1,性能基本没有任何下降.这个结果表明,ZCS-G(x)光催化剂在可见光照射下具有较为优异的产氢性能和光稳定性.
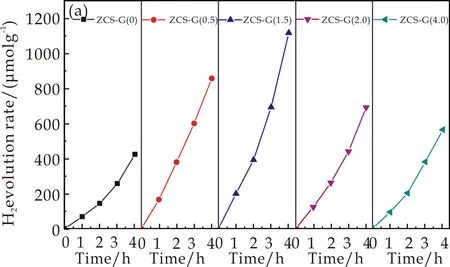
(a)一个周期的产氢性能图谱
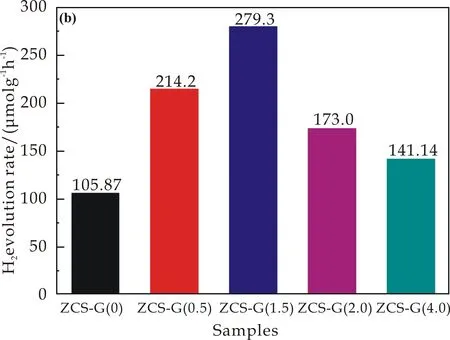
(b)一个小时的平均产氢率
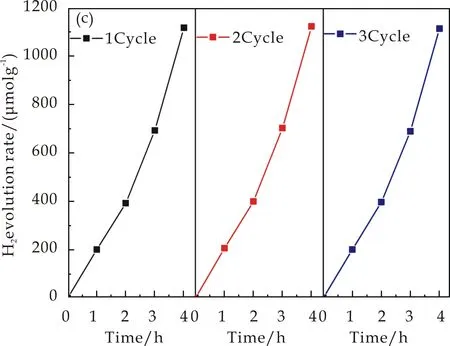
(c)一个周期的产氢循环性能图谱
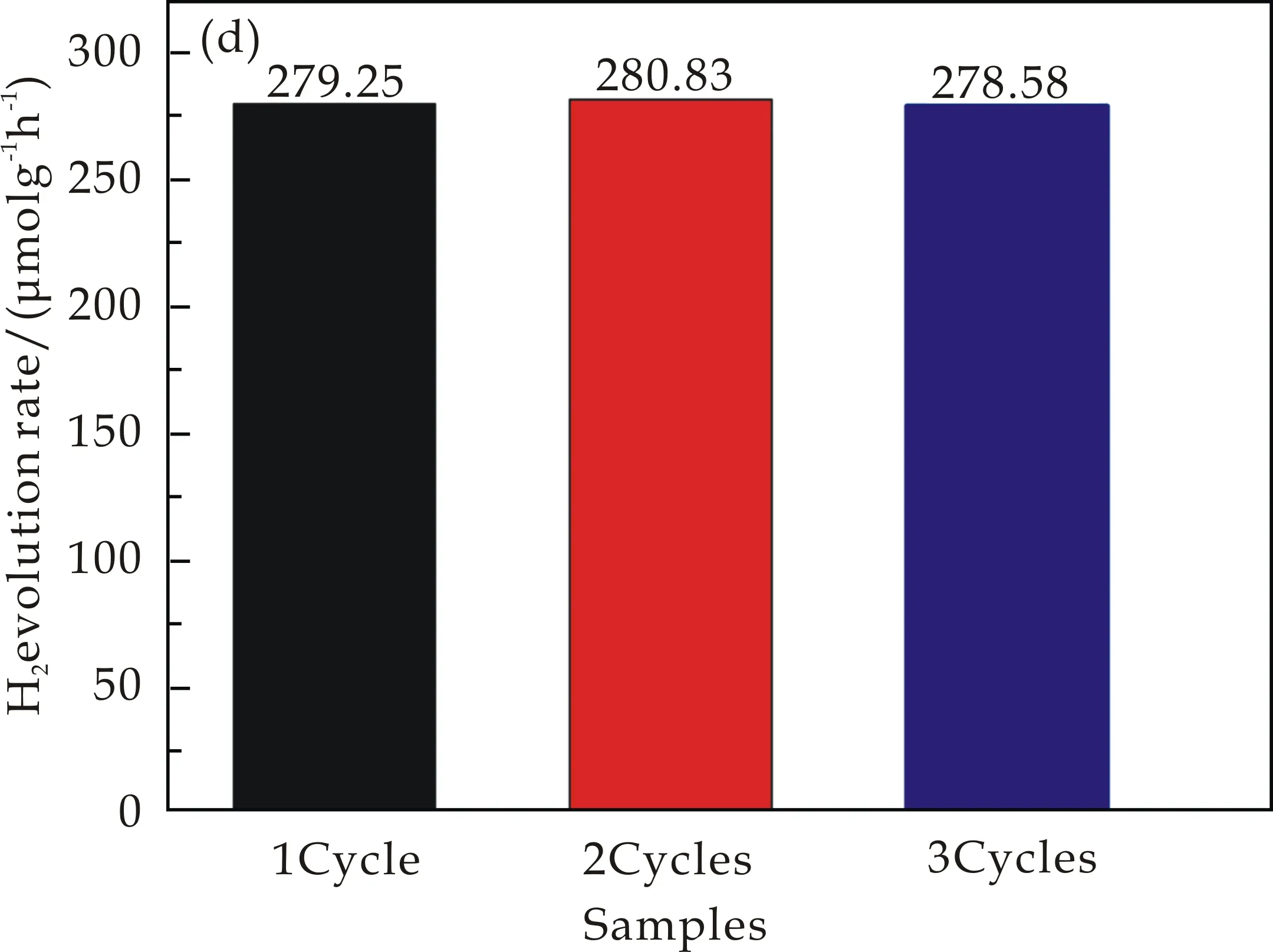
(d)一个小时的循环平均产氢率图6 不同石墨烯加入量的ZCS-G(x)样品的产氢性能测试
3 结论
本文采用两步水热法制备了Zn0.2Cd0.8S/rGO材料.利用XRD、SEM、TEM、Raman和紫外可见漫反射对不同rGO加入量的ZCS-G(x)样品进行表征,其中ZCS-G(1.5)样品具备最佳的结构和光吸收能力以及合适的导带位置.在可见光的照射下可以应用作为高度活跃和稳定的产氢光催化剂,由此表明ZCS-G(1.5)光催化剂不仅具有最佳的载流子传输和H+还原的捕获能力.更重要的是,本文报道的ZCS-G(1.5)光催化剂可以为今后高性能光催化材料的合理设计和开发提供新的思路.
