水稻窄叶突变体nal12的鉴定与基因精细定位
2019-05-24文艺方云霞胡鹏王月影侯琳琳谭义青朱黎欣邓雪梅曾大力张光恒郭龙彪朱丽陈光任德勇饶玉春薛大伟钱前胡江
文艺 方云霞 胡鹏 王月影 侯琳琳 谭义青 朱黎欣 邓雪梅 曾大力 张光恒 郭龙彪 朱丽 陈光 任德勇 饶玉春 薛大伟 钱前 胡江,
水稻窄叶突变体的鉴定与基因精细定位
文艺1, 2,#方云霞3,#胡鹏2王月影2侯琳琳2谭义青2朱黎欣2邓雪梅2曾大力2张光恒2郭龙彪2朱丽2陈光2任德勇2饶玉春1薛大伟3钱前1, 2,*胡江2,*
(1浙江师范大学 化学与生命科学学院, 浙江 金华 321000;2中国水稻研究所 水稻生物学国家重点实验室, 杭州 310006;3杭州师范大学 生命与环境科学学院, 杭州 310036;#共同第一作者;*通讯联系人, E-mail: qianqian188@hotmail.com; hujiang588@163.com)
【目的】水稻叶片是理想株型的主要组成部分。筛选和鉴定新的叶形突变材料,可为研究叶发育调控机制和塑造叶片理想形态打下基础。【方法】由粳稻品种武运粳31经EMS(ethyl methane sulphonate)诱变获得窄叶突变体();通过表型测量分析剑叶至倒4叶的叶片长度、宽度、大脉数和小脉数,并进行组织切片和显微观察;将突变体与籼稻品种台中本地1号(TN1)杂交,在F2分离群体中选取了1709个具窄叶突变表型的单株,通过已有的SSR、STS和新开发的分子标记进行精细定位。【结果】在幼苗期就表现出了窄叶性状,在成熟期植株较野生型矮小,分蘖增多,茎秆变细。经组织切片观察分析,叶片变窄是由于大脉和小脉数量减少造成。遗传分析表明该窄叶表型受单一隐性核基因调控;最终将该基因定位在第10染色体上LC2-RF37与LC4R-RF39标记之间约64.7 kb的范围内。该区间内共有10个开放阅读框,其中并无已报道的窄叶相关基因。qRT-PCR结果表明,基因的突变会影响生长素合成与运输相关基因的表达。【结论】为一个新的叶形调控基因。这为进一步研究水稻叶片发育,丰富其分子调控网络打下了基础。
水稻;窄叶;;基因定位
叶片作为水稻光合作用和呼吸作用的主要器官,其形态结构直接影响水稻的生长发育和最终产量[1]。因此,深入研究水稻叶发育的分子调控机制,建立相应的分子调控网络,塑造大田种植的最佳叶片形态,对提高水稻产量和改善稻米品质均有重要的理论意义和应用价值。作为水稻理想株型的重要组成部分,叶片大小和受光姿态一直是育种学家关注的重点。袁隆平针对长江中下游稻作区超级杂交水稻的理想株型,强调叶片要“长、直、窄、凹、厚”,充分发挥冠层在整个生育期的光合作用来提高产量[1]。也即应根据不同地区和气候条件选择相应叶片形态,在同等光照下最大限度地保证每片叶的受光面积,提升光合效率,从而提高产量。
到目前为止,已有多个水稻窄叶突变基因被发掘和克隆。通过经典遗传结合现代分子生物学技术,已经定位窄叶基因~,其中、、、和已经被克隆[2-5]。此外还有一些窄叶相关基因,如窄卷基因[6-8]和[9-11],白化窄叶基因/等[12-13]。其中,编码一个生物学功能未知蛋白,在维管束组织中大量表达,其突变后可引起叶片中小脉数显著减少从而导致叶宽变小[12-13]。进一步研究发现是通过降低生长素的极性运输来调控叶发育,其在9311中的等位基因()可提高叶绿素含量,并增加产量[14]。和是拷贝基因,与拟南芥中的和玉米中的、同源,均编码与WUSCHEL相关的同源框蛋白OsWOX3A,也是通过生长素极性运输来调控叶片的发育[3]。编码一个含核黄素的单加氧酶,是YUCCA家族中的一员,涉及到生长素的生物合成,该基因的突变可导致生长素含量的变化,最终影响叶宽[4]。而与水稻黄叶基因等位,同时调控着水稻叶绿体的发育和叶宽[5]。窄卷叶基因() 编码一个纤维素合成类似酶OsCSLD4,在根、叶鞘、穗部等生长旺盛的器官中大量表达,该基因能够通过影响维管束和泡状细胞的发育来调控叶片的宽度和卷曲度[6-8]。/编码CHR4/MI-2类似蛋白,是一类可调节H3K4和H3K27甲基化的基因,该基因也是通过调控生长素来影响水稻叶片维管束发育的[12-13]。
本研究以新窄叶突变体为材料,通过构建的F2群体进行遗传分析,并利用已知的分子标记和新开发的分子标记开展了目的基因的精细定位,将其锁定在第10染色体长臂末端约64.7 kb的区域内。同时还开展了组织切片观察,以及生长素相关基因的qRT-PCR表达分析。这些将为进一步的基因克隆和解析其调控叶发育的分子机理奠定基础。
1 材料与方法
1.1 研究材料
粳稻品种武运粳31经EMS诱变,从其分离后代中获得一个窄叶突变体,经连续多代种植,突变性状能够稳定遗传。将与籼稻品种台中本地1号(TN1)杂交得到F1,播种自交得到F2分离群体,从中分离出现正常和窄叶两种表型,根据窄叶表型田间取样,共获得1709个窄叶材料用于基因定位。所有水稻材料均种植于杭州富阳中国水稻研究所试验田。
1.2 表型调查与显微观察
抽穗后分别调查野生型与剑叶至倒4叶的叶长和叶宽、茎节长及分蘖数,在显微镜下统计叶脉数量。用FAA固定液(70%酒精、40%甲醛和冰乙酸的体积比为18∶1∶1)固定剑叶,经酒精梯度脱水,二甲苯透明后用石蜡包埋,切片染色中性树脂封片后用显微镜观察维管束细胞,并拍照。
1.3 水稻DNA提取及PCR
野生型和两个亲本、F2群体及混池的DNA提取采用CTAB法。引物设计使用Primer Premier 5.0软件,由尚亚生物技术公司合成。PCR采用10 μL扩增体系:2 μL模板DNA,1 μL dNTP(2 mmol/L),1 μL缓冲液(10×),2 μL 正反向引物,0.1 μL rDNA聚合酶,3.95 μL ddH2O。PCR扩增程序如下:94℃下高温变性4 min;94℃下30 s,55℃下30 s,72℃下30 s,共计40个循环;72℃下充分延伸10 min,15℃下保存。PCR产物加入溴酚蓝核酸染料,琼脂糖凝胶电泳后置于凝胶成像仪上紫外扫描,保存胶图并统计分析。
1.4 NAL12的精细定位
以1709株×台中本地1号的F2隐性单株为定位群体,利用均匀分布于12条染色体上的SSR标记对群体DNA混池(F2群体中随机选取30单株)、F1以及双亲进行多态性筛选,找出与目的基因连锁的分子标记。然后扩大群体验证连锁标记,确定初定位区间。基于初定位结果,对比目标区间内籼粳基因组序列,以日本晴与珍汕97为参考,找出序列差异后用Primer Premier 5.0软件设计InDel标记引物。PCR扩增双亲和琼脂糖凝胶电泳检测,筛选出多态性引物对F2群体进行检测。分析胶图,将具有台中本地1号带型的单株记为A,具有带型的单株记为a,具有F1带型即交换单株记为H,统计交换单株的减少趋势及走向,以明确目标基因的区间,依据图位克隆原理完成精细定位。利用NCBI网站(https://www.ncbi.nlm.nih.gov/)和水稻基因组注释数据库(http://rice.plantbiology.msu.edu/)预测定位区间内的候选基因,并下载其DNA序列。以候选基因序列为参考,用Primer Premier 5.0软件设计测序引物,PCR扩增野生型和突变体,并送往尚亚生物技术公司进行测序。采用Seqman软件比对分析测序结果。
1.5 实时荧光定量PCR
取野生型与突变体成熟植株的剑叶,使用Axygen公司的Miniprep试剂盒提取基因组RNA。随后用日本TOYOBO公司生产的反转录试剂盒(ReverTra Ace quantitative PCR RT Master Mix)反转合成第1链cDNA,实验操作均按照说明书进行。得到cDNA后,稀释5倍用于实时荧光定量PCR。使用Bio-Rad CFX96 PCR仪器和TOYOBO生产的2×SYBR Green PCR Master Mix试剂,扩增以水稻内参基因作为对照,样品3次重复,PCR扩增程序如下:95℃下预变性60 s;95℃下变性15 s,60℃下延伸60 s,共计40个循环。
2 结果与分析
2.1 nal12农艺性状分析
比较野生型武运粳31与窄叶突变体植株形态,两者在叶片、茎秆、株高、分蘖和穗等方面存在显著差异(图1)。播种10 d左右,即可观察到叶片显著变窄,但根系发育正常(图1-A)。抽穗后,株型紧凑,相对野生型稍矮小,分蘖数比野生型增多33.33%,叶片平均宽度和平均长度均低于野生型(图1-B);突变体茎秆变细,倒Ⅰ节至倒Ⅳ节长度分别为野生型的55.6%,55.8%,69.5%,88.1%(图1-C、D、F),穗形较小(图1-E)。这表明该基因突变后不仅影响叶形态,而且早期就开始调控着整个植株的形态发育。
2.2 nal12细胞学观察及组织解剖分析
调查统计发现,的叶宽与叶长均低于野生型,其剑叶至倒4叶的叶宽分别占野生型叶宽的58.8%、56.3%、53.3%和40.0%;而叶长则分别占野生型叶长的56.2%、66.4%、83.1%和80.0%(图2-A、G、H)。由于已报道的窄叶相关基因大部分与叶片维管束的发育相关,我们进行了显微镜及石蜡切片观察,发现叶片剑叶至倒4叶的大脉数分别占野生型大脉数的83.3%、83.3%、66.7%和66.7%;而小脉数则分别占野生型小脉数的69.8%、57.8%、58.5%和62.5%,野生型与突变体的差异均达显著水平(图2-B~F、I、J)。因此,叶片的窄化应该是叶脉数量下降造成的。
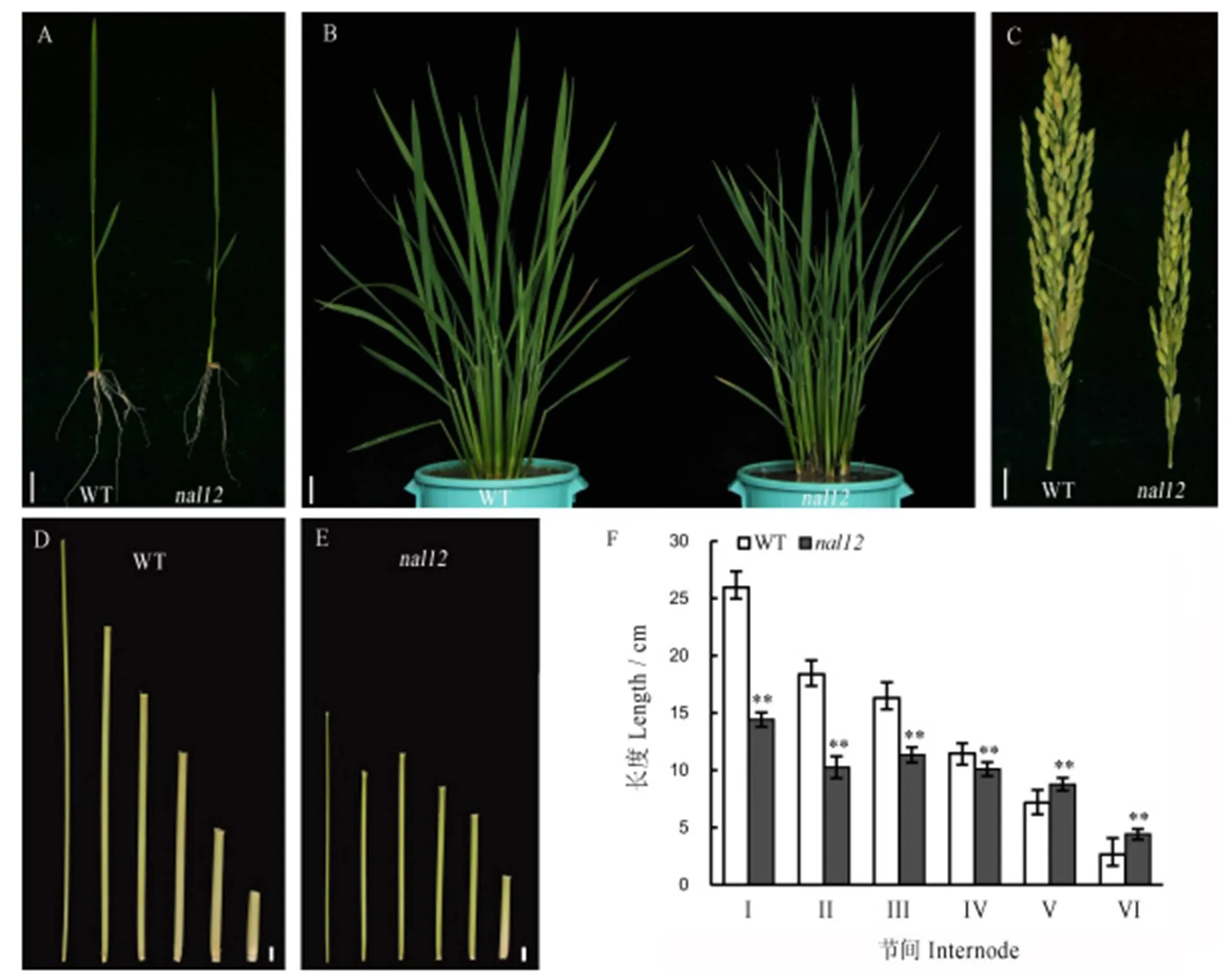
A−10 d秧龄的幼苗,标尺=3 cm;B−分蘖期植株,标尺=5 cm;C−穗,标尺=1 cm;D和E−分别为茎秆倒Ⅰ节到倒Ⅵ节,标尺=1 cm;F图中,误差线表示标准差(n=20),**表示差异达0.01显著水平。
Fig.. 1. Phenotype of wild-type Wuyunjing 31 and mutant.

A−野生型武运粳31和突变体nal12剑叶至倒4叶的形态, 标尺=1 cm;B−叶片的主脉、大脉和小脉。MV为主脉,LV为大脉,SV为小脉,标尺=1 cm;C和D−主脉的石蜡切片,标尺=200 μm;E和F−大脉和小脉的石蜡切片。标尺=200 μm;G和H−野生型武运粳31和突变体nal12的叶宽和叶长;I和J−野生型武运粳31和突变体nal12的大脉数和小脉数。误差线表示标准差(n=20),**0.01极显著水平。
Fig.. 2. Leaf microstructure of Wuyunjing 31(wild type, WT) and mutant.
2.3 遗传分析与基因定位
本研究将突变体与籼稻台中本地1号(TN1)杂交,得到的F1代在田间种植为正常叶片表型,表明该性状受隐性基因控制。收集F1种子在田间播种,可分离出窄叶表型植株和正常表型植株。统计正常植株与窄叶植株的数量比例为5213∶1709,经卡方测验符合一对隐性核基因调控的3∶1分离比(χ2=0.34<χ20.05=3.84),表明表型受一单隐性核基因控制。以184个F2隐性个体为初定位群体,利用234个均匀分布于12条染色体上的分子标记进行混池鉴定分析,发现在第10染色体末端位置,分子标记B10-13、B10-14和B10-15的扩增条带位置出现了偏扩增。随后用这184个单株进行验证,结果表明3个分子标记均与目标性状连锁,初步将目的基因锁定在第10染色体长臂末端(图3-A)。然后扩大F2定位群体,共计1709株突变体表型单株,并在此区间进一步设计SSR和InDel标记,筛选出亲本间具有多态性的分子标记进行精细定位,最终将定位在标记LC2-RF37和LC4R-RF39之间,物理距离为64.7 kb(图3-B,表1)。据前人相关报导并未在此区段发现类似的窄叶基因,此为一个新的窄叶基因,定名为。
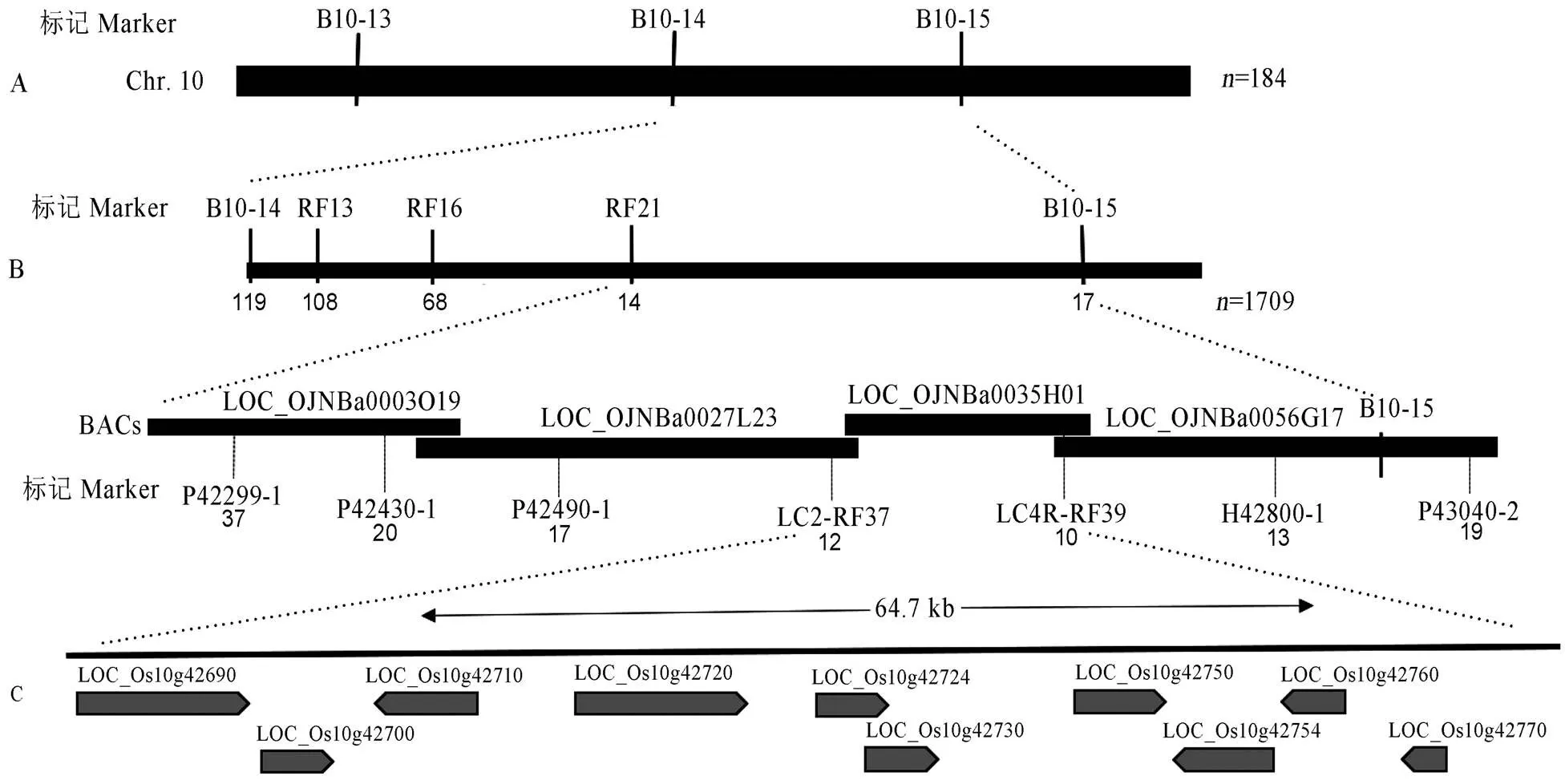
A−NAL12初定位在第10染色体上;B−NAL12精细定位在64.7 kb的区间内;C−定位区间的10个预测基因。
Fig.. 3. Fine mapping of.

表1 用于基因定位和定量分析的分子标记

表2 目标区域预测基因
2.4 预测候选基因
根据水稻基因组注释数据库(Rice Genome Annotation Project, http://rice.plantbiology.msu.edu/) 提供的信息,在的定位区间内共包含10个预测基因,分别为LOC_Os10g42690,编码一个结构域蛋白;LOC_Os10g42700,编码假定的CS结构域蛋白质;LOC_Os10g42710,编码RCD1酶;LOC_Os10g42720,编码假定的酰基转移酶;LOC_Os10g42724,编码VHS和GAT结构域蛋白;LOC_Os10g42730和LOC_Os10g42754,均编码一个未知蛋白;LOC_Os10g42750,编码CSLD1纤维素合成酶;LOC_Os10g42760,编码一个PPR重复结构域蛋白;LOC_Os10g42770,编码假定的a_IG002N01.7蛋白(图3-C,表2)。
2.5 生长素相关基因的表达分析
根据已克隆基因的cDNA序列设计引物用于qRT-PCR(表1)。我们检测了生长素相关基因在野生型武运粳31与窄叶突变体中的表达情况(图4)。实验结果表明,除生长素运输基因外,其他基因的转录水平在中均有所下降。其中,生长素合成基因的表达量下调为野生型的61.6%;信号传导有关基因的表达量下调为野生型的85.8%;运输有关基因和分别下调为野生型的74.3%和49.8%。表明的基因突变可造成生长素的生物合成、运输和传导基因的改变,从而导致植株和叶发育的异常。
3 讨论
本研究从武运粳31的EMS诱变群体中获得的一个窄叶突变体,其不仅表现为叶脉数量的显著下降,还伴随着植株矮化、分蘖增多、茎秆变细等表型,也即相关调控基因应该是在多组织中表达的。根据已报道窄叶材料的表型,大部分突变体除了叶片变窄外,多数还伴随着植株矮小、穗发育不良、叶片卷曲黄化等形态学特征。其中,、、和除了叶片变窄以外,还表现出植株矮化[2, 4-8];而、和则表现出不同程度叶片卷曲[4, 6-12]。在叶色方面,的叶片为白条叶[12-13],为黄化叶[5],而显性窄叶突变体的叶片则表现为深绿色[15]。此外,窄叶突变体还会出现畸颖,并且不育[16]。因此,与其他窄叶材料一样,均有多个性状发生变化,表明其突变基因可同时影响植株多个组织器官的发育。
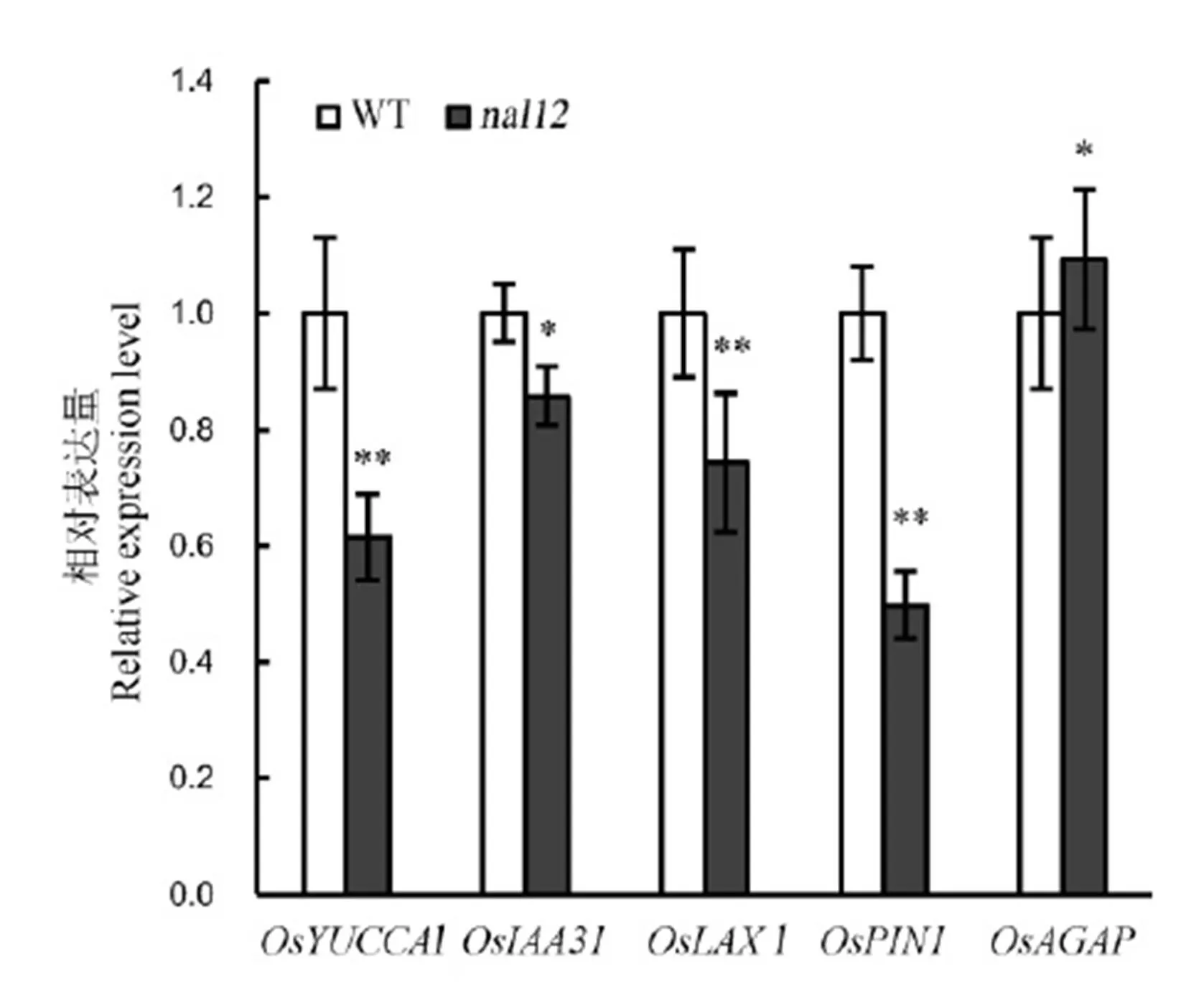
Bar值代表标准误(n=3),**表示0.01极显著水平,*表示0.05显著差异。
Fig.. 4. Expression analysis of auxin-related genes in the wild-type Wuyunjing 31 and mutant.
通过图位克隆法,我们将精细定位在第10染色体末端约64.7 kb的区间,该区域内有10个预测基因。其中编码一个OsCSLD1蛋白,涉及到根毛的发育[17]。在高等植物中,糖基转移酶家族的纤维素合酶类似蛋白(cellulose synthase-like, CSL)对细胞壁的生物合成和植株生长至关重要。家族参与纤维素与半纤维素的骨架合成,在水稻中有5个成员,即~;在拟南芥中有6个成员,即~[6]。其中,编码一个OsCSLD4蛋白,该基因的突变会导致植株矮化、窄叶微卷及细长粒表型[6-8]。而/则是与水稻根毛的形态建成相关,在根部和地上部分外皮层和皮层细胞的细胞壁表达,该基因突变后可造成根毛缩短或无根毛表型,但根系长度及地上部表型无显著性变化[17-18]。尽管定位区间内包含基因,但与/的突变表型显著不同,/表型为无或短根毛,植株和叶形正常,而则表现出了矮化、窄叶、分薛增多、细秆,且根毛正常表型,表明应为一个调控叶片发育的新基因。
叶片从叶原基起始开始,经近-远轴、基-顶轴和中-侧轴三个极性发育方向发育,最终形成一片完整的叶,而叶片宽窄改变应与中-侧轴的极性发育相关。通过解剖分析发现,大多数窄叶都发生了叶脉数量的减少,如和就会使大脉和小脉减少,经组织切片后能观察到突变体的维管束发育不完全,其数目和分布皆有所改变[2, 4]。与生长素极性运输相关[2],而则与生长素合成相关[4],事实上生长素对于细胞分裂、分化、纵向延伸以及叶原基的分化均有着重要作用[19-20]。在RT-PCR分析中,中的生长素合成、信号转导及运输基因的表达基本都下降了,表明很可能也涉及到通过生长素调控叶发育。
目前,由于突变发生的不确定性,通过诱变育种来进行品种改良往往都伴随着一些不利性状,如生育期延迟、植株矮化、叶片过于卷曲、结实率下降等,导致多数突变材料,特别是叶形类材料并不能直接用于育种改良。然而通过挖掘和鉴定新叶形突变材料,克隆相关控制基因,完善其分子调控网络,再通过基因敲除或定点突变等新兴技术将为构造水稻理想株型的分子育种打下基础。
[1] 袁隆平. 杂交水稻超高产育种. 杂交水稻, 1997, 12(6): 1-6.
Yuan L P. Breeding of super high yield hybrid rice., 1997, 12(6): 1-6. (in Chinses with English abstract)
[2] Qi J, Qian Q, Bu Q Y, Li S Y, Chen Q, Sun J Q, Liang W X, Zhou Y H, Chu C C, Li X G, Ren F G, Palme K, Zhao B G, Chen J F, Chen M S, Li C Y. Mutation of the ricegene, which encodes a novel protein, affects vein patterning and polar auxin transport., 2008, 147(4): 1947-1959.
[3] Cho S H, Yoo S C, Zhang H T, Pandeya D, Koh H J, Hwang J Y, Kim G T, Paek N C. The riceandloci encode WUSCHEL-related homeobox 3A (OsWOX3A) and function in leaf, spikelet, tiller and lateral root development., 2013, 198(4): 1071-1084.
[4] Fujino K, Matsuda Y, Ozawa K, Nishimura T, Koshiba T, Fraaije M W, Sekiguchi H.controls leaf shape mediated by auxin in rice., 2008, 279(5): 499-507.
[5] Li W, Wu C, Hu G C, Xing L, Qian W J, Si H M, Sun Z X, Wang X C, Fu Y P, Liu W Z. Characterization and fine mapping of a novel rice narrow leaf mutant., 2013, 55(11): 1016-1025.
[6] Jiang H, Li Z, Zeng D L, Gao Z Y, Guo L B, Fang Y X, Zhang G H, Dong G J, Yan M X, Liu J, Qian Q. Identification and characterization of, a novel gene regulating leaf morphology and plant architecture in rice., 2010, 73(3): 283-292.
[7] Li M, Xiong G Y, Li R, Cui J J, Tang D, Zhang B C, Pauly M, Cheng Z K, Zhou Y H. Rice cellulose synthase-like D4 is essential for normal cell-wall biosynthesis and plant growth., 2009, 60(6): 1055-1069.
[8] Wu C, Fu Y P, Hu G C, Si H M, Cheng S H, Liu W Z. Isolation and characterization of a rice mutant with narrow and rolled leaves., 2010, 232(2): 313-324.
[9] Zhao S S, Zhao L, Liu F X, Wu Y Z, Zhu Z F, Sun C Q, Tan L B.regulates leaf shape, male fertility, and seed size in rice., 2016, 58(12): 983-996.
[10] Liu X F, Li M, Liu K, Tang D, Sun M F, Li Y F, Shen Y, Du G J, Cheng Z K.modulates rice leaf rolling by regulating abaxial side cell differentiation., 2016, 67(8): 2139-2150.
[11] Ma L, Sang X C, Zhang T, Yu Z Y, Li Y F, Zhao F M, Wang Z W, Wang Y T, Yu P, Wang N, Zhang C W, Ling Y H, Yang Z L, He G H.regulates cell proliferation and procambium cell establishment during aerial organ development in rice., 2017, 213(1): 275-286.
[12] Xu J, Wang L, Zhou M Y, Zeng D L, Hu J, Zhu L, Ren D Y, Dong G J, Gao Z Y, Guo L B, Qian Q, Zhang W Z, Zhang G H.is allelic to, regulates leaf morphogenesis and development by affecting auxin metabolism in rice., 2017, 82(1): 175-186.
[13] Ma X D, Ma J, Zhai H H, Xin P Y, Chu J F, Qiao Y L, Han L Z. CHR729 is a chd3 protein that controls seedling development in rice., 2015, 10(9): e0138934.
[14] Zhang G H, Li S Y, Wang L, Ye W J, Zeng D L, Rao Y C, Peng Y L, Hu J, Yang Y L, Xu J, Ren D Y, Gao Z Y, Zhu L, Dong G J, Hu X M, Yan M X, Guo L B, Li C Y, Qian Q., fromcultivar, which is allelic to, increases yield ofsuper rice 93-11., 2014, 7(8): 1350-1364.
[15] 桑贤春, 林婷婷, 何沛龙, 王晓雯, 廖红香, 张孝波, 马玲, 何光华. 水稻显性窄叶突变体的鉴定与基因定位.中国农业科学, 2014, 47(9): 1819-1827.
Sang X C, Lin T T, He P L, Wang X W, Liao H S, Zhang X B, Ma L, He G H.Identification and gene mapping of a dominant narrow leaf mutantin rice ()., 2014, 47(9): 1819-1827. (in Chinses with English abstract)
[16] 方云霞, 朱丽, 潘江杰, 余海平, 薛大伟, 饶玉春, 王小虎, 石珍源, 张栋, 祝阳舟, 董国军, 曾大力, 张光恒, 郭龙标, 胡江, 钱前. 水稻窄叶突变体的鉴定与基因精细定位. 中国水稻科学, 2015, 29(6): 587-594.
Fang Y X, Zhu L, Pan J J, Yu H P, Xue D W, Rao Y C, Wang X H, Shi Z Y, Zhang D, Zhu Y Z, Dong G J, Zeng D L, Zhang G H, Guo L B, Hu J, Qian Q.Identification and fine mapping of a narrow leaf mutantin rice., 2015, 29(6): 587-594. (in Chinses with English abstract)
[17] Kim C M, Park S H, Je B I, Park S H, Park S J, Piao H L, Eun M Y, Dolan L, Han C D.,gene, is required for root hair morphogenesis in rice., 2007, 143(3): 1220-1230.
[18] Takahisa Y, Kenji S, Naoki S, Akio M, Hirohiko H, Masahiko I, Taketa S.() mutant represents a loss-of-function allele of the cellulose synthase-like gene OsCSLD1 in rice., 2011, 61(3): 225-233.
[19] Vanneste S, Friml J. Auxin: A trigger for change in plant development., 2009, 136(6): 1005-1016.
[20] Zhao Y. Auxin biosynthesis and its role in plant development., 2010, 61: 49-64.
Identification and Fine Mapping of a Narrow Leaf Mutantin Rice
WEN Yi1, 2,, FANG Yunxia3,, HU Peng2, WANG Yueying2, HOU Linlin2, TAN Yiqing2, ZHU Lixin2,DENG Xuemei2, ZENG Dali2, ZHANG Guangheng2, GUO Longbiao2, ZHU Li2, CHEN Guang2, REN Deyong2, RAO Yuchun1, XUE Dawei3, QIAN Qian1, 2, *, HU Jiang2, *
(College of Chemistry and Life Science,,,;,,, China; College of Life and Environmental Sciences,,,;These authors contributed equally to this work;Corresponding authors,:)
【Objective】Leaf is a vital component of ideal plant type in rice. Screening and identification of new leaf mutants can lay the foundation for studying leaf development and constructing ideal leaf morphology. 【Method】A novel rice mutant named() was identified from an EMS mutagenized population of Wuyunjing 31. The leaf length, leaf width, numbers of large and small veins from flag leaf to the 4th leaf from the top were measured, and the histological section and microscopic observation were conducted at the maturity stage. The F2segregating population was constructed from a cross betweenandvariety TN1, and 1709 narrow-leaf individuals were selected for fine mapping ofwith existing SSR, STS and developed molecular markers. 【Result】Theshowed narrow leaves at seedling stage, and exhibited dwarf, increased tillers and thinner stems at maturity stage. According to the anatomy observation of tissue sections, the narrow leaf phenotype ofwas caused by the decrease in the number of large veins and small veins compared with the wild type. Genetic analysis indicated that the narrow leaf trait was regulated by a single recessive nuclear gene, andwas finally mapped to a range of 64.7 kb between LC2-RF37 and LC4R-RF39 markers on chromosome 10. A total of 10 ORFs (open reading frames) were found and there were no narrow-leaf related genes reported in this region. qRT-PCR analysis revealed that the mutation ofwas involved in the expression level of auxin synthesis and transport-related genes. 【Conclusion】is a new leaf-shape regulatory gene, which lay a foundation for further research on rice leaf development and enrich its molecular regulatory network.
rice; narrow leaf;; gene mapping
Q343.5; S511.032
A
1001-7216(2019)03-0219-08
10.16819/j.1001-7216.2019.8125
2018-11-20;
2018-12-18。
国家自然科学基金资助项目(31671666; 31871594; 91335105);浙江省自然科学基金杰出青年项目(LR19C130001)。
