葛根素联合阿托伐他汀对激素性股骨头缺血性坏死COX-2 / PGE2 / cAMP 信号通路的影响
2019-05-24汪瑜罗梅懿黄歆熊德建杨云戟宋永丹杨旭陈维永
汪瑜 罗梅懿 黄歆 熊德建 杨云戟 宋永丹 杨旭 陈维永
作者单位:610041 成都市第七人民医院、成都市癌症防治中心 ( 汪瑜、黄歆、熊德建、杨云戟、宋永丹、陈维永 );610072 成都,四川省医学科学院、四川省人民医院 ( 罗梅懿 );643000 四川,自贡市第四人民医院皮肤肿瘤科 ( 杨旭 )通讯作者:陈维永,Email: wangyu167890@126.com
股骨头缺血性坏死 ( avascular necrosis of femur head,ANFH ) 是一种高致残性骨科疾病,其主要病理病机是血运受阻导致骨质缺血[1-2]。临床统计,导致股骨头坏死的因素早已高达 60 余种[3]。常见坏死类型有激素性、酒精性、外伤性、老年和儿童性;致病因素主要是创伤、药物、酒精、骨质疏松等[4]。激素性股骨头缺血性坏死 ( steroid-induced avascular necrosis of femoral head,SANFH ) 因糖皮质激素的过量使用,从而导致股骨头缺血、骨细胞大量死亡,是临床主要发病类型,占总发病率的57%[5]。阿托伐他汀除了可降胆固醇、降血液黏稠度等作用,其单独或联合应用,还具有减轻 ANFH 症状的临床疗效[6]。葛根素是提取自葛根的一种黄酮类药物,能够刺激成骨细胞的增殖,提高成骨细胞的分化早期标志物碱性磷酸酶的活性并兼具抗炎作用[7-8],可应用于 SANFH 治疗。但二者联合用药尚无报道,联合用药能否增强疗效值得研究。笔者旨在考察葛根素联合阿托伐他汀对 SANFH 的作用效果及机制,为二者联合用药治疗 SANFH 提供科研依据。
材料与方法
一、药物
葛根素 ( 中国食品药品鉴定研究院,批号:110752-201514 )、阿托伐他汀 ( 辉瑞制药有限公司,批号:1037043 )、脂多糖 LPS ( 美国 Sigma 公司 )、甲泼尼龙 ( 美国辉瑞公司 )、生理盐水、水合氯醛。
二、动物
采用成年雄性 SD 大鼠,共 50 只,12 周龄,体重 400~450 g,许可证号:SCXK ( 川 ) 2015-030,养殖温度 22 ℃~26 ℃,湿度 37%~42%,光照按12 h 昼夜交替,自由摄食饮水,每笼 2 只。适应性喂养 1 周后随机分为 5 组,每组 10 只。动物和试验场地由成都里来生物科技有限公司提供。
三、主要试剂
TRIZOL,美国 Invitrogen 公司生产,批号:15596-026;PrimeScript RT reagent Kit,宝生物工程( 大连 ) 有限公司生产,批号:BK501;SYBR Premix Ex Taq II Kit,宝生物工程 ( 大连 ) 有限公司生产,批号:BK402;大鼠 PGE2 ELISA 试剂盒、大鼠 TXB2 ELISA 检测试剂盒,大鼠 TGF-β1 ELISA 试剂盒,购于上海鑫乐;TUNEL 试剂盒 ( In situ cell death detection kit-POD 法,10279600 ),购自瑞士 Roche公司;甲醛、伊红液、苏木素 ( AR 级 )。
四、主要仪器
RT-PCR 仪 ( PIKORed 96,ThermoFisher ),全自动组织脱水机 ( TSJ-II,常州中威 ),包埋机( BMJ-III,常州中威 ),病理组织漂烘仪 ( PHY-III,常州中威 ),数码三目摄像显微镜 ( BA400 Digital ),酶标仪 ( Multlskan ),低温离心机 ( C2500,湖南湘仪实验仪器 ),压力蒸汽灭菌器 ( SYQ-DSX-280B,上海宜川 ),高精密电子天平 ( BN-200,台湾巨林樱花 )。
五、分组及造模
50 只 SD 大鼠按随机数字表,随机分为空白对照组 ( A )、模型组 ( B )、阿托伐他汀组 ( C )、葛根素组 ( D ) 和联合用药组 ( E ),每组 10 只。每组大鼠精确称重后,B、C、D、E 组均分别以 20 μg / kg 剂量尾静脉注射 LPS 2 天,每天 1 次,末次注射 24 h后,臀肌注射 40 mg / kg 剂量甲泼尼龙 3 天,每天1 次[9]。空白对照组 A 臀肌注射等体积无菌生理盐水。造模的同时,C 组灌胃阿托伐他汀20 mg/kg,D 组灌胃葛根素 400 mg / kg,E 组灌胃 20 mg / kg 阿托伐他汀及 400 mg / kg 葛根素,每天 1 次,连续8 周。第 8 周治疗结束后 2 h,采集各组大鼠血样,收集血清于 -80 ℃ 保存待测;处死大鼠,采集左侧股骨头组织,按后续操作用于组织病理学检测;采集右侧股骨头,剔除软骨,置于盛有 1 ml Trizol 的研磨器中仔细研碎,按后续操作提取骨标本总 RNA。
六、检测指标
1. 血清指标检测:采用 ELISA 试剂盒检测各组大鼠血清 PGE2、TXB2、TGF-β1 含量。
2. RT-PCR 检测:按试剂盒说明书,提取大鼠总 RNA,检测 A260 和 A280 吸光度值,电泳确定RNA 的完整性后,按照 PrimeScript RT reagent Kit 说明书合成 cDNA 第一链。设计 BMP-2、COX-2、TGF-β1、VEGF 上下游引物,以 β-actin 作为内参基因,按照 SYBR Premix Ex Taq II Kit 说明书,检测股骨头组织 BMP-2、COX-2、TGF-β1、VEGF mRNA表达量。
3. 组织病理检测:采集的股骨头组织,于多聚甲醛固定 3 天后进行脱水脱钙处理,二甲苯透明,石蜡包埋,切片,取部分切片 HE 染色,镜下观察骨髓细胞以及骨髓内脂肪细胞,骨小梁以及骨细胞。
4. 免疫组化检测:采用免疫组化 SABC 方法,检测股骨头组织 cAMP、PGE2 表达。镜下观察细胞膜、细胞质及细胞外基质中出现棕黄色反应产物判定为阳性。照相后采用图像分析软件 Image-Pro Plus 6.0 ( 美国 Media Cybernetics 公司 ) 进行光密度测定和图像分析。
5. 细胞凋亡检测:石蜡切片,经脱蜡水化后,根据 TUNEL 凋亡试剂盒说明书操作,镜下观察骨细胞凋亡情况。计算细胞凋亡指数 ( AI )。计算公式:AI=凋亡细胞数 / 细胞总数×100%,取平均数。
七、统计学处理
运用 SPSS 20.0 软件对模型和空白对照组进行t检验;各治疗组与模型组间进行单因素方差统计分析,定量资料以±s描述,除特别说明外,检验水准 α 均设定为 0.05,以P<0.05 为差异有统计学意义。
结 果
一、血清指标检测
模型组大鼠血清 PGE2、TXB2 含量较空白对照组明显增加 (P<0.01 ),TGF-β1 含量明显降低 (P<0.01 )。通过不同药物干预,阿托伐他汀组和联合用药组 PGE2、TXB2 含量较模型组明显降低 (P<0.05,P<0.01 ),TGF-β1 含量明显升高 (P<0.01 ),葛根素组 PGE2、TXB2、TGF-β1 含量较模型组无明显变化 (P>0.05 ) ( 表 1 )。
二、RT-PCR 检测
RT-PCR 结果显示模型组较空白对照组股骨头组织 BMP-2、TGF-β1、VEGF mRNA 表达明显降低 (P<0.01 ),COX-2 mRNA 表达明显增加 (P<0.01 )。经不同药物干预,与模型组比较,葛根素组 BMP-2、VEGF mRNA 表达明显增加 (P<0.05 ),COX-2、TGF-β1 mRNA 表达差异无统计学意义 (P>0.05 );联合用药组 BMP-2、TGF-β1、VEGF mRNA 表达均明显增加 (P<0.01 ),COX-2 mRNA 表达明显降低 (P<0.05 );阿托伐他汀组 BMP-2、COX-2、TGF-β1、VEGF mRNA 表达差异无统计学意义 (P>0.05 ) ( 表 2 )。
三 、组织病理检测
空白对照组:成骨细胞数量多,骨细胞清晰,骨小梁排列规则整齐,造血细胞丰富。模型组:骨小梁数量、骨细胞数量、软骨下血管、造血细胞数量均减少,脂肪细胞体积增大,血管减少。
阿托伐汀组:成骨细胞及造血细胞多见,骨小梁较粗,空骨陷窝少,髓腔内无出血,脂肪细胞基本正常。
葛根素组:骨细胞数目增多,造血细胞及成骨细胞多见,脂肪细胞基本正常。联合用药组:软骨细胞、骨细胞排列整齐,骨小梁致密,髓腔内有大量造血细胞,脂肪细胞分布均匀,造血细胞丰富。
联合用药组较两组单一用药组,骨小梁增宽更明显,间距更小,且骨髓细胞和造血细胞增生更明显,修复效果更佳 ( 图 1 )。
四、免疫组化检测
免疫组化结果显示 cAMP、PGE2 在股骨头组织中表达趋势一致,均表现为模型组明显高于空白对照组 (P<0.01 );3 组药物治疗组均可明显降低股骨头组织 cAMP、PGE2 的表达 (P<0.01 ) ( 表 3、2 )。
表1 各组大鼠血清中相关因子的含量 (±s)Tab.1 Contents of related factors in serum of each group of rats (±s)
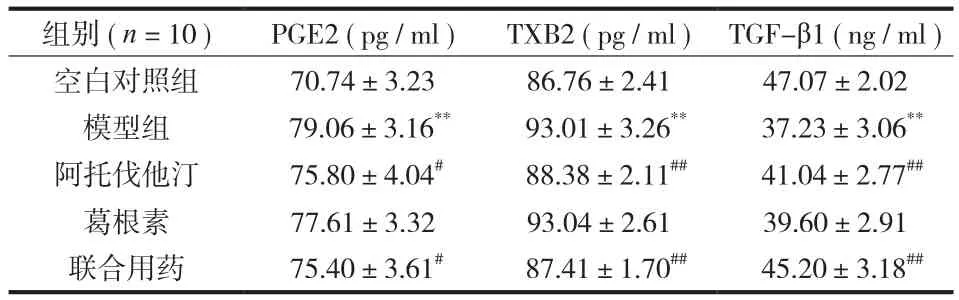
表1 各组大鼠血清中相关因子的含量 (±s)Tab.1 Contents of related factors in serum of each group of rats (±s)
注:模型组与空白对照组比较,**P<0.01;各治疗组与模型组比较,#P<0.05,##P<0.01Notice: The model group was compared with the blank control group, **P < 0.01;each treatment group was compared with the model group, #P < 0.05, ##P < 0.01
组别 ( n = 10 ) PGE2 ( pg / ml ) TXB2 ( pg / ml ) TGF-β1 ( ng / ml )空白对照组 70.74±3.23 86.76±2.41 47.07±2.02模型组 79.06±3.16** 93.01±3.26** 37.23±3.06**阿托伐他汀 75.80±4.04# 88.38±2.11## 41.04±2.77##葛根素 77.61±3.32 93.04±2.61 39.60±2.91联合用药 75.40±3.61# 87.41±1.70## 45.20±3.18##
表2 各组大鼠股骨头组织中相关基因的表达量 (±s)Tab.2 Expression levels of related genes in the femoral head tissue of each group of rats (±s)
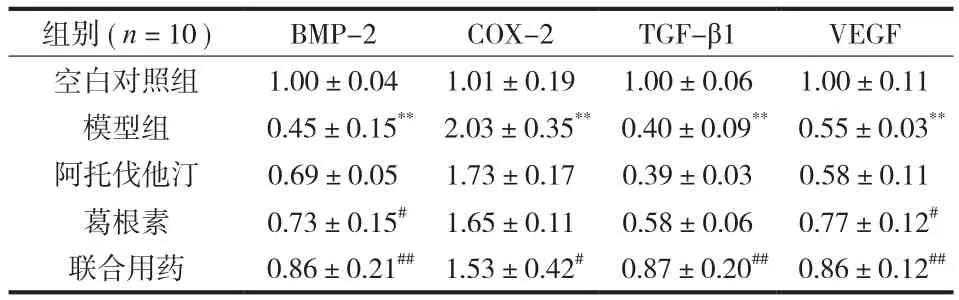
表2 各组大鼠股骨头组织中相关基因的表达量 (±s)Tab.2 Expression levels of related genes in the femoral head tissue of each group of rats (±s)
注:模型组与空白对照组比较,**P<0.01;各治疗组与模型组比较,#P<0.05,##P<0.01Notice: The model group was compared with the blank control group, **P < 0.01;each treatment group was compared with the model group, #P < 0.05, ##P < 0.01
组别 ( n = 10 ) BMP-2 COX-2 TGF-β1 VEGF空白对照组 1.00±0.04 1.01±0.19 1.00±0.06 1.00±0.11模型组 0.45±0.15** 2.03±0.35** 0.40±0.09** 0.55±0.03**阿托伐他汀 0.69±0.05 1.73±0.17 0.39±0.03 0.58±0.11葛根素 0.73±0.15# 1.65±0.11 0.58±0.06 0.77±0.12#联合用药 0.86±0.21## 1.53±0.42# 0.87±0.20## 0.86±0.12##
表3 各组大鼠股骨头组织中的免疫指标结果 (±s)Tab.3 Results of immunological indicators in femoral head tissues of each group of rats (±s)
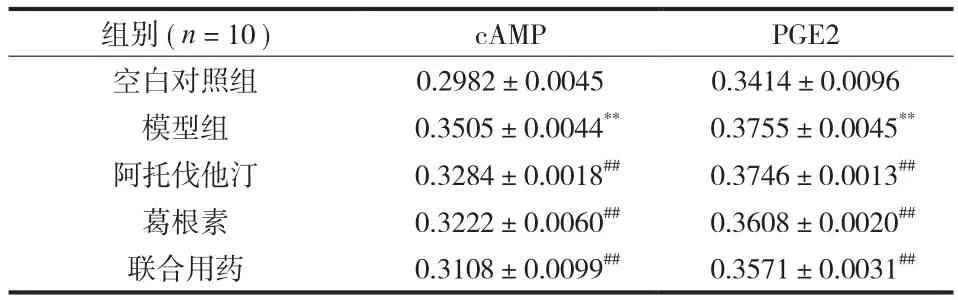
表3 各组大鼠股骨头组织中的免疫指标结果 (±s)Tab.3 Results of immunological indicators in femoral head tissues of each group of rats (±s)
注:模型组与空白对照组比较,**P<0.01;各治疗组与模型组比较,##P<0.01Notice: The model group was compared with the blank control group, **P < 0.01;each treatment group was compared with the model group, ##P < 0.01
组别 ( n = 10 ) cAMP PGE2空白对照组 0.2982±0.0045 0.3414±0.0096模型组 0.3505±0.0044** 0.3755±0.0045**阿托伐他汀 0.3284±0.0018## 0.3746±0.0013##葛根素 0.3222±0.0060## 0.3608±0.0020##联合用药 0.3108±0.0099## 0.3571±0.0031##
五、TUNEL 细胞凋亡检测
细胞凋亡结果显示模型组较空白对照组细胞凋亡指数明显升高 (P<0.01 ),3 组药物治疗组均可明显降低细胞凋亡指数 (P<0.01 ),其中联合用药组凋亡指数最低 ( 表 4,图 3 )。
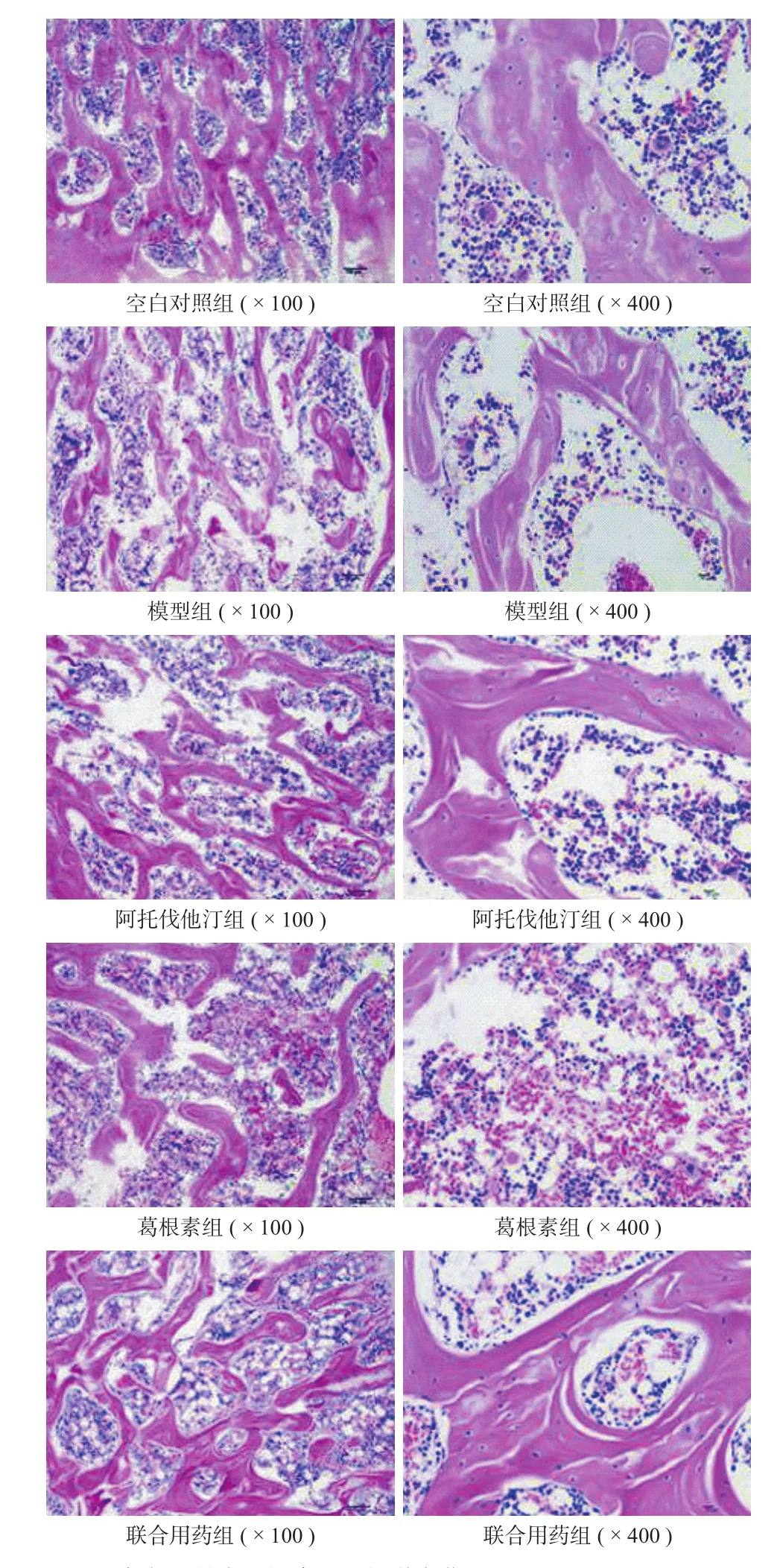
图1 大鼠股骨头组织病理组织学变化 ( HE )Fig.1 Histopathological changes of rats femoral head tissue ( HE )
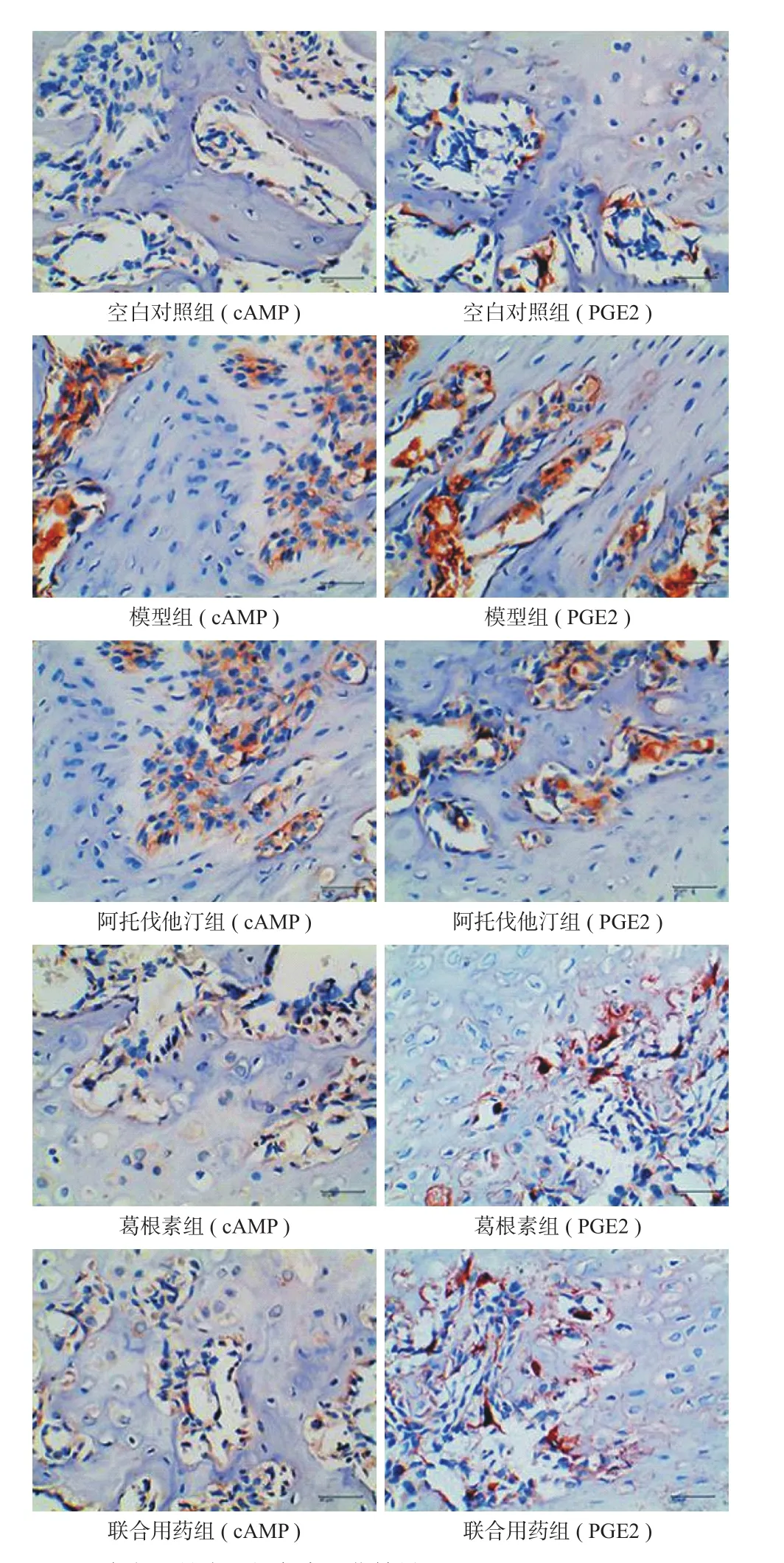
图2 大鼠股骨头组织免疫组化结果 ( × 400 )Fig.2 Results of immunohistochemical in rats femoral head tissue( × 400 )
表4 各组大鼠股骨头组织细胞凋亡指数 (±s)Tab.4 Apoptosis index of femoral head tissues in each group of rats(±s)

表4 各组大鼠股骨头组织细胞凋亡指数 (±s)Tab.4 Apoptosis index of femoral head tissues in each group of rats(±s)
注:模型组与空白对照组比较,**P<0.01;各治疗组与模型组比较,##P<0.01Notice: The model group was compared with the blank control group, **P < 0.01;each treatment group was compared with the model group, ##P < 0.01
组别 ( n = 10 ) 凋亡指数空白对照组 2.99±0.31模型组 27.55±2.35**阿托伐他汀 6.20±1.58##葛根素 8.73±1.00##联合用药 3.94±0.62##
讨 论
SANFH 是糖皮质激素过量使用,导致股骨头缺血、骨细胞大量死亡而引发的骨科常见疾病,致残率极高[10]。本试验在大鼠 SANFH 模型基础上,分别采用阿托伐他汀、葛根素及二者联合用药治疗,首先从组织病理角度考察疗效。结果表明,模型组骨小梁骨细胞数量、造血细胞数量均减少,脂肪细胞体积增大。阿托伐汀、葛根素单一用药可使周围成骨细胞及骨细胞数增多,造血细胞数增加,脂肪细胞基本正常。联合用药组的骨细胞排列整齐,骨小梁致密,造血细胞丰富,脂肪细胞分布均匀。联合用药组较两组单一用药组,骨小梁增宽更明显,间距更小,且骨髓细胞和造血细胞增生更明显,修复效果更佳,表明阿托伐汀和葛根素均可明显减轻SANFH 病理损伤。同时,本研究还考察了不同药物对骨细胞凋亡的影响,结果显示,模型组细胞凋亡指数较空白组明显升高 (P<0.01 ),3 个药物组细胞凋亡指数较模型组均明显降低 (P<0.01 ),联合用药较单一用药降低更明显,表明联合用药可更好地促进成骨细胞增殖,诱导骨形成。

图3 大鼠股骨头组织细胞凋亡Fig.3 Apoptosis of rats femoral head tissue
SANFH 发病机制的两种主要学说为血管内凝血学说和脂肪代谢紊乱学说,围绕学说开展调控机制研究[11]。PGE2 不仅可直接刺激神经末梢提高痛觉感受器的敏感性,与炎性致痛物质作用而引起疼痛[12],且可双向调节骨生成,低浓度 PGE2 可以促进骨生成,高浓度 PGE2 则可刺激骨吸收[13]。骨形成过程主要依赖于破骨细胞主导的骨吸收和成骨细胞主导的骨生成两个过程[14-15]。当骨生成小于骨吸收,会出现骨丢失现象,如:骨矿含量和骨基质成分等比例的减少、骨皮质变薄、骨小梁减少变细,从而导致骨坏死,而当机体内 PGE2 浓度过高,将刺激破骨细胞骨吸收。本试验检测结果显示,模型组血清及股骨头组织 PGE2 含量较空白组均明显升高 (P<0.01 ),与模型组比较,葛根素联合阿托伐他汀组 PGE2 含量明显降低 (P<0.05 ),说明联合用药可以促进骨生成。TXB2 浓度过高,可凝聚血小板,形成血栓,引起股缺血,TXB2 与 PGE2 共同作用可加速骨坏死。COX-2 属于诱导性表达基因,一般情况下,COX-2 在机体内的大部分组织中几乎无表达[16]。但当其被刺激信号刺激时,将大量表达,且能够通过催化反应转化氨基酸,最终形成 PGE2。作为 PGE2 的限速酶,COX-2 能够调控 PGE2 的活性[17]。本试验检测发现,模型组 TXB2、COX-2 含量明显升高 (P<0.01 ),与模型组比较,葛根素、阿托伐他汀单一用药对 COX-2 含量降低无明显变化(P>0.05 ),阿托伐他汀组可明显降低 TXB2 含量(P<0.01 ),而联合用药组 TXB2、COX-2 含量均明显降低 (P<0.05,P<0.01 ),表明联合用药可抑制骨坏死。cAMP,作为 PGE2 介导的下游因子,在病理状态下,PEG2 可以通过 cAMP 介导的通路促进破骨过程。当 COX-2 / PGE2 / cAMP 通路被激活,COX-2、PGE2、TXB2、cAMP 均大量释放,共同加速骨坏死进程。免疫组化试验发现 cAMP 含量模型组较空白组明显升高 (P<0.01 ),3 个药物治疗组cAMP 表达较模型组均明显降低 (P<0.01 ),且联合用药组低于单一用药组。TGF-β1 可以促进骨细胞增殖、调控未分化间充质干细胞增殖分化、支持破骨细胞形成、促进骨与血管形成以及骨吸收的作用,是重要的耦联调节因子[18]。RT-PCR 结果显示模型组TGF-β1 mRNA 表达较空白组明显降低 (P<0.01 ),仅联合用药较模型组可明显升高 TGF-β1 mRNA 表达(P<0.01 )。软骨内成骨是骨形成的重要过程,而在软骨内成骨过程中,需新生成血管,VEGF 则是促进血管形成的重要调节因子。BMP 是促进成骨细胞分化、诱导骨形成的重要活性物质[19],其中 BMP-2 的活性最强。有研究发现 VEGF 与 BMP-2 相互调节,共同促进骨形成以及骨愈合[20]。RT-PCR 检测结果显示模型组 VEGF、BMP-2 mRNA 表达较空白组明显降低 (P<0.01 ),葛根素组、联合用药较模型组BMP-2、VEGF mRNA 表达明显升高 (P<0.05,P<0.01 ),联合用药较单一用药升高更明显,表明联合用药还可通过提高股骨头组织 VEGF、BMP-2 mRNA表达促进骨形成及骨愈合。
综上所述,葛根素联合阿托伐他汀可通过抑制COX-2 / PGE2 / cAMP 信号通路,明显减轻股骨头坏死症状,抑制破骨细胞的吸收能力,加强成骨细胞分化,减少骨丢失。
