稳定表达RFP-GFP-LC3的大鼠胰岛β细胞株的构建
2019-05-23周佳丽吴艳阳罗玉霜袁玉菊刘明俊刘东波
周佳丽,吴艳阳,罗玉霜,袁玉菊,刘明俊,刘东波,4,5*
(1.湖南农业大学园艺园林学院,中国湖南长沙410128;2.湖南农业大学食品科学技术学院,中国湖南长沙410128;3.国家中医药管理局亚健康干预技术实验室,中国湖南长沙410128;4.湖南省作物种质创新与资源利用重点实验室,中国湖南长沙410128;5.湖南省植物功能成分利用协同创新中心,中国湖南长沙410128;6.湖南省马王堆医院,中国湖南长沙410128)
糖尿病是一种全球性的、以持续高血糖症为特征的代谢紊乱疾病。血糖异常升高的原因可能是胰岛素自身分泌缺陷(1型糖尿病,T1D),或肝脏等效应器官产生胰岛素抵抗,或胰岛素分泌不足(2型糖尿病,T2D)[1]。在T1D和T2D的情况下,持续高浓度的葡萄糖会引起细胞内抗氧化能力的失衡,导致亚硝基介导的氧化应激和损伤。氧化和糖化蛋白的积累是糖尿病相关的常见蛋白质修饰,其部分原因可能是自噬缺陷[2]。因此,越来越多的研究认为相关细胞自噬可能有利于糖尿病的治疗。β细胞是人体内唯一能够分泌胰岛素的功能细胞,研究β细胞的自噬对于糖尿病的治疗与控制具有重大意义。相关研究报道,β细胞自噬可通过调控胰岛素颗粒的降解来影响细胞胰岛素的释放[3~4]。
自噬是真核细胞内一种高度保守的再循环过程,它通过降解细胞质中的细胞器、蛋白质和大分子物质,对分解产物进行再利用。自噬在细胞存活和功能维持中起着重要作用[5]。细胞自噬由多个步骤组成,其中包括:1)吞噬泡的形成;2)自噬体的形成;3)自噬体与溶酶体融合形成自噬溶酶体;4)自噬溶酶体的降解[6]。自噬流是这些步骤在细胞内连续出现的动态过程,自噬流的活化或受阻往往会形成不同的生物学效应[7]。人们在研究过程中逐渐发现,自噬流受阻可能诱发多种疾病[7]。微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)是自噬体膜标志物,一般散在分布于细胞质[8]。在自噬过程中,胞质形式的LC3(LC3-Ⅰ)与磷脂酰乙醇胺结合形成LC3-磷脂酰乙醇胺结合物(LC3-Ⅱ)[9]。红色荧光点-绿色荧光点-LC3(red fluorescence point-green fluorescence point-LC3,RFP-GFP-LC3)融合蛋白是一种方便的自噬荧光蛋白标记物。在自噬发生初期,胞浆型LC3转变为膜型LC3,在荧光显微镜下可观察到红色/绿色共定位的点状聚集。自噬后期,溶酶体与自噬体融合形成自噬溶酶体,细胞环境pH发生变化。当环境pH<5时,GFP荧光敏感发生淬灭,只能检测到红色荧光点状聚集[10]。因此可以通过GFP荧光点与RFP荧光点比例来评价自噬流进程。
目前可通过瞬时转染的方法检测自噬流,通过在细胞中瞬时高表达RFP-GFP-LC3质粒来进行后续实验[11],但是瞬时转染的方法具有稳定性差、转染效率低等缺点。为解决这一问题,我们通过慢病毒转染的方法构建了能够稳定表达RFPGFP-LC3质粒的大鼠胰岛β细胞株,这将有利于研究自噬在胰岛β细胞中的作用,同时也可将其用于治疗糖尿病药物的初步筛选。
1 材料与方法
1.1 材料
慢病毒包装系统(该病毒系统包括VSVG质粒、Δ8.9 质粒);293FT 细胞、RIN-m5f细胞株(湖南农业大学亚健康实验室冻存);DH5α感受态细胞(北京全式金生物技术有限公司)。DMEM培养基、1640培养基、胎牛血清(fetal bovine serum,FBS)(Biological Industries公司,以色列);Trypsin-EDTA细胞消化液(北京全式金生物技术有限公司);LipofectamineTM3000转染试剂(Thermo公司,美国);G418试剂(Sigma公司,美国);防荧光淬灭封片剂(SouthernBiotech公司,美国);SQSTM1/P62(sequestosome 1)抗体、S6K(ribosomal protein S6 kinase)抗体、phospho-S6K抗体(CST公司,美国);GAPDH(glyceraldehyde-3-phosphate dehydrogenase)抗体[亚太恒信生物科技(北京)有限公司];6×loading buffer(北京全式金生物技术有限公司)。激光共聚焦显微镜(Zeiss LSM710);倒置荧光显微镜(Leica DMI8)。
1.2 慢病毒载体构建
慢病毒载体构建由上海吉凯基因科技有限公司完成,构建过程主要参照文献[12]的方法,简要概述如下:用PCR从PCMV-RFP-GFP-LC3质粒中扩增RFP-GFP-LC3片段;扩增产物10 g/L琼脂转化,筛选出重组质粒,得到RFP-GFP-LC3-GV374质粒。经过测序比对确认慢病毒载体构建成功(图1),提取重组质粒,纯化溶解,-20℃保存。
1.3 慢病毒的包装制备
用含有10%FBS的DMEM基础培养基于37℃、5%CO2培养箱中培养293FT细胞,细胞状态良好。待细胞汇合至90%左右,将其用含0.25%EDTA的胰酶消化,种入6孔板中,培养24 h。待细胞汇合度达50%左右时,进行换液处理并按照转染试剂LipofectamineTM3000的说明书进行操作。即将VSVG质粒、Δ8.9质粒、RFP-GFP-LC3质粒进行质量浓度1∶1∶1的共转染,转染完成后将细胞置于37℃、5%CO2培养箱中继续培养24 h。到达时间后,于倒置荧光显微镜下观察转染效率,并收集细胞上清液,3 000 r/min离心10 min,去除残余的293FT细胞杂质,即得到已包装好RFP-GFP-LC3质粒的慢病毒颗粒。
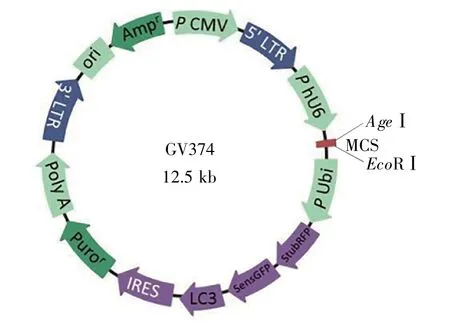
图1 LC3自噬流检测慢病毒载体图谱Fig.1 The vector of lentivirus for detecting LC3
1.4 稳定细胞株的筛选
转染前一天,将RIN-m5f用0.25%EDTA胰酶进行消化,种入6孔板中。用含10%FBS的1640培养基培养24 h后,将收集的慢病毒颗粒加入细胞培养液中,对细胞进行换液处理。24 h后,在倒置荧光显微镜下观察转染情况,并更换新的培养基。感染约48 h后,加入嘌呤霉素进行筛选培养。预实验提示RIN-m5f细胞的嘌呤霉素最佳筛选质量浓度为6 μg/mL。筛选培养约7 d后,未经感染的对照组细胞全部死亡,感染组有阳性克隆细胞生长,荧光显微镜下可见RFP荧光与GFP荧光。用0.25%EDTA胰蛋白酶消化阳性克隆细胞,转移到新的培养皿中继续培养2 d,随后收集感染病毒的稳定细胞株,用细胞免疫荧光的方法检测RFP-GFP-LC3的表达。
1.5 自噬的诱导及自噬流的检测
构建成功的细胞以1×105的数目种入24孔板中,37℃、5%CO2条件下培养过夜。待细胞汇合至70%左右,对照组使用含10%FBS的1640培养基继续培养,饥饿组加入无血清1640培养基饥饿2 h,在饥饿+氯喹(chloroquine,CQ)组,使用10 μmol/L的氯喹与饥饿共处理2 h。到达预定处理时间后,用PBS清洗两遍,将玻片夹出反向固定于载玻片上,于激光共聚焦下拍摄RFPGFP-LC3荧光点。
1.6 Western-blot分析
构建成功的细胞以1×105的数目种入24孔板中,37℃、5%CO2条件下培养过夜。待细胞汇合至95%左右,加入无血清1640培养基饥饿处理2 h,在饥饿+CQ组,使用10 μmol/L的氯喹与饥饿共处理2 h。到达预定时间后,用PBS洗涤细胞,每孔加入200 μL 2%SDS细胞裂解液,迅速将细胞刮下收集。每管加入40 μL的6×loading buffer,煮至蛋白质变性,蛋白质可置于-20℃冰箱保存备用。12%SDS-PAGE电泳后,电转移至PVDF膜上,封闭液室温封闭1 h,按照1∶1 000的稀释比例,分别孵育 P62、S6K、P-S6K、GAPDH一抗,4℃过夜,加入对应二抗稀释液(1∶5 000),室温孵育1 h,ECL发光显影。
1.7 统计学处理
2 结果
2.1 稳定细胞系的筛选
慢病毒转染48 h后,用嘌呤霉素对已转染细胞株进行筛选。大约7 d后,经过筛选的细胞如图2所示,在荧光显微镜下观察到100%表达红色/绿色荧光,表明稳定表达RFP-GFP-LC3的大鼠胰岛细胞已经建立成功。
2.2 自噬的诱导以及自噬流的检测
如图3A所示,在本实验中可明显观察到对照组中自噬体较少且红色荧光与绿色荧光的表达量一致。经过饥饿自噬诱导以后,自噬点显著增加,细胞中绿色荧光点的表达量显著低于红色荧光的表达量。该现象是由于饥饿诱导形成了自噬流,自噬体与溶酶体结合形成自噬溶酶体,在自噬溶酶体的酸性环境下,绿色荧光点发生淬灭。在对细胞进行饥饿处理的同时加入10 μmol/L的CQ,发现绿色荧光的表达量较饥饿组略有回升。这是因为自噬阻断剂CQ部分阻断了自噬体与溶酶体的结合,从而导致绿色荧光表达量的上升。单个细胞中红绿荧光点的比值在各组间具有统计学差异(图 3B)。
2.3 自噬诱导后相关蛋白质的表达分析
细胞经过无血清饥饿处理2 h后用2%SDS溶液裂解,收集总蛋白质,采用Western-blot的方法检测自噬相关蛋白质P62及S6K的表达水平。结果如图4所示,自噬底物P62蛋白的水平下降,与此同时m-TOR活性评价蛋白质S6K的磷酸化水平下降,由此证明自噬流被成功诱导,与图3结果所示一致。

图2 RIN-m5f细胞的荧光显微镜观察图(100×)(A)透射光下的RIN-m5f细胞株;(B)绿色荧光下的RIN-m5f细胞株;(C)红色荧光下的RIN-m5f细胞株。Fig.2 The RIN-m5f cells observed by fluorescence microscopy(100×)(A)Transmitted light image;(B)Green fluorescence image;(C)Red fluorescence image.

图3 激光共聚焦下观察RFP-GFP-LC3稳定细胞株中自噬体的形成(A)2 h血清饥饿后,RFP-GFP-LC3稳定细胞株中自噬体的形成图(标尺50 μm);(B)图A中绿色荧光点/红色荧光点的统计结果。**:P<0.01,与对照组相比;#:P<0.05,与饥饿组相比。Fig.3 Observation of autophagy formation in RFP-GFP-LC3 stable cell line under laser scanning microscopy(A)The formation of autophagosomes in RFP-GFP-LC3 stable cell line after serum starvation for 2 h (scale bar 50 μm);(B)The cells were treated as described in(A)and the statistical results of green/red fluorescence points were analysed by SPSS 10.0 software.**:P<0.01 vs.control group;#:P<0.05 vs.starvation group.

图4 无血清饥饿2 h后,Western-blot检测RFP-GFPLC3稳定细胞株中相关蛋白质表达水平的变化Fig.4 The protein levels of P62,GAPDH,S6K and PS6K were tested by Western-blot after 2 h of serumfree starvation in RFP-GFP-LC3 stable cell line
3 讨论
近年来,越来越多的证据表明,自噬是一种治疗糖尿病的新靶点,具有多种有益作用。同时许多药物和天然产物通过多种信号途径参与自噬调节,包括诱导或抑制自噬[13]。有实验研究表明传统中药消渴平可通过诱导自噬抑制小鼠胰岛细胞在高糖培养下的细胞凋亡[14],这对于糖尿病的研究具有重大意义,同时也提示自噬的精准检测愈发重要。目前,通过细胞免疫荧光技术以及Western-blot对LC3-Ⅰ和LC3-Ⅱ的检测,并不能完整地反映自噬的整体过程。本实验通过慢病毒转染的方法,将已融合的红色荧光蛋白、绿色荧光蛋白与LC3蛋白转入RIN-m5f细胞,这样能够在较为简单的共聚焦活细胞拍摄下,清楚观察到细胞自噬的整个过程,实验简便易行。
双荧光RFP-GFP-LC3体系是比GFP-LC3更全面可靠的自噬定量分析方法。该体系最大的优点是不需要外加其他药物干预,可以同时直观地判断细胞自噬活性和自噬流(自噬通量)的变化[15~16]。在本研究中,我们运用慢病毒转染的方法,成功构建了表达RFP-GFP-LC3的大鼠胰岛β细胞株,并通过G418进行筛选,运用激光共聚焦拍摄手段进行检测,发现细胞最终能100%表达RFPGFP-LC3质粒。在此基础上,根据RFP与GFP对pH的不同适应度[17~18],通过无血清饥饿诱导细胞自噬,结果显示:在饥饿条件下,绿色荧光点因溶酶体环境pH较低发生淬灭,而红色荧光点稳定存在,因此GFP/RFP荧光点的比值下降;当加入10 μmol/L氯喹部分阻断自噬流后,LC3无法与溶酶体融合,绿色荧光点数回升。这一实验现象符合饥饿诱导的自噬情况[19]。自噬是一个动态的过程,该双色荧光体系能够准确地同时显示和区分自噬体和自噬溶酶体,是检测自噬流的最佳方法[20]。目前,双荧光RFP-GFP-LC3已经逐渐得到许多学者的认可,在自噬相关研究中发挥了重要作用[21~23]。本实验中,稳定表达RFP-GFP-LC3质粒的大鼠胰岛细胞株的成功构建不仅解决了传统自噬检测手段——细胞免疫荧光技术需要相应一抗/二抗的孵育、实验成本较大、步骤繁琐耗时的缺点[24],而且为自噬在糖尿病的相关研究提供了细胞平台,有利于自噬相关机理药物在胰岛β细胞上的高通量筛选,为糖尿病药物的开发提供了便利。
