烟碱暴露对成瘾相关烟碱型乙酰胆碱受体的影响及调控机理
2019-05-23耿怡佳朱欣潮侯宏卫胡清源
耿怡佳,陈 欢,朱欣潮,侯宏卫,胡清源
(国家烟草质量监督检验中心,中国河南郑州450001)
烟草的烟气成分复杂,包含5 000多种化学成分[1],其中烟碱被认为是最重要的药理学成分。吸烟时烟碱随烟气进入肺部,而后经肺泡中的毛细血管吸收进入血液循环。摄入体内的烟碱能迅速通过血脑屏障,与中枢神经元表面的烟碱型乙酰胆碱受体(nicotinic acetylcholine receptors,nAChRs)结合,作用于中脑边缘多巴胺系统,进而产生奖赏效应[2]。已有研究表明,与非吸烟者相比,吸烟者脑部α4β2型nAChRs的表达量显著升高[3],重度吸烟者α7型nAChRs显著上调[4]。因此研究者推测,烟碱暴露对大脑中nAChRs的影响可能与烟碱成瘾密切相关。本文简要介绍了nAChRs的分类、结构以及测定方法,综述了烟碱暴露对nAChRs的影响,阐述了烟碱作用下nAChRs的变化趋势与烟碱成瘾的关系,并从细胞内nAChRs的组装、运输、成熟和降解以及组成与构象变化等各方面综述了烟碱调控nAChRs变化的相关机制。
1 nAChRs的种类和分布
nAChRs是半胱氨酸环配体门控离子通道(the cysteine-loop ligand-gated ion channel,cys-loop LGIC)超家族中的一员,该家族还包含5-羟色胺受体、γ-氨基丁酸A型受体和甘氨酸受体等,是介导脊椎动物和无脊椎动物突触传递的神经递质受体[5]。nAChRs是由5个相同或不同的亚基围绕中心离子通道构成的五聚体,其结构如图1[6]所示。目前已确认 17 种 nAChR 亚基(α1~α10、β1~β4、γ、δ、ε)[5],这些亚基通过不同的组合形成功能各异的nAChR亚型。
哺乳动物中的nAChRs分为肌肉型受体和神经型受体:肌肉型受体包含4种亚基,在成年哺乳动物和胚胎中分别为 α1、β1、δ、ε 和 α1、β1、δ、γ,而神经型受体仅由 α2~α10 和 β2~β4 亚基组成[5]。基于对α-银环蛇毒素的敏感程度,可将神经型nAChRs分为两类,一类是对α-银环蛇毒素敏感的受体亚型,包括α7~α10亚基,这4种亚基性质相似,既能单独组成仅包含一种亚基的均质五聚体,也能与其他亚基组合形成包含多种亚基的异质五聚体;另一类为对α-银环蛇毒素不敏感的受体亚型,由 α2~α6 和 β2~β4 亚基通过不同的组合形成异质五聚体[7]。
神经型nAChRs广泛分布在整个中枢神经系统、外周神经系统和大脑其他部位,在中枢神经系统中发挥重要的调节作用,可调节γ-氨基丁酸、谷氨酸、多巴胺、5-羟色胺、去甲肾上腺素和乙酰胆碱等多种神经递质的释放[8]。α4β2*nAChRs(符号“*”表示可能存在其他亚基)是脑中最丰富的异质受体,主要分布于中枢神经系统,并对烟碱具有高亲和力[9]。α7*nAChRs也是中枢神经系统中广泛表达的受体亚型,主要存在于皮质、海马、杏仁核、小脑、下丘脑、嗅区、脊髓中,对烟碱的亲和力较低[5]。α3*nAChRs也存在于中枢神经系统中,但不如 α7*nAChRs 或 α4β2*nAChRs 普遍[6]。nAChRs在认知功能、精神疾病以及药物成瘾中的作用一直是研究的热点,目前已有许多报道对nAChRs的分类、结构等进行了全面的论述[10~12]。
2 受体表达的测定方法

图1 nAChR的带状结构示意图[6](A)俯视图;(B)侧视图。两条水平灰线表示膜平面。Fig.1 Ribbon diagrams of the nAChR structure[6](A)Top view;(B)Side view.Two horizontal gray lines indicate the membrane plane.
nAChRs分布在脑部各个区域,且不同区域数量不同,使用放射性配体对nAChRs进行显像能够检测nAChRs在不同脑区的分布和表达差异。大多数脑成像研究聚焦于脑内表达水平最高的 α4β2*nAChRs和 α7*nAChRs,目前已开发出多种放射性配体来实现成像,其中一些已成功应用于临床研究。表1总结了一些主要的nAChRs放射性配体的种类和特点。其中,最早使用的放射性同位素是[3H]-烟碱、[11C]-烟碱以及[3H]-乙酰胆碱[13],主要结合α4β2*nAChRs,但具有高度非特异性结合与代谢快的特点,成像性能较差[14]。之后出现了[3H]-野靛碱[15]以及可被[3H]或[125I]标记的地 棘 蛙 素[16~17]。[3H]-野 靛碱主 要 结 合 α4β2*nAChRs,但同时对α3*nAChRs也具有高亲和力,而地棘蛙素可针对多种受体亚型,只能用来反映nAChRs整体的变化,且其毒副作用也限制了进一步的应用研究。α4β2受体激动剂2-[18F]-FA-85380(2-[18F]fluoro-3-[2(S)-2-azetidinylmethoxy]pyridine)是目前最成熟的研究人脑α4β2*nAChRs的放射性配体,对nAChRs的选择性和特异性高,对人体无损害,但其在人脑中表现出缓慢的分布动力学,具有较长的扫描时间,因此需要开发性能更好的nAChRs放射性示踪剂[18~19]。近年来,人们开发了包括[18F]nifene(2-[18F]-fluoro-3-[2-((S)-3-pyrrolinyl)methoxy]pyridine)和(-)-[18F]Flubatine((-)-[18F]norchloro-fluoro-homoepibatidine)在内的新型nAChRs放射性配体,这些新型配体具有优于2-[18F]-FA-85380的检测性能[20~21],可大大缩短扫描时间,对于临床研究具有十分重要的作用。[11C]CHIBA-1001(4-[11C]methylphenyl-1,4-diazabicyclo[3,2,2]nonane-4-carboxylate)是可应用于人体的α7*nAChRs放射性配体,但它在脑部的特异性结合较差[22]。近年来发现的[18F]标记的ASEM(4-(6-fluorodibenzo[b,d]thiophen-3-yl)-1,4-diazabicyclo[3,2,2]nonane 5,5-dioxide),即[18F]ASEM,是对α7*nAChRs具有高特异性和选择性的放射性配体,在啮齿动物和狒狒的研究中表现出优异的体内成像性能,并成功应用于人脑活体成像的研究,为研究人脑中α7*nAChRs开拓了新的视野[23]。此外,Sarasamkan等[24]合成出首个用于 α3β4*nAChRs分子成像的放射性配体(S)-[18F]T1((S)-[18F]-3-(4-(4-fluorophenyl)-1H-1,2,3-triazol-1-yl)quinuclidine),而且针对小鼠和猪大脑的分析表明(S)-[18F]T1在脑区的结合与α3β4*nAChRs的表达有关,这使得(S)-[18F]T1成为对脑内α3β4*nAChRs进行成像研究的潜在工具。
目前,正电子发射断层扫描(positron emission tomography,PET)是进行活体脑部非侵入性研究的最先进的方法,在量化放射性的区域分布和时间测量方面表现出较好的分辨率和准确性,因而优于其他所有成像模式[25]。但是,现有的放射性配体各有不足,针对不同受体的新型配体尚处于研究中,且多限于动物实验,毒性与安全性尚未确定,因而制约了人脑中nAChRs PET成像研究的发展,今后需要筛选出可以进行快速成像分析的更理想的放射性配体用于nAChRs的研究。
此外,使用放射性配体也可通过体外途径对nAChRs的分布和变化进行研究。体外研究通常使用放射性标记的化合物与nAChRs进行结合,然后利用液体闪烁计数、放射自显影、免疫沉淀等手段检测受体的分布,测定烟碱暴露引起的受体结合位点的变化,从而评价烟碱对受体的影响。
Marks等[26]采用放射性标记的化合物与大脑切片结合后进行放射自显影,比较了慢性烟碱暴露下 α4β2*nAChRs和 α6β2*nAChRs的表达变化。Whiteaker等[27]使用[125I]单克隆抗体免疫标记α4和β2亚基,通过放射自显影来对受体的表达进行定位和定量。放射自显影技术通过放射性标记的配体或抗体特异性结合受体来进行定位分析,从组织水平测定受体的分布和数量,具有直观、操作简便、灵敏度高等优点,但还存在一定的应用局限:nAChRs在许多大脑区域以低水平表达,当配体具有相对高的非特异性结合时,其分辨率不足以鉴定一些亚型的结合位点,同样也难以可靠地鉴定特异性免疫标记[28]。

表1 nAChRs放射性配体的种类和特点Table 1 Species and characteristics of nAChRs radioligand
Lai等[29]使用抗β2和α4亚基的单克隆抗体吸附[125I]-地棘蛙素结合的受体,然后通过液体闪烁计数测定受体结合位点的变化。Gotti等[30]用亚基特异性抗体免疫沉淀证明在皮质和丘脑中超过70%的[3H]-地棘蛙素结合位点仅包含α4和β2亚基,随后进一步用蛋白质印迹法分析α4、β2基因的野生型和杂合子小鼠两个脑区中α4和β2亚基的含量。免疫沉淀可通过不同nAChR亚基的特异性抗体免疫吸附放射性标记的受体,然后使用液体闪烁计数测定受体结合位点的变化,并结合蛋白质印迹法测定受体的表达,虽然所使用的特异性抗体对受体具有高亲和力与特异性,但无法直观显示受体的分布。
Moretti等[31]使用抗α7和β2亚基的抗体从样品中纯化nAChRs,然后通过蛋白质印迹法对特定脑区中两种亚基的水平进行分析。蛋白质印迹法通过凝胶电泳分离蛋白质,使用特异性抗体或抗原与靶蛋白结合进行染色观察或直接鉴定,无需进行放射性同位素标记,具有高分辨率和高特异性,可用于定量测定nAChR亚基含量水平,但同样无法实现定位分析。
另外,荧光标记的nAChR亚基已应用于检测转染nAChR亚基的细胞中烟碱诱导的上调,以及构建基因敲除和敲入小鼠模型[32~33]。Nashmi等[34]将胞浆结构域中已分别融合了黄色荧光蛋白(yellow fluorescent protein,YFP)和青色荧光蛋白(cyan fluorescent protein,CFP)的α4和β2亚基转染到培养的人胚肾细胞和中脑腹侧的神经元中,当暴露于烟碱时两种细胞均显示出α4-YFP亚基荧光的增加,与烟碱诱导的α4亚基数量的增加一致,而且α4-YFP亚基荧光的增加与α4β2受体的功能性上调相关,这证明检测α4-YFP亚基荧光信号可以表征α4β2受体的功能性上调。
3 烟碱暴露下nAChRs的变化及其在烟碱成瘾中的作用
烟碱和乙酰胆碱结构相似,是nAChRs的激动剂,可结合并激活nAChRs。但烟碱不会被乙酰胆碱酯酶水解,因此烟碱在nAChRs附近的保持时间长于乙酰胆碱[35]。基于吸烟者和慢性烟碱暴露下动物大脑的研究表明,慢性烟碱暴露会引起[3H]-地棘蛙素标记的nAChRs数量增加[19]。这主要是由于烟碱暴露使得对烟碱具有高亲和力的α4β2*nAChRs发生上调。此外,α6、α7 和 α3 等nAChR亚型表现出对烟碱不同程度的灵敏度,烟碱暴露也会影响这些受体的表达。表2列出了烟碱暴露对不同nAChR亚型的影响以及亚基基因敲除小鼠模型中烟碱引起的行为学、生理学作用的变化。
3.1 α4β2*nAChRs
当烟碱到达中脑边缘多巴胺区域时可激活nAChRs,特别是具有高亲和力的α4β2*nAChRs。研究发现,慢性烟碱暴露(3~6 mg·kg-1·d-1,微泵给药14 d)的动物体内以及吸烟者的脑部均显示出由于α4β2*nAChRs数量增加而导致的[3H]-地棘蛙素结合的增加,在小鼠γ-氨基丁酸能神经元中烟碱暴露也可引起α4β2*nAChRs的上调[36]。此外,自给药模型下的间歇性烟碱暴露也可以使松鼠猴大脑整体水平上以及特定脑区(杏仁核和壳核)中α4β2*nAChRs发生上调[37]。Semenova 等[38]评价了烟碱戒断对α4β2*nAChRs表达的影响,发现同样的烟碱剂量下,间歇暴露后戒断使得腹侧被盖区和前边缘皮层中α4β2*nAChRs上调,而连续暴露后戒断使得伏隔核中α4β2*nAChRs上调。α4β2*nAChRs可以两种化学计量方式存在,即在五聚体中所含 α4 亚基数量不同的[(α4)2(β2)3]和[(α4)3(β2)2],两种亚型具有不同的药理学特性,并在慢性烟碱处理下产生不同的变化[39]。Fasoli等[40]研究了14 d慢性烟碱处理以及戒断对C57BL/6小鼠皮质和丘脑中α4β2*nAChRs的表达与β2/α4比例的影响,发现烟碱暴露使得皮质中[3H]-地棘蛙素结合的受体密度增加,同时α4和β2蛋白水平以及 β2/α4 亚基比例均增加,表明 α4β2*nAChRs中(α4)2(β2)3的比例增加,并且这些变化仅在烟碱暴露后短暂发生,戒断后即回到基准水平,而在丘脑中未观察到上述变化。当然,也有研究指出,烟碱暴露会使α4β2α5*nAChRs在海马区、纹状体区、大脑皮层和丘脑中的上调受到抑制,这种现象很可能是α5亚基的存在导致的[7]。有研究发现包含α5亚基的α4β2*nAChRs中,α5亚基可与相邻的α4亚基形成结合位点,并具有特殊的配体选择性,因而可能影响烟碱暴露下受体产生的变化[41]。
α4β2*nAChRs在烟碱奖赏、耐受及其引发的多巴胺释放和行为效应中发挥重要作用[42]。Renda等[43]在不同年龄小鼠的烟碱自给药模型中对包含α4亚基受体的表达进行了测定,发现VTA神经元细胞中α4*nAChRs的表达具有年龄差异,并与烟碱摄入量之间存在很强的正相关性,表明α4*nAChRs的表达水平在烟碱自给药中发挥作用。在针对大鼠的烟碱自给药和复吸行为的研究中,选择性结合(α4)3(β2)2的正向变构调节剂NS-9283(3-[3-(3-pyridyl)-1,2,4-oxadiazol-5-yl]benzonitrile)减弱了大鼠对烟碱的摄入和渴求[44],而在小鼠的烟碱戒断模型中使用正向变构调节剂dFBr(des-formylflustrabromine)特异性结合 α4β2*nAChRs,也可对小鼠的戒断症状产生消除作用[45]。Peng等[46]使用自给药和条件性位置偏爱(conditioned place preference,CPP)模型研究了α4亚基删除与烟碱奖赏相关行为之间的关系,结果表明腹侧中脑中α4亚基的删除阻断了烟碱诱导的CPP,并使得小鼠在提供的最高烟碱浓度下摄入更多的烟碱。以上信息表明,α4β2*nAChRs的表达变化对烟碱成瘾有着关键的作用,α4β2*nAChRs可作为今后开展烟碱成瘾治疗相关研究的核心靶点。
3.2 α6*nAChRs
在中脑和纹状体区域中鉴别出的几种主要的α6*nAChRs亚型包括 α6β2*nAChRs(不含 α4)和α4α6β2*nAChRs。有研究表明,在发现 α6*nAChRs的所有脑区域(包括腹侧被盖区、黑质致密层、上丘和内侧缰核)中,α6*nAChRs在慢性烟碱暴露下发生上调[47]。但是,基于啮齿动物的相关研究表明α6β2*nAChRs不随慢性烟碱暴露上调[48]。Perez等[49]的研究则进一步发现烟碱暴露下不含有 α4 亚基的 α6β2*nAChRs上调,而 α4α6β2*nAChRs则不发生上调。在烟碱自给药模型中,大鼠脑内α6*nAChRs数量表现出增加的趋势[50],但慢性烟碱给药(3~6 mg·kg-1·d-1,通过微泵给药14 d)或饮用水(50~300 μg/mL长达6周)则可减少中脑多巴胺神经元中 α6*nAChRs的数量[29,51~52]。Walsh等[53]将烟碱诱导的 α6β2*nAChRs上调情况与α3β2*nAChRs和 α4β2*nAChRs的上调情况作比较,发现α6β2*nAChRs上调的时间过程和浓度依赖性与 α3β2*nAChRs相似,但是与 α4β2*nAChRs相比,α6β2*nAChRs的上调快 10倍,不需要经过2~3 h的延迟,并且需要更高的烟碱浓度,这些差异表明受体的上调具有亚型特异性,而且可能发生在烟碱摄入的不同阶段。
α6*nAChRs在纹状体多巴胺释放、运动行为和烟碱自给药中起重要作用[51]。Beckmann等[54]研究发现,α6β2*nAChRs的选择性拮抗剂r-bPiDI(1,10-bis(3-methyl-5,6-dihydropyridin-1(2H)-yl)decane)可显著减弱大鼠的烟碱自给药(75%)。Sanjakdar等[55]采用 α6β2*nAChRs拮抗剂和 α6、α4亚基基因缺失小鼠,研究并比较了α6*nAChRs亚型在CPP模型中对烟碱奖赏的作用,结果显示伏隔核注射选择性α6β2*nAChRs拮抗剂可阻断烟碱CPP,表明烟碱的奖赏效应可能是由中脑边缘α6β2*nAChRs介导的;同时研究发现与对照小鼠相比,α6缺失小鼠在烟碱剂量-反应曲线上表现出向右移动,而α4缺失小鼠未能建立烟碱CPP,表明烟碱奖赏涉及α6α4β2*nAChRs。另外有研究表明,内侧僵核胆碱能神经元中含有α6亚基的nAChRs能够调节烟碱戒断所引发的焦虑症状[56]。
3.3 α7*nAChRs
Slotkin等[57]对大鼠进行烟碱给药(2 mg·kg-1·d-1或 6 mg·kg-1·d-1),使用[125I]-α-银环蛇毒素检测到纹状体中烟碱诱导的α7*nAChRs的瞬时上调。Doura等[58]对青春期的大鼠进行烟碱给药(2~6 mg·kg-1·d-1),观察到含 α4β2 和 α7 亚基受体的上调,并且发现青年和成年大鼠大脑中的α4β2*nAChRs和α7*nAChRs数量存在明显差异,相比α4β2*nAChRs,α7*nAChRs的数量变化程度较小。
针对烟碱依赖的研究表明,α7*nAChRs与烟碱引起的行为变化以及烟碱戒断症状有关[59]。通过阻断背侧纹状体α7*nAChRs可显著降低烟碱暴露引起的细胞外谷氨酸浓度的增加程度,并减弱大鼠的运动活力,表明烟碱暴露产生的行为变化与α7*nAChRs介导的大鼠背侧纹状体中的谷氨酸反应活化有关[60]。
3.4 α3*nAChRs
α3β4*nAChRs通常在与吸烟者脑内烟碱水平相当的烟碱浓度(50~200 nmol/L)下不上调,而在烟碱浓度大于等于10 mmol/L的情况下发生上调[61]。有意思的是,这种烟碱浓度仅可能在吸烟期间短暂出现在气道中。体外研究表明,与α3β2*nAChRs相比,α3β4*nAChRs对烟碱的诱导不太敏感,在能观察到α3β4*nAChRs上调的区域中,仅少数上调发生在细胞膜(细胞表面受体增加30%),大部分的上调存在于细胞内的细胞器中,其中约95%的α3β4*nAChRs上调发生在内质网中[61]。此外,有研究表明,α3β4*nAChRs介导烟碱的奖赏和躯体戒断症状[62]。Yuan 等[63]报道 α3β4*nAChRs部分激动剂AT-1001可减少大鼠的烟碱自给药,并能减弱戒断期间大鼠烟碱寻求行为的恢复。
综上可知,nAChRs的上调由于亚基组成、细胞类型和大脑区域的不同而存在差异,烟碱的暴露方式和暴露浓度也对受体的表达产生复杂的影响。研究显示,人吸烟后的烟碱浓度可以激活、脱敏和上调 α4β2*、α6β2*、α3β2*nAChRs,而含有α7和β4的nAChRs对烟碱似乎不太敏感,需要更高的烟碱浓度来激活[36,47]。
4 烟碱诱导nAChRs上调的调控机理
目前,围绕烟碱诱导nAChRs上调的作用机制一直存在广泛的讨论。研究表明nAChRs的上调不依赖于受体表达所在的细胞,并且当受体在除神经元之外的细胞中表达时也会在烟碱的诱导下发生上调,因此上调是受体本身固有的性质,不受细胞类型的限制[64]。一般认为nAChRs的上调作用发生在转录后,因为烟碱暴露不改变大鼠和小鼠脑中nAChRs亚基的mRNA表达水平;此外,当使用环己酰亚胺抑制蛋白质合成后,烟碱暴露仍会导致α4β2*nAChRs上调约10倍,表明受体上调发生在蛋白质翻译后[34,42]。以下总结了目前可能存在的几种烟碱诱导nAChRs上调的机制。
4.1 促进亚基的成熟和装配
有研究表明烟碱诱导nAChRs上调的关键步骤是受体的装配、转运及其在细胞表面的表达。Sallette等[65]研究发现烟碱暴露(10~1 000 mmol/L,24 h)通过增加亚基的装配对α4β2*nAChRs在细胞内的成熟过程起增强作用。Kuryatov等[66]发现在内质网中烟碱作为分子伴侣促进亚基的装配,从而导致nAChRs装配速率的增加,同时也使得细胞膜表面上nAChRs的寿命增加5倍。这些研究表明烟碱可直接上调细胞内和细胞膜上的nAChRs,进而揭示了烟碱在细胞内对nAChRs发挥诱导作用。但是,也有另外一些研究结果与装配机制存在矛盾,Vallejo等[67]发现烟碱暴露(10 mmol/L,17~18 h)导致[125I]-地棘蛙素与 α4β2*nAChRs的结合增加4~6倍,然而表面受体的数目并未发生显著变化,即使装配效率增加到100%,受体数量也不会明显增加。
4.2 增强nAChRs的转运
另一种烟碱诱导nAChRs上调的可能机制是受体向细胞表面胞吐转运的增加[68]。Darsow等[68]使用布雷菲德菌素A(brefeldin A,BFA)处理HEK-293T细胞,从而干扰膜蛋白分泌转运至细胞膜的过程,当处理后的细胞暴露于烟碱时,未能检测到烟碱诱导的nAChRs的上调,提示nAChRs通过分泌途径转运到细胞膜是烟碱诱导的nAChRs上调所必需的。Foxloe等[69]发现,烟碱暴露增强了α4β2*nAChRs向细胞表面的转运,同时也增加了其在内质网中的装配,两种机制的共同作用可能产生细胞表面受体的上调。但也有研究报道,使用BFA处理HEK细胞从而分散高尔基体并阻断高尔基体的运输后,烟碱诱导的[125I]-地棘蛙素结合位点的上调保持不变,表明上调可能并非来自于受体向细胞表面转运的增加[67]。
4.3 阻断亚基的降解
泛素化可调节配体门控受体(包括nAChRs)的降解、膜运输和转录,在哺乳动物突触中泛素-蛋白酶体系统影响突触传递和可塑性[70]。烟碱可通过与泛素-蛋白酶体系统相互作用影响nAChRs的降解,Rezvani等[71]研究发现,在与吸烟者血液中烟碱平均水平相当的浓度下,烟碱能够抑制蛋白酶体的活性,减少α7亚基的蛋白酶体依赖性降解,从而导致泛素化α7亚基的积累,并增加总体蛋白质水平。另外,在HEK细胞和重组HeLa细胞模型中,烟碱暴露也可减少α4β2*nAChRs[72]和 α3β4*nAChRs[61]的降解。
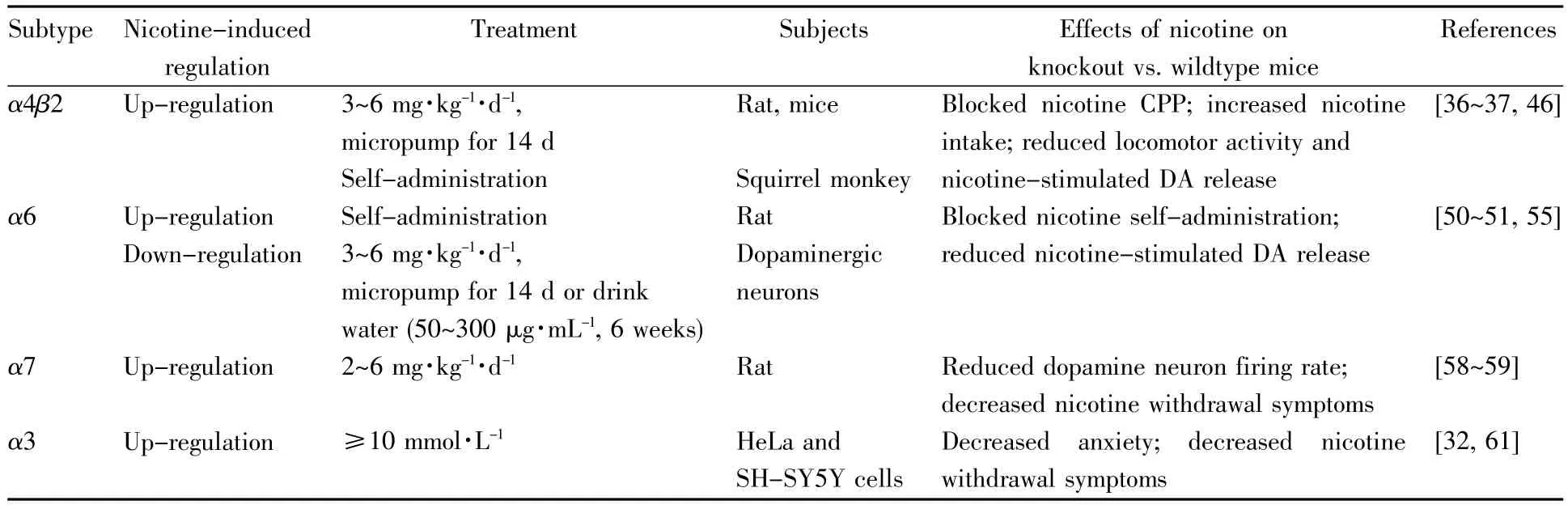
表2 烟碱暴露对不同nAChR亚型以及亚基敲除小鼠的影响Table 2 Effects of nicotine exposure on nAChRs and subunit knockout mice
4.4 改变亚基的化学计量
在哺乳动物细胞系中,α4β2亚型可以两种化学计量方式存在,即在五聚体中分别包含两个或三个α4亚基,其中具有两个α4亚基的亚型(α4)2(β2)3对烟碱具有较高的灵敏度[39]。亚基的定量研究显示,在稳定转染表达α4β2*nAChRs的HEK293细胞中,(α4)3(β2)2受体占优势,但长期暴露于烟碱(0.5~1 000 mmol/L 下暴露 14~72 h)会促进对乙酰胆碱高度敏感的(α4)2(β2)3受体的表达[65,67]。卵母细胞中编码α4和β2亚基的mRNA的不同比率可产生具有不同化学计量的受体,但是在慢性烟碱暴露后仅有(α4)2(β2)3受体明显上调,提示这种化学计量的变化对于烟碱诱导的α4β2*nAChRs的上调是关键的[73]。
Fasoli等[40]对C57BL/6小鼠皮质和丘脑的研究也支持了这一结论,皮质中(α4)2(β2)3的表达低于丘脑,但在慢性烟碱暴露下(α4)2(β2)3比例增加,表明烟碱暴露增加了包含3个β2亚基的(α4)2(β2)3的装配。然而,另有研究发现细胞表面的α4β2*nAChRs与[125I]-地棘蛙素结合的上调与亚基化学计量的变化不一致,这是因为一旦插入到细胞表面,受体亚基化学计量的变化就不太可能发生[67]。
4.5 改变nAChRs的构象
nAChRs存在两个独立的状态,一种状态为静息状态,对烟碱和其他激动剂的亲和力非常低,不会与放射性标记的激动剂进行显著的结合;另一状态为上调状态,对烟碱和其他激动剂的亲和力高,可与放射性标记的激动剂进行结合,状态之间的转换由烟碱调节[74]。烟碱暴露诱导受体从静息状态转变为上调状态,从而观察到结合位点数目的增加,但是受体数目并没有增加。Buisson等[75]研究表明α4β2*nAChRs的功能性上调主要由α4β2*nAChRs进入不同的功能状态引起,表现为脱敏率的变化、单通道电导的变化和乙酰胆碱浓度依赖性激活的变化。功能状态变化与构象变化一致。Vallejo等[67]提出,烟碱可能与细胞表面以及细胞内的nAChRs相互作用,引起构象变化,从而改变其功能以及对激动剂的亲和力。
5 总结与展望
神经型nAChRs广泛分布在整个中枢神经系统、外周神经系统和大脑其他部位,且不同区域数量不同,不同nAChR亚型表现出对烟碱不同程度的灵敏度,因而其受烟碱诱导产生的表达差异有所不同。PET作为非侵入性研究脑部nAChRs的定量分析方法,具有较好的分辨率和准确性,放射性配体的开发与应用使得PET具备实时定量检测人脑nAChRs的发展潜力,但目前放射性配体可识别的受体种类有限,且多限于动物实验,因此需要开发更高效更理想的放射性示踪剂以用于人脑中nAChRs的成像研究。随着检测技术的飞速发展,对于nAChRs分布与表达的研究已从单个亚基表达水平进化到对不同类型受体的成像检测和定量分析,人们可基于这些手段检测不同脑区nAChR亚型的分布差异和表达变化。目前,已有相当多的研究深入探讨了烟碱作用下各脑区中不同nAChR亚型的表达变化及其在烟碱成瘾中发挥的作用,并提出多个机制来解释烟碱诱导的上调:烟碱可在细胞内增加nAChRs组装、运输以及亚基的成熟和折叠,减少亚基的降解,并且能够改变亚基化学计量及受体构象。尽管针对烟碱调节nAChRs机制的研究已经取得了显著的进展,但许多研究结果之间存在矛盾,各个机制在烟碱诱导nAChRs上调中发挥的作用尚不清楚,同时也有研究显示不同的机制可能在细胞中共同发挥作用,所以之后的研究应更加重视烟碱作用下nAChRs的复杂变化以及多种作用机制之间的关联。目前的研究大多数仅关注某一种或几种受体,缺乏针对脑区各受体综合作用的整体性研究,同时成瘾不同阶段中各受体分布变化的研究也尚不充分。此外,基于吸烟者脑部受体变化的研究需要更成熟的受体成像和原位检测技术,从而实现对nAChRs的空间定位和实时定量检测,以便更深入地探究烟碱在体内的复杂作用,明确烟碱与nAChRs表达的作用机制,从而明确烟碱成瘾与nAChRs的相关性。
中枢神经系统中nAChRs的激活导致各种神经递质的释放增强,包括乙酰胆碱、多巴胺、谷氨酸和γ-氨基丁酸。大量研究表明nAChRs多种亚型介导烟碱成瘾、奖赏和戒断过程,并与帕金森病、阿尔茨海默病等神经疾病有关,因此nAChRs的结构、功能以及信号传导成为药物成瘾和精神疾病领域的研究热点。中脑多巴胺神经元在烟碱依赖的产生和维持中发挥关键作用,烟碱可通过多巴胺神经元中表达的nAChR亚型调节多巴胺释放及神经元活性。腹侧被盖区的谷氨酸神经元也是奖赏回路的重要组成部分,有研究显示nAChRs在谷氨酸神经元中表达,并且烟碱可通过nAChRs调节腹侧被盖区的兴奋性传递,表明腹侧被盖区谷氨酸神经元中的胆碱能机制参与烟碱诱导的级联反应[76]。另外,胆碱能也可调节海马区和记忆功能,研究表明 9 种亚基(α2~α7 和 β2~β4)在海马中表达,其中最丰富的是α7*nAChRs和α4β2*nAChRs,对烟碱具有高亲和力的 α4β2*nAChRs可介导海马中烟碱诱导的突触可塑性,α7*nAChRs则对Ca2+具有高度可渗透性,在突触调节中发挥重要作用[77]。烟碱通过奖赏回路各脑区中表达的nAChRs对突触传递、神经可塑性产生影响,进而产生成瘾等一系列变化,烟碱成瘾过程中nAChRs介导作用的研究尚不全面,同时烟碱作用下nAChRs相关信号通路的变化及其与成瘾之间的关联也有待进一步探讨。
