H2O2氧化对肉牛血红素蛋白构象与氧化性质的影响
2019-05-23陈皓马国源姬晓颖张晴马君义余群力
陈皓,马国源,姬晓颖,张晴,马君义,余群力*
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070) 2(青海百德投资发展有限公司,青海 西宁,810000)
在牛肉加工保藏的过程中,其品质受脂质氧化和蛋白质氧化的影响较大。目前,对于牛肉脂质氧化的研究和报道较多,吴宝森等[1]研究发现,牛肉组织中的亚铁血红素、金属离子和脂肪酸等促氧化因子均可以诱发蛋白质的氧化。同时,蛋白质的氧化也与自由基的链式反应有密切的关系[2]。蛋白质中的主链和侧链均易受到自由基如硝基自由基、超氧阴离子自由基和羟基自由基等的攻击[3],从而引起了蛋白质结构发生改变,进一步引起了蛋白质的性质发生变化。这些变化不但会引起肌肉特性的改变,还会引起肉品质构、风味和加工特性的改变[4]。因此,研究蛋白质氧化对肉品的品质影响意义重大。
我国肉牛产业逐渐成为畜牧业中的重要产业之一[5],2017年肉牛存栏数量稳定在1.0亿头以上。随着存栏量和产量的上升,牛肉的品质也在不断提高。由于冷却肉的品质要优于冷冻肉和热鲜肉,所以冷却肉会成为消费市场的主流[6]。但其在运输、储藏和销售过程中易受到光照、温度和氧气的影响,会造成肉品脂质和蛋白的氧化,进而影响肉品品质。拉曼光谱是一种非弹性散射光,它与分子或晶格的振动相关,所以常用于分子结构的分析,是测定多肽和蛋白质二级结构最有效最快捷的方式之一[8]。二硫键是一种比较稳定的共价键,它可以稳定肽链的空间结构。同时,二硫键数目越多,蛋白质对抗外界影响的稳定性越大[9]。由于二硫键的构型不同,可以引起二硫键所在位置的2个半胱氨酸残基的肽链相对构象发生改变,所以导致蛋白质的构象发生改变[10]。在使用强氧化剂时,强氧化剂可将形成的二硫键再次氧化为游离巯基[11]。NO自由基近些年备受关注,NO自由基具有多方面的重要作用,一方面是内皮细胞的松弛因子,可以松弛血管平滑肌,同时还可以防止血小板凝聚,另一方面也是一种神经传导的逆信使。机体自身会释放大量的NO自由基来杀伤侵入的肿瘤细胞或微生物,但是也可以损伤自身的正常细胞,对心肌和脑组织的损伤作用尤为明显[12]。SOD是生物体内最重要的抗氧化酶之一,其特殊的生理活性决定了它是清除氧自由基的首要物质。SOD不但能阻断氧自由基对细胞造成损伤,还能及时修复受损的细胞,并复原自由基对细胞的损伤[13]。
本实验采用H2O2氧化体系,以拉曼光谱分析卟啉环结构变化和红外光谱分析蛋白质二级结构的变化,并结合血红素蛋白的二硫键、NO自由基和SOD活性为指标,来探究氧化对牛肉血红素蛋白质构象和功能引起的改变。为从分子结构的改变阐明牛肉蛋白质氧化的规律提供了理论基础,并为研究新的抗氧化剂、针对性保藏技术、延长储藏期提供理论依据。
1 材料与方法
1.1 材料与试剂
试验材料:36月龄公牛背最长肌。
试剂:H202,分析纯,成都市科龙化工试剂厂;NaNO2,分析纯,烟台市双双化工有限公司;Tris-HCl、NTSB、EDTA、硫氰酸胍、甘氨酸、亚硫酸钠、Na3PO4,均为分析纯,国药集团化学试剂有限公司;NO自由基试剂盒,南京建成科技有限公司;SOD试剂盒,苏州科铭生物技术有限公司。
1.2 仪器与设备
ALPHALI-4 LD型真空冷冻干燥机,德国CHRIST公司;HR 800型激光显微拉曼光谱仪,法国HORIBA公司;WQF-400 N型傅里叶变换近红外光谱仪,北京第二光学仪器厂;TGL-24 MC型高速冷冻离心机,平凡仪器厂;HI 99163型pH计,哈纳沃德仪器(北京)有限公司;XHF-D型高速分散器,宁波新芝生物科技股份有限公司;756 P紫外可见分光光度计,上海光谱仪器有限公司。
1.3 试验设计
参考LU等[14]、王丽丽等[15]的方法,并略作修改。使用牛背最长肌提取血红素蛋白,并进行分离纯化。向血红素蛋白提取液中加入等体积的50 mmol/L pH 6.0的磷酸盐缓冲液,并向该体系中加入与提取液等体积的0、10和20 mmol/L的H2O2;25 ℃条件下反应24 h,使用与提取液等体积的EDTA终止氧化反应。之后将部分氧化体系溶液冻干成粉末用作光谱测定[16],其余样品置于冻样管中-80 ℃超低温冰箱冻存。
1.4 结构测定
1.4.1 卟啉环结构测定
参考LU等[17]方法,并略作修改。将冻干24 h的H2O2氧化后的血红素蛋白分别放在拉曼光谱仪下,激光波长532 nm,功率7.63 mW,狭缝宽度200 μm,光栅密度选择400 grades/cm,扫描范围为100~1 800 cm-1,每次扫描时间为20 s,积分3次,以苯丙氨酸为归一化因子。提取1 200~1 700 cm-1波段,对卟啉环中心尺寸进行分析。
1.4.2 二级结构测定
参考PRIM等[18]的方法,并略作修改。将冻干24 h的未处理血红素蛋白和H2O2氧化后的血红素蛋白置于光谱仪室平衡12 h,使得样品环境条件与光谱仪的条件一致。光谱仪分辨率为2 cm-1,全波段扫描,扫描次数64次;提取1600~1 700 cm-1波段,进行高斯拟合,对二级结构进行分析。在得到原始光谱图后,使用Origin 8.0软件对原始图谱进行去积卷,然后使用LabSpec软件去除其他干扰[19]。红外光谱可以清晰地定量反应蛋白质二级结构的变化,使用PeakFit 4.0软件对1 600~1 700 cm-1处谱图先进行基线校准、去积卷,再进行二阶导数拟合,并利用各子峰面积计算出各部分二级结构的比率[20]。
1.5 氧化性质测定
1.5.1 二硫键含量
参考THANNHAUSER等[21]的方法加以优化进行测定。称取100 mg 5,5′-二硫双(2-硝基苯甲酸)(5,5′-dithiobis(2-nitrobenozic acid))溶于10 mL 1 mol/L Na2SO3溶液中,调节pH值为7.25,将盛有溶液的烧杯至于38 ℃水浴锅中,加热1 h后与溶液(2 mol/L硫氰酸胍,50 mmol/L甘氨酸,100 mmol/L亚硫酸钠,3 mmol/L乙二胺四乙酸(ethylenediaminete traacetic acid),pH 9.5)按1∶100混合,所得溶液即为2-硝基-5-硫代磺基苯甲酸盐(2-nitro-5-thiosulfobenzoate)试剂。将血红素蛋白分散在25 mmol/L磷酸钠缓冲液中(pH=6.25),调整蛋白质量浓度为5 mg/mL。取100 μL稀释后的蛋白液与3 mL新鲜配制的NTSB溶液混合,在室温避光反应25 min,然后在412 nm下测定吸光值A。100 μL 25 mmol/L磷酸钾缓冲液(pH=6.25)代替蛋白液用于空白对照。使用分子吸光系数13 600 mol/(L·cm)计算二硫键含量,每个样本3个平行。
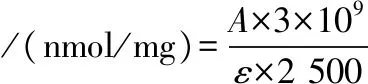
(1)
式中:A,吸光度;ε,摩尔消光系数。
1.5.2 NO自由基含量
参照南京建成NO自由基测定试剂盒说明书中方法进行测定。
(2)
1.5.3 SOD活性
参照苏州科铭生物技术有限公司SOD试剂盒说明书测定。
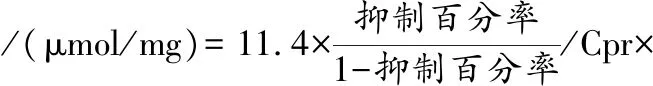
样品稀释倍数
(3)
1.6 数据处理与分析
所有实验重复3次;使用SPSS 19.0统计分析软件的Duncan’s法(P<0.05)检验,并进行显著性分析;数据绘图使用Origin 8.0软件。
2 结果与分析
2.1 血红素蛋白卟啉环结构变化
蛋白质的构型或者构象的变化可以引起拉曼光谱吸收峰位置、强度和退偏比的变化,从而可以反映出酰胺Ⅰ、酰胺Ⅲ带的变化及二级结构信息的变化和酪氨酸、色氨酸等侧链的构象信息[22]以及其对于血红素环骨架的振动模式。图1为不同浓度处理血红素蛋白的拉曼光谱图。

图1 不同浓度双氧水处理的血红素蛋白拉曼光谱图Fig.1 Raman spectra of heme protein treated with differentconcentrations of hydrogen peroxide
血红素中心尺寸和卟啉环间距主要由处于1 470~1 600 cm-1附近的谱带来确定,该区间是铁离子自旋态的敏感谱带,受血红素环内电子密度的影响较小,受次甲基键伸缩振动的影响较大[23]。由图1和表1分析可得,H2O2氧化处理后血红素的中心尺寸及卟啉环间距发生了变化。一般来说,1 470~1 505 cm-1为Cα-Cβ和Cα-Cm的拉伸模式,1 560~1 600 cm-1为Cβ-Cβ的拉伸模式。当使用H2O2氧化血红素蛋白后,可以发现该谱带峰值降低,且峰值区间左移,可以推测Fe2+的低自旋态变为Fe3+的高自旋态,氧化时,Fe与吡咯环的N原子距离增大,键长增长,血红素中心尺寸增大[24]。同时,dx2-y2的反键轨道电子密度增高。所以,Cα-Cm、Cα-Cβ、Cβ-Cβ的键长均增长[25]。
由上述分析可知,在氧化过程中,由于卟啉环中C原子间间距变大,C—C键键长增长,卟啉结构的扩张,中心Fe原子更加接近于卟啉环平面,此时,空间位阻和电子轨道能级跃迁的协同效应,二价铁由低自旋态转变为三价铁的高自旋态[26]。使得血红素蛋白的二级结构发生细微变化,从而引起了血红蛋白的功能变化。此时,血红素蛋白的携氧机制丧失,同时,血红素蛋白的抗氧化性也会发生改变。
2.2 血红素蛋白二级结构变化
蛋白质的二级结构是指蛋白质分子中的多肽链的各种折叠方式,比如α-螺旋、β-折叠、β-转角和无规则卷曲[27]。这些结构主要由酰胺Ⅰ带的谱峰指认,其中α-螺旋为1 650~1 658 cm-1、β-折叠为1 610~1 640 cm-1、β-转角为1 660~1 700 cm-1、无规则卷曲为1 640~1 650 cm-1[28]。酰胺Ⅰ带的谱峰指认目前已比较成熟且应用广泛。
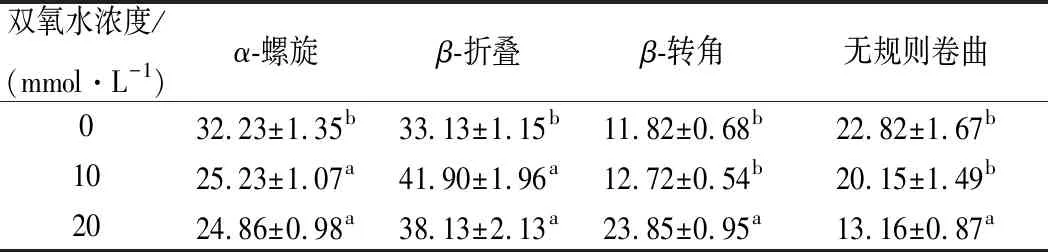
表1 不同浓度双氧水处理的血红素蛋白二级结构变化Table 1 Changes of secondary structure of heme proteintreated with different concentrations of hydrogen peroxide
注:小写字母代表不同处理组间差异显著(P<0.05),下同。
从表1可以看出,在血红素蛋白中主要是α-螺旋和β-折叠为主。H2O2处理时可能是蛋白质的收缩破坏了多肽链的反转,使其α-螺旋转化为β-折叠的收缩结构,这使得蛋白质结构趋向稳定[28]。多肽链反转180°形成了β-转角,H2O2的加入大幅度改变了肽链的结构,形成β-转角的氨基酸残基因为H2O2的氧化而增加,使其β-转角含量增加[29]。同样,由于α-螺旋结构中的氨基酸残基因为H2O2的氧化破坏了其旋转,使其转化为β-折叠和β-转角的结构[30]。但从构象角度来说,β-转角的空间位阻要比α-螺旋要小,所以H2O2会更加容易与β-转角中的氨基酸残基发生反应[31]。此时又由于α-螺旋中巯基易被氧化形成二硫键,所以β-折叠和β-转角会明显增加。
综上分析可知,H2O2处理可以使α-螺旋下降7.3%、β-折叠上升12.03%、无规则卷曲下降9.66%。从而明显改变蛋白质的二级结构,使得其功能性质发生了改变。
2.3 H2O2处理对血红素蛋白功能特性的影响
2.3.1 二硫键含量
蛋白质的氧化会使得肽链上的巯基交联形成二硫键,通常,蛋白质的氧化程度越高,其巯基含量越低,二硫键含量越高[32]。由图2可以看出,在使用10 mmol/L H2O2氧化时,二硫键含量比使用0 mmol/L H2O2氧化时显著上升30.77%;而使用20 mmol/L H2O2氧化时,二硫键含量比使用0 mmol/L H2O2氧化时显著上升56.67%,比使用10 mmol/L H2O2氧化时显著上升43.33%。在整个氧化过程中,由于氧化剂用量和氧化时间相同,所以氧化剂浓度是蛋白氧化程度的决定因素。故在氧化剂浓度增大时,蛋白质氧化会更加彻底,从而使其中巯基交联成二硫键,使其含量显著升高[33]。

图2 不同浓度双氧水处理的血红素蛋白二硫键含量变化Fig.2 Changes in the disulfide bond content of heme protein treated with different concentrations of hydrogen peroxide
2.3.2 NO自由基含量
NO自由基对细胞有双重作用,可以介导一系列生化反应,从而使细胞凋亡[34]。由图3可以看出,在使用浓度为0 mmol/L H2O2进行氧化时,其NO自由基含量为4.976 μmol/g;在使用浓度为10 mmol/L H2O2进行氧化时,其NO自由基含量为5.011 μmol/g;在使用浓度为20 mmol/L H2O2进行氧化时,其NO自由基含量为12.054 μmol/g。由此可以看出在使用低剂量H2O2氧化血红素蛋白时,NO自由基含量上升不显著,但在使用高剂量H2O2对血红素蛋白氧化时,其NO自由基含量显著上升。
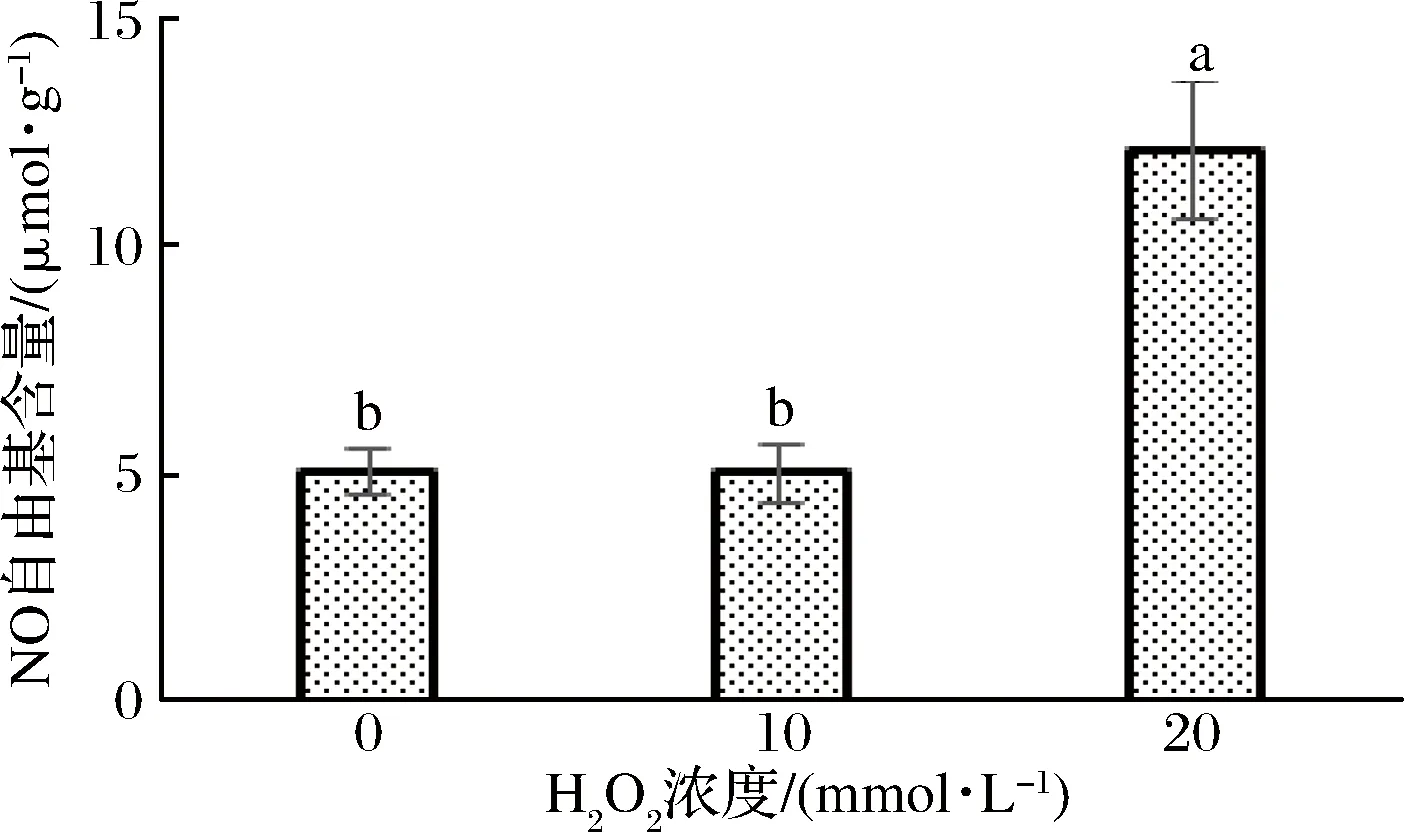
图3 不同浓度双氧水处理的血红素蛋白NO自由基含量变化Fig.3 Change of No free radical content of heme protein treated with different concentrations of hydrogen peroxide
2.3.3 SOD活性
SOD能够清除生物体在新陈代谢中产生的有害物质,尤其是超氧阴离子自由基,具有抗氧化、抗衰老的效果[35]。由图4可以看出,当使用浓度为0 mmol/L H2O2进行氧化时,其SOD活性为0.153 U/mg;在使用浓度为10 mmol/L H2O2进行氧化时,其SOD活性为0.159 U/mg;在使用浓度为20 mmol/L H2O2进行氧化时,其SOD活性为0.132 U/mg。在使用低剂量氧化剂氧化时,SOD活性会有略微上升,但在使用高剂量氧化剂进行氧化时,SOD的活性反而下降。由此可以推测,在使用低剂量氧化剂对血红素蛋白进行氧化时,其SOD活性受诱导效应产生应激性而略微升高[36]。随着H2O2浓度的升高,SOD活性降低,此时血红素蛋白抗氧化还原防御能力降低。
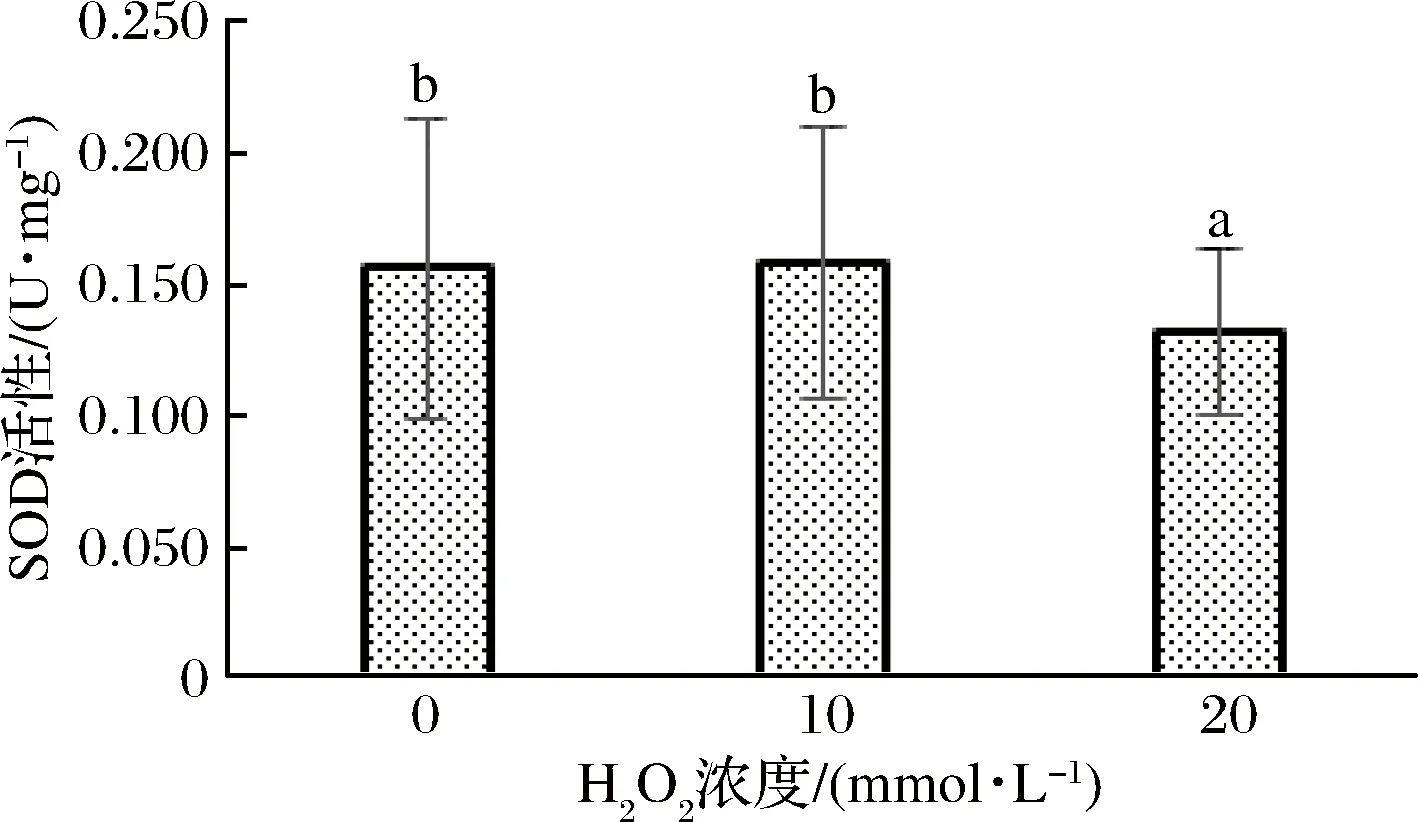
图4 不同浓度双氧水处理的血红素蛋白SOD活性变化Fig.4 Change of SOD activity of heme protein treated with different concentrations of hydrogen peroxide
3 结论
拉曼光谱结果表明,H2O2处理导致血红素蛋白中卟啉环的整体扩张,使得中心Fe更接近卟啉平面,并且Fe的氧化态发生改变,从而导致蛋白质的功能性质发生了改变。H2O2处理导致血红素蛋白的二级结构发生了显著的变化,样品氧化后,α-螺旋下降7.37%,β-折叠上升5%,β-转角上升12.03%,无规则卷曲下降9.66%。同时,在氧化后二硫键含量显著升高,此时,原本疏松的蛋白折叠结构变得更加紧密。从而使蛋白质的功能性质发生改变。
H2O2处理导致血红素蛋白氧化后,NO自由基含量明显升高,它可以同血红素蛋白形成较强的配位结合,并将Fe(Ⅱ)或Fe(Ⅲ)上的O2或者CO取代下来,从而使血红素蛋白构象发生改变,其自身的携氧机制丧失。H2O2处理导致血红素蛋白氧化后,SOD活性先略微升高后显著降低,其抗氧化能力降低。H2O2处理导致血红素蛋白卟啉环、二硫键和二级结构发生了改变,从而使得血红素蛋白的性质发生了改变。
