屎肠球菌Ef2的安全性评估及其产生物胺氧化酶培养和诱导条件的优化
2019-05-23李彬彬宋桂森全鑫杰蒲艳徐晔牛淑慧敖晓琳陈淑娟何利刘书亮杨勇
李彬彬,宋桂森,全鑫杰,蒲艳,徐晔,牛淑慧,敖晓琳,陈淑娟,何利,刘书亮,杨勇
(四川农业大学 食品学院,四川 雅安,625014)
生物胺(biogenic amine, BA)是一类具有潜在毒性的生物活性物质,食品中BA主要是在微生物氨基酸脱羧酶的作用下将游离的氨基酸脱羧而生成的,因此BA广泛存在于蛋白质丰富的发酵食品中。适量的BA是人体的活性物质[1],但摄入过量的外源BA则会危害人体健康[2-7]。面对发酵食品生产加工过程中高BA含量的问题,除采取控制前体物水平[8]、抑制产胺微生物生长[9]等措施外,常通过接种不具有氨基酸脱羧酶活性而具有生物胺氧化酶活性的微生物来降低发酵食品中BA含量,并取得了良好的效果[10-12]。
生物胺氧化酶(amine oxidase, AOs) 是广泛存在于动植物、微生物体内的能够将已生成的BA分解成相应的醛、氨气和过氧化氢的一类酶[13-14]。AOs作为BA代谢中的关键酶,一直是国内外BA降解研究的热点。AOs主要分为单胺氧化酶(monoamine oxidase, MAO)、二胺氧化酶(diamine oxidase, DAO)和多胺氧化酶(polyamine oxidase,PAO)。MAO多属于含铜氧化酶,主要氧化酪胺等;DAO主要作用于组胺和腐胺,属于含铜的氧化酶;PAO是指所有能氧化多胺类物质的酶,是催化多胺氧化降解的关键性酶[15-17]。在微生物体内,该酶可通过诱导产生,常见的诱导方式主要是在培养基中添加BA或以BA为主要氮源,通过对诱导培养基和培养条件的优化可提升微生物产AOs的能力。周小虎等[18]研究发现,当以正己胺为诱导氮源时,黑曲霉FF05产AOs酶活力最高,通过对诱导培养条件的优化,酶活力显著提高。
本研究室前期从四川香肠中筛选出了1株不具有氨基酸脱羧酶活性但具有AOs活性的微生物,经鉴定为屎肠球菌Ef2,研究发现,该菌株对发酵香肠中色胺、尸胺和组胺、腐胺均有高效的降解能力[19]。为了更好的利用该菌株,并保证发酵肉制品的安全性,本研究首先对该菌株的安全性进行检测,并在此基础上优化该菌株产AOs的培养条件和诱导条件,为分离和纯化该菌株产生的AOs提供了保证,也为深入研究该菌株产生的AOs奠定了基础。
1 材料与方法
1.1 实验材料
屎肠球菌Ef2 (Enterococcusfaecium),由四川农业大学肉品科学与技术实验室保藏。
金黄色葡萄球菌ATCC 25923 (Staphylococcusaureus),由四川农业大学动物微生物实验室保藏。
1.2 试剂与设备
辣根过氧化物酶(250 U/mg)、4-氨基安替比林、2.4.6-3溴-3-羟基苯甲酸等,成都康迪生物科技有限公司;细菌总DNA提取试剂盒、PCR相关试剂,天根公司;蒸馏水、超纯水为实验室自制。
SW-GJ-1FD超净工作台,苏净集团安泰公司;PCR和凝胶成像仪,Bio-Rad; Varioskan flash全波长酶标仪,美国Thermo Fisher Science公司; pH S-3C+酸度计,上海仪电科学仪器公司;SCIENTZ-950E超声波细胞破碎仪,宁波新芝生物科技公司;LHS-250SC恒温恒湿培养箱,上海荣丰有限公司。
1.3 实验方法
1.3.1 培养基的制作
种子培养基: MRS液体培养基。
诱导产酶培养基:乳糖 50 g,腐胺 6 g,酵母膏 8 g,MgSO43 g,MnSO40.03 g,K2HPO42 g,乙酸钠 1.5 g,吐温-80 1 mL,超纯水 1 L,调节pH值7.0,121 ℃灭菌20 min。
1.3.2 屎肠球菌Ef2的安全性评估
1.3.2.1 溶血实验
以金黄色葡萄球菌为阳性对照,用接种环蘸取活化的菌液,于血平板划线,37 ℃培养48 h后观察菌落长出后有无溶血现象。溶血与否按以下进行判断[20]:α-溶血,在菌落周围由于红细胞的不完全破裂形成草绿色溶血环;β-溶血,由于红细胞的完全破裂在菌落形成透明溶血环;γ-溶血,红细胞无损坏,菌落周围无变化未形成透明溶血环。选取具有γ-溶血特性的菌株,进行后续实验。
1.3.2.2 药敏实验
采用药敏片琼脂扩散法[21]进行药敏试验。所用的药敏纸片:庆大霉素、链霉素、氯霉素、替考拉宁、四环素、青霉素、红霉素、利福平、万古霉素、氨苄西林。
1.3.2.3 耐药基因的PCR检测
采用PCR法检测屎肠球菌Ef2中11种抗生素耐药相关基因[22-23],分别为TEM、aac(6′)/aph2、aph(3′)-Ⅲ、ant(6)-Ⅰ、ermB、TetM、VanA、VanB、mef、ant(2″)-Ⅰ和ant(4′,4″)基因。PCR反应程序为:预变性93 ℃、2 min,变性93 ℃、30 s,复性55 ℃、30 s,延伸72 ℃、1 min,35个循环,补充延伸72 ℃、5 min(其中ermB基因按预变性93 ℃、2 min,变性93 ℃、30 s,复性37 ℃、90 s,延伸72 ℃、2 min,35个循环,补充延伸72 ℃、5 min的条件进行)。将PCR扩增产物经1%琼脂糖凝胶电泳检测。
1.3.2.4 毒力基因PCR检测
择取7种常见的和公认的肠球菌毒力基因,分别为gelE、efaA、ace、asaI、cylA、esp和hyl基因,进行PCR扩增[24]。PCR反应条件为:预变性94 ℃ 4 min,变性90 ℃ 40 s,复性58 ℃、30 s,延伸72 ℃、1 min,35个循环,补充延伸72 ℃、5 min。PCR反应采用25 μL反应体系: DNA模板1 μL,premix Taq 10 μL,上/下游引物各 1 μL,ddH2O 12 μL。将PCR扩增产物经1%琼脂糖凝胶电泳检测。
1.3.3 诱导产酶培养基优化
1.3.3.1 不同氮源及其质量浓度对产酶的影响
在诱导产酶培养基中,分别以质量浓度4 g/L的组胺、酪胺、腐胺、尸胺、苯乙胺代替培养基中的氮源,与诱导产酶培养基中其他成分混合,接种培养;在确定最佳诱导氮源的培养基中,分别加入0.5、1、2、4、6、8、10 g/L的诱导氮源,接种培养。3个重复,测定AOs活性,以确定不同氮源及其质量浓度对产酶的影响。
1.3.3.2 不同碳源及其质量浓度对产酶的影响
分别以质量浓度20 g/L的葡萄糖、乳糖、麦芽糖、蔗糖、麦芽糊精、可溶性淀粉作为碳源,与诱导产酶培养基中除碳源以外的成分混合,接种培养;在确定最佳碳源的培养基中,分别加入10、30、50、70、90、100 g/L的碳源,接种培养。3个重复,测定AOs活性,以确定不同碳源及其质量浓度对产酶的影响。
1.3.3.3 酵母膏及其质量浓度对产酶的影响
在确定最佳碳源、氮源的培养基中,分别加入质量浓度0、1、3、5、7、10、15 g/L的酵母膏,接种培养。3个重复,测定AOs活性,以确定酵母膏对产酶的影响。
1.3.3.4 不同金属离子及其质量浓度对产酶的影响
在确定最佳碳源、氮源的培养基中,分别加入乙酸钠(1、3、5、7、9 g/L)、MgSO4(0.5、1、2、3、4 g/L)、MnSO4(0.03、0.04、0.05、0.06、0.07 g/L)、CuSO4(0.1、0.2、0.3、0.4、0.5 g/L)、K2HPO4(1、2、3、4、5 g/L),接种培养,筛选出对酶活影响较大的几种无机盐,采用L9(33)正交实验设计,进行正交实验。每个处理3个重复,测定AOs活性,以确定不同金属离子对产酶的影响。
1.3.3.5 诱导产酶培养基成分优化的正交实验
采用L9(33)正交实验设计,对单因素实验确定的碳源、氮源以及酵母膏质量浓度进行正交实验优化。
1.3.4 诱导产酶培养条件优化
1.3.4.1 不同初始pH值对产酶的影响
在最佳诱导产酶培养基中,分别选择初始pH值为5.0~8.0,以每增加0.5为1个处理。在37 ℃、静置培养48 h,每个处理3个重复,测定AOs活性,以确定最佳的初始pH值。
1.3.4.2 不同培养温度对产酶的影响
在最佳诱导产酶培养基中,最优初始pH值条件下,分别在25、28、30、34、37、40 ℃静置培养48 h,每个处理3个重复,测定AOs活性,以确定最佳培养温度。
1.3.4.3 不同接种量对产酶的影响
在最佳诱导培养基中,最优初始pH值、培养温度条件下,分别接种为1%、3%、5%、7%、9%的种子液,静置培养48 h,每个处理3个重复,测定AOs活性,以确定最佳接种量。
1.3.4.4 培养时间对产酶的影响
在最佳诱导培养基中,在最优初始pH值、培养温度、接种量条件下,分别静置培养12~72 h,以每增加12 h为1个处理,每个处理3个重复,测定AOs活性,以确定菌株的最佳产酶时间。
1.3.4.5 诱导产酶培养条件优化的正交试验
采用L9(33)正交实验设计,对上述诱导产酶培养条件进行正交优化。
1.3.5 AOs粗酶液的提取
将菌株诱导产酶的培养液在4 ℃ 8 000 r/min离心15 min后,获得菌体,用预冷的50 mmol/L pH 7.0的磷酸钠缓冲液冲洗细胞2次后,悬浮于10倍体积的缓冲液中。加入终浓度为20 mg/mL的溶菌酶,37 ℃处理2 h后,于冰浴下超声波破碎细胞(功率60%、超声时间30 min、工作时间6 s),镜检细胞破碎情况。4 ℃ 8 000 r/min离心15 min去除细胞碎片,上清液即为粗酶液。
1.3.6 酶活性的测定方法
参考FOSTER的方法[25],以将体系中AOs替换为胺氧化酶商品酶为阳性对照。以将体系中AOs替换为磷酸钾缓冲液为阴性对照。
酶活单位定义:以每分钟内510 nm吸光值变化0.01为1个酶活力单位(U)。相对酶活力以每组实验中酶活力最高为100%。
1.3.7 数据处理与统计分析
2 结果与讨论
2.1 屎肠球菌Ef2安全性检测结果
2.1.1 溶血实验结果
屎肠球菌Ef2的溶血实验结果如图1所示。观察血平板可知,接种金黄色葡萄球菌菌落周围形成透明溶血环,呈β-溶血。接种屎肠球菌Ef2区域无变化,为γ-溶血,即对溶血无作用或不溶血[20],因此可证明屎肠球菌Ef2非溶血菌株。
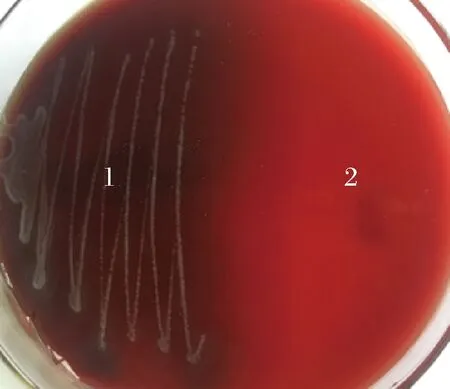
1-金黄色葡萄球菌; 2-屎肠球菌Ef2图1 溶血实验及其结果Fig.1 The results of hemolysis test
2.1.2 药敏实验结果
由表1可知:屎肠球菌Ef2对四环素、青霉素、红霉素、利福平、万古霉素、氨苄西林等大部分抗生素药物高度敏感,对替考拉宁中度敏感,对庆大霉素、链霉素和氯霉素不敏感。因此可认为屎肠球菌Ef2对绝大多数抗生素敏感,具有一定的安全性。
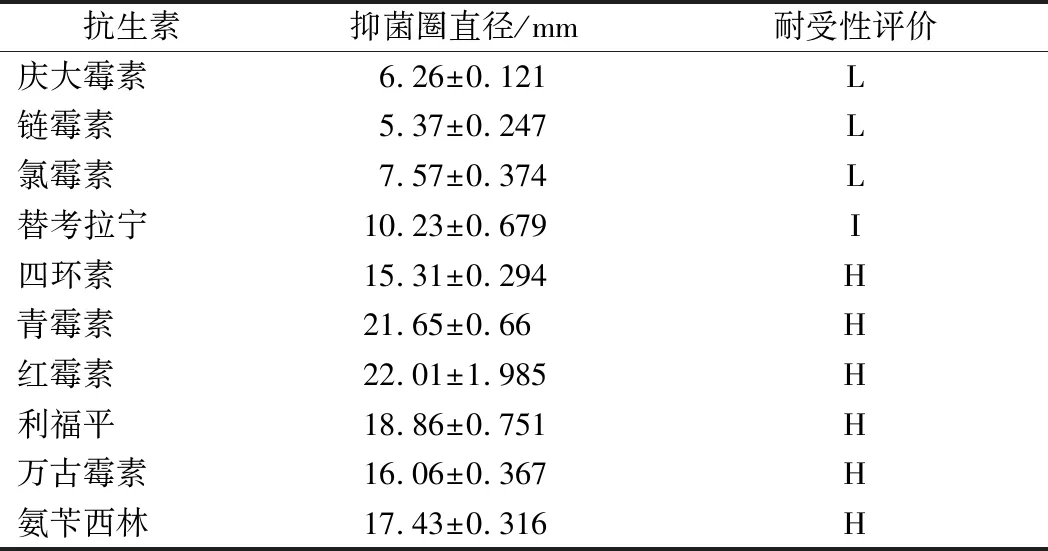
表1 药敏试验结果Table 1 The results of antibiotics susceptibility test
注:抑菌圈直径≥15高度敏感(H); 10~14中度敏感(I); <10不敏感(L)。
2.1.3 耐药基因的PCR检测结果
如图2所示,2号泳道165 bp左右出现了ant(4′,4″)基因的目的条带,其余耐药基因均无被检出。ant(4′,4″)基因为氨基糖苷类抗生素耐药相关基因,主要介导对庆大霉素、链霉素等氨基糖苷类药物的敏感程度[23]。该结果与药敏实验得到的结果基本一致,可以得出屎肠球菌Ef2对庆大霉素和链霉素不敏感,对四环素、青霉素和万古霉素等大多数抗生素敏感。
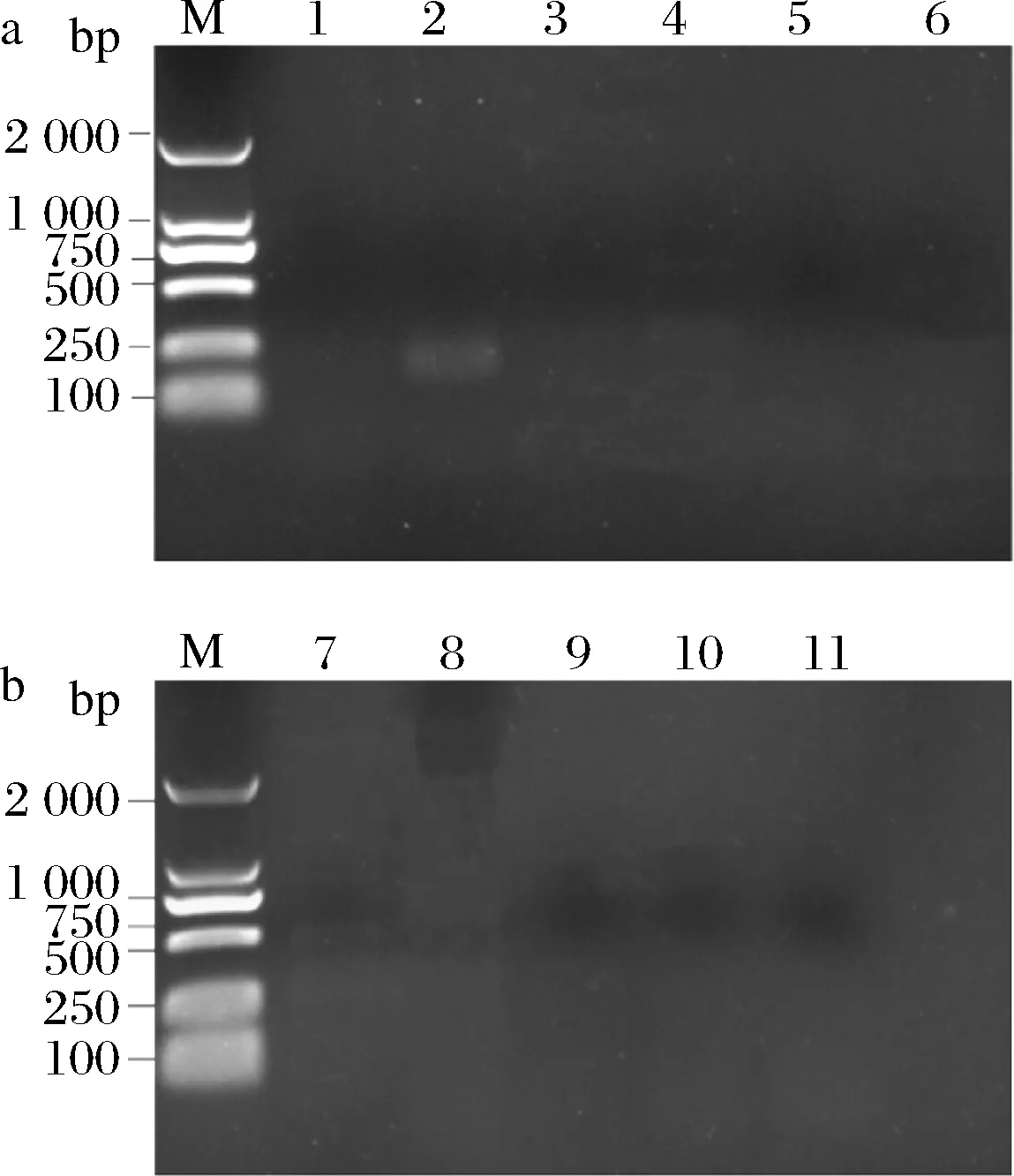
M-DNA marker; 1-VanA; 2-ant(4′,4″); 3-ermb; 4-TEM; 5-TetM; 6-VanB;7-ant(6)-I; 8-ant(2″)-I; 9-aac(6′)/aph(2″); 10-mef; 11-aph(3′)-III图2 屎肠球菌Ef2耐药基因的PCR电泳图Fig.2 The electrophoresis results of drug resistance genesPCR in Enterococcus faecium Ef2
2.1.4 毒力基因的PCR测定结果
毒力基因PCR产物经1%琼脂糖凝胶电泳检测,结果如图3所示,均无目的条带检出,表明屎肠球菌Ef2无毒力基因检出,可以判定该菌株不会产生常见的毒蛋白。毒力基因的检测已成为分析肠球菌安全性的重要标准之一[26],王晓蕊等[27]对豆酱中产细菌素的屎肠球菌进行PCR扩增,发现无毒力基因检出,初步证实该菌株是安全的。

M-DNA marker; 1-ace; 2-asaI; 3-cylA; 4-efaA; 5-esp; 6-hyl; 7-gelE图3 屎肠球菌Ef2毒力基因的PCR电泳图Fig.3 The electrophoresis results of virulence genes PCRin Enterococcus faecium Ef2
由于溶血性细菌易引起溶血现象,从而导致败血症的发生[21]。实验结果证实屎肠球菌Ef2不会引起溶血现象,对红细胞无影响。通过药敏实验和耐药基因PCR检测得出屎肠球菌Ef2对庆大霉素、链霉素不敏感,而对万古霉素等其他大部分抗生素抗菌药物敏感。毒力基因PCR结果无毒力基因检出,可判定该菌株不会产生相应的毒蛋白。因此结合溶血实验、药敏试验、耐药基因和毒力基因PCR检测结果可初步判定屎肠球菌Ef2是安全的,具有潜在的应用前景,可选取该菌株进行后续研究。
2.2 屎肠球菌Ef2诱导产酶培养基优化结果
2.2.1 氮源及其质量浓度对酶活力的影响
不同诱导氮源及其质量浓度对屎肠球菌Ef2产AOs活力的影响结果由图4所示。由图可知,腐胺作为诱导培养基的氮源时,酶活力最高,尸胺最低。随着腐胺质量浓度升高,AOs酶活力也随之升高,当腐胺质量浓度> 4 g/mL后,酶活力开始逐渐下降,由此可以得出,高浓度诱导氮源能够抑制酶活力。BA对微生物产AOs有着重要的影响,OKAMURA等[28]研究发现酪胺等BA能够特异性诱导Klebsiellaaerogenes产酪胺氧化酶。朱霞[29]分别用丙胺、正丁胺、正戊胺、正己胺、苄胺作为黑曲霉产AOs的诱导氮源,发现正己胺的诱导能力最好,丙胺和苄胺的诱导能力较差,因此选取正己胺作为唯一的诱导氮源。由于菌株的不同,以及BA之间的结构性质差异,影响着微生物对BA的利用。因此在后续的实验中选取腐胺为诱导氮源,其质量浓度为4 g/mL。

图4 不同氮源及其质量浓度对AOs酶活力的影响Fig.4 Effect of different nitrogen sources and mass concentrations on the activity of amine oxidase
2.2.2 碳源及其质量浓度对酶活力的影响
不同诱导碳源及其质量浓度对屎肠球菌Ef2产AOs酶活力的影响结果由图5所示。由图可知,不同碳源对AOs的诱导结果差异较大,说明碳源对屎肠球菌Ef2产AOs酶的影响较大,其中乳糖对产AOs的效果最好,蔗糖对产AOs的效果最差,低于40%。因此选择乳糖为诱导产酶培养基的碳源。随着乳糖质量浓度的升高,AOs酶活力呈先上升后下降趋势。当乳糖质量浓度为50 g/L时,酶活力最高。因此在后续实验中选择乳糖质量浓度为50 g/L。但在黑曲霉的相关研究中,发现碳源对菌株产AOs影响不显著,不同碳源条件下黑曲霉均能较好的完成生长[18],这可能是不同菌种之间的差异造成的。
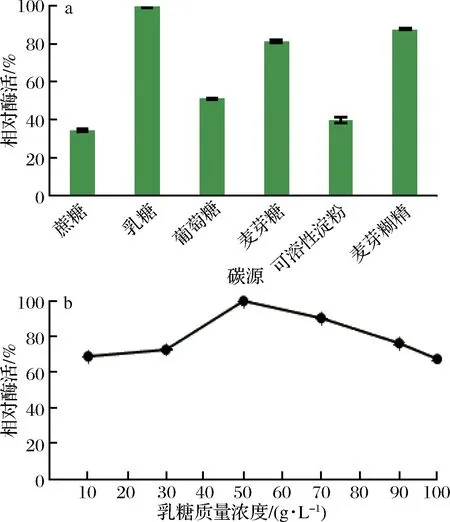
图5 不同碳源及其质量浓度对AOs酶活力的影响Fig.5 Effect of different carbon sources and mass concentrations on the activity of amine oxidase
2.2.3 酵母膏及其质量浓度对酶活力的影响
酵母膏及其质量浓度对屎肠球菌Ef2产AOs酶活力的影响结果由图6所示。当不添加酵母膏,即酵母膏浓度为0时,AOs酶活力最低。随着酵母膏质量浓度逐渐升高,AOs酶活力也随之升高,可知酵母膏的添加有利于AOs的产生,可能与酵母膏为菌株的生长提供了必要的生长因子有关[30]。当浓度>10 g/L时,酶活力下降,可得出高浓度的酵母膏能够抑制AOs酶活力。因此在后续实验中选取酵母膏质量浓度为10 g/L。
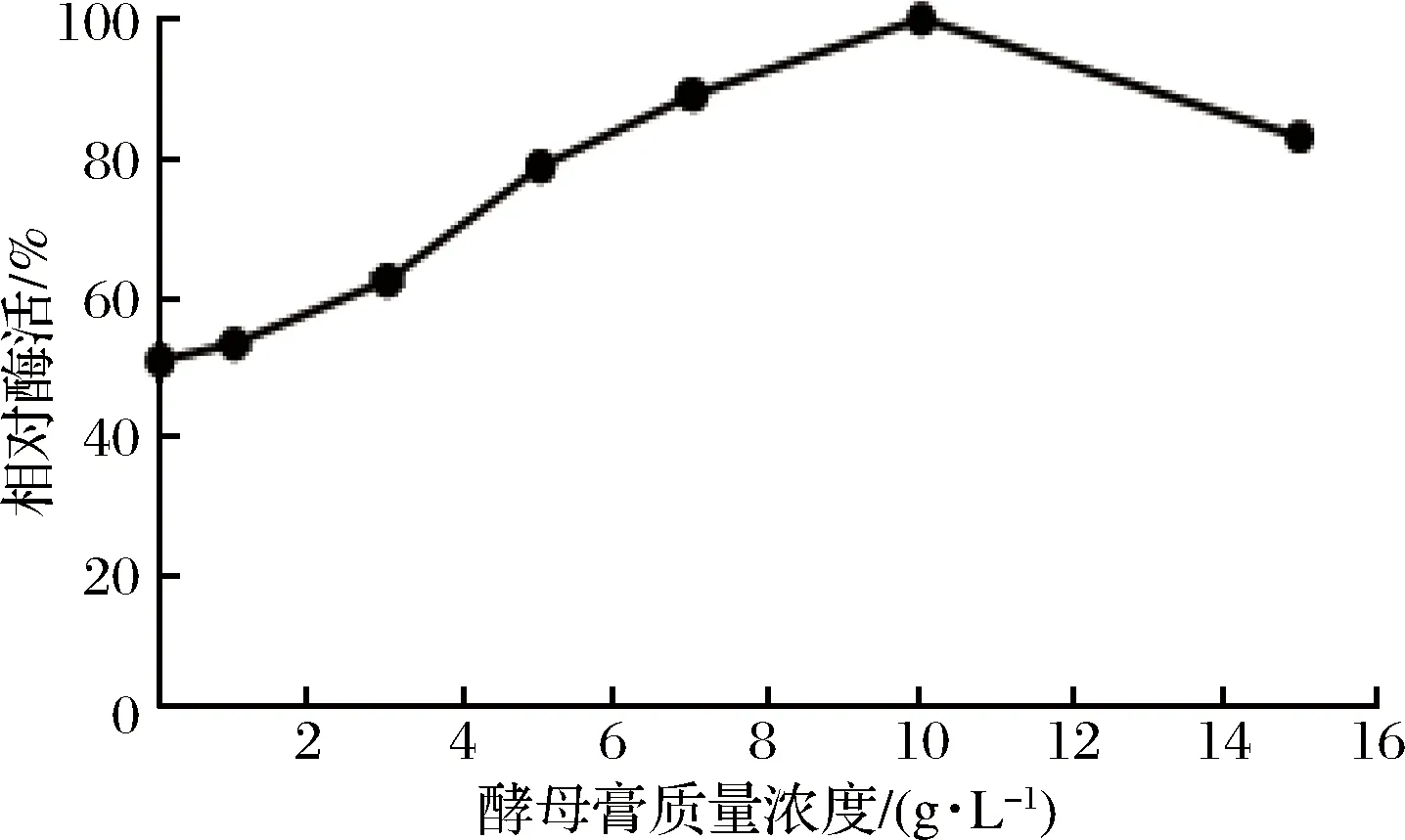
图6 酵母膏及其质量浓度对AOs酶活力的影响Fig.6 Effect of yeast extract and mass concentrations on the activity of amine oxidase
2.2.4 不同金属离子及其质量浓度对酶活力的影响
由不同金属离子及其质量浓度对屎肠球菌Ef2产AOs酶活力的影响结果表明Mg2+、Na+、Mn2+对屎肠球菌Ef2产生物胺氧化酶的影响较大,且在最适浓度处的酶活力较其他金属离子高,因此选择Mg2+、Na+、Mn2+进行后续的正交实验。
2.2.5 不同金属离子对产酶影响的正交实验结果
在诱导培养基中添加Mg2+、Na+、Mn2+,并对这3个因素的浓度复配进行正交实验优化。实验方案和结果如表2所示。
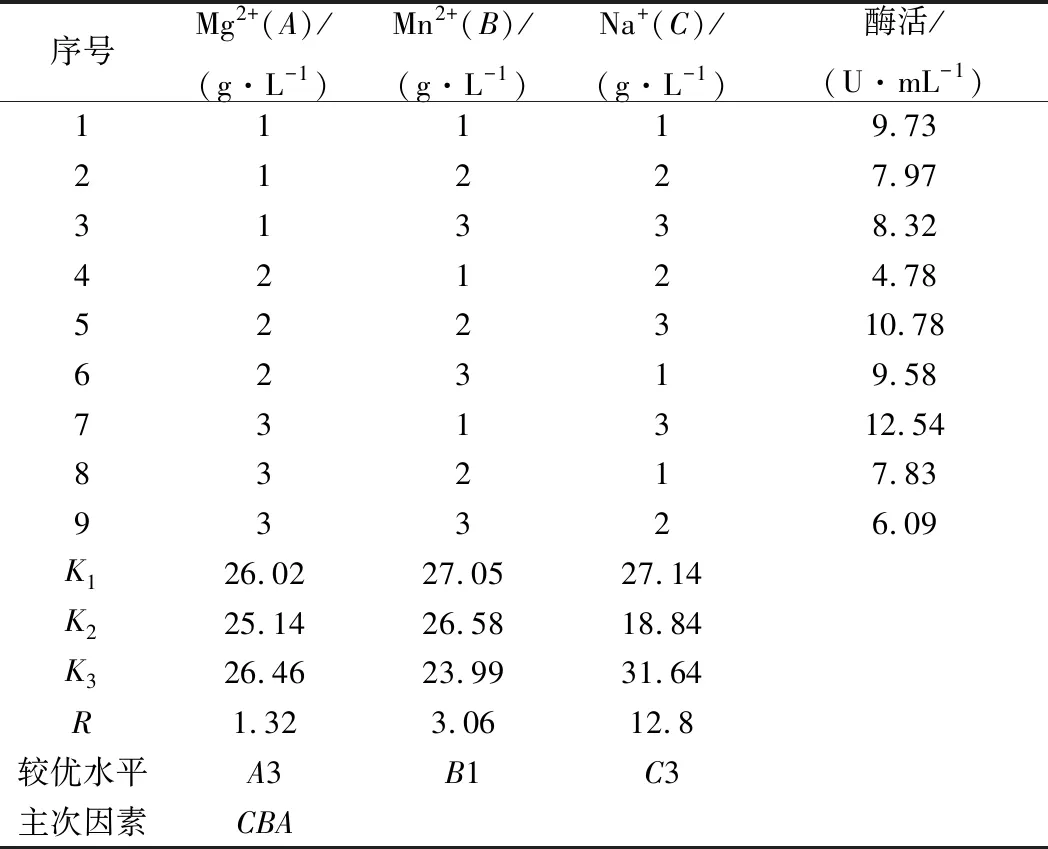
表2 不同金属离子对产酶影响的正交实验结果Table 2 Orthogonal test results of effect of differentmetal ions on enzyme production
由表2可知,Mg2+、Mn2+、Na+的极差值分别为1.32、3.06、12.8。Na+的极差值最大,其次为Mn2+。因此Na+和Mn2+在金属离子中是影响屎肠球菌Ef2产AOs的主要因素,Mg2+影响较小。3个因子的主次顺序为C→B→A。由表3方差分析结果可知,Na+在95%的置信度下影响显著,说明金属离子中Na+对诱导屎肠球菌Ef2产AOs有显著性差异,与极差分析结果相一致。而Mg2+和Mn2+对诱导屎肠球菌Ef2产AOs不存在显著性差异。
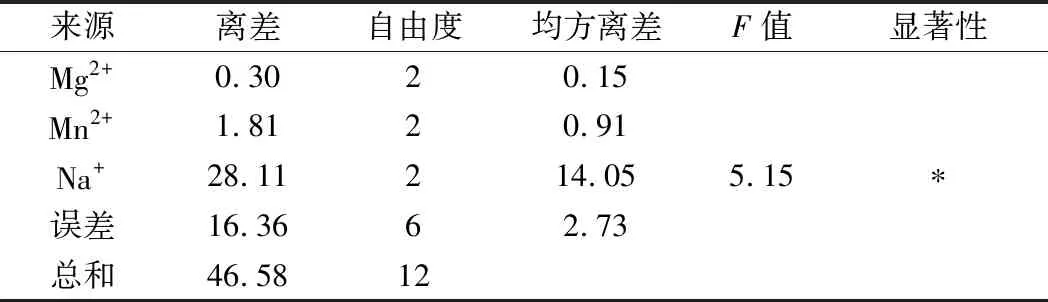
表3 正交实验方差分析表Table 3 Variance analysis of orthogonal experiment
注:*表示P<0.05。
根据此正交实验设计得出各因子的最佳水平为A3→B1→C3,即Mg2+、Mn2+、Na+的质量浓度分别为3 g/L、0.03 g/L、1.5 g/L得到的AOs的活力最高。在此条件下进行诱导产酶,得到酶活力为12.54 U/mL。
2.2.6 诱导产酶培养基的正交实验结果
由表4可知,碳源、氮源、酵母膏的极差值分别为5.95、16.48、7.01。氮源的极差值最大,其次为酵母膏。因此在以乳糖为主要碳源、腐胺为主要氮源的诱导产酶培养基中,氮源和酵母膏是影响屎肠球菌Ef2产AOs的主要因素,碳源影响较小。3个因子的主次顺序为B→C→A。由表5方差分析结果可知,氮源在95%的置信度下影响显著,说明氮源对诱导屎肠球菌Ef2产AOs有显著性差异,与极差分析结果相一致。而碳源和酵母膏浓度对诱导屎肠球菌Ef2产AOs不存在显著性差异。
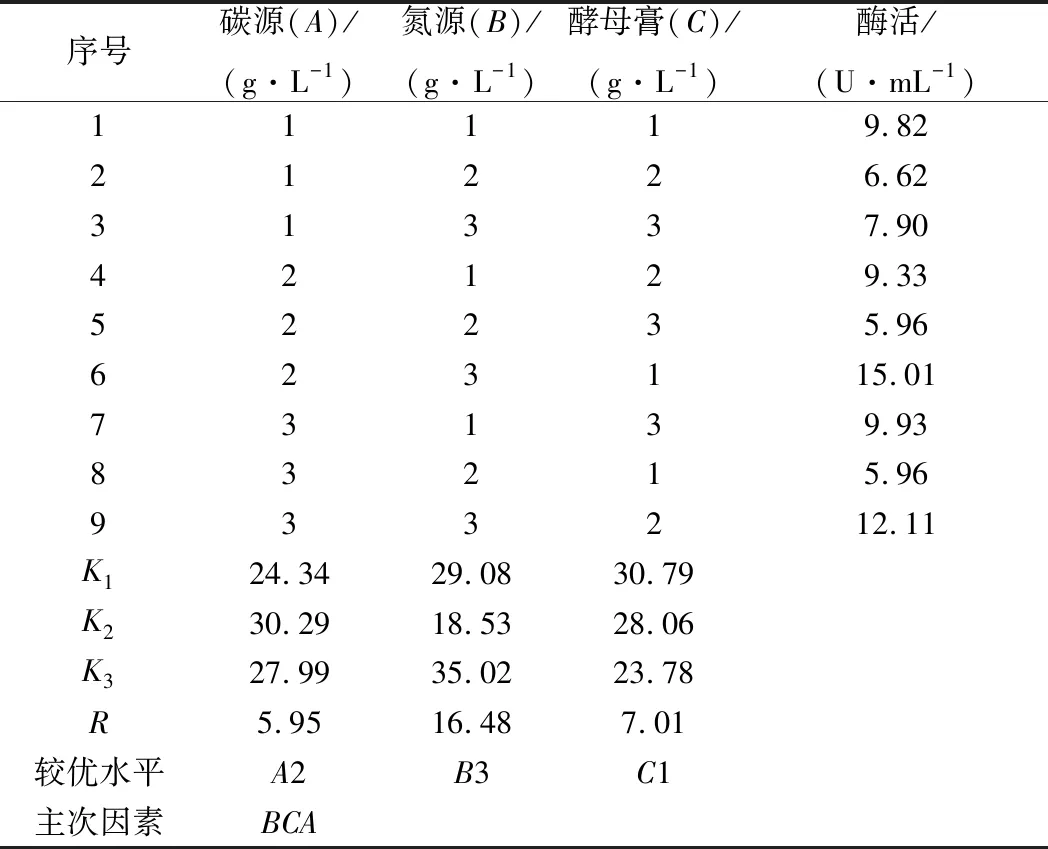
表4 诱导产酶培养基正交实验结果Table 4 Orthogonal test results of medium for theenzyme induction
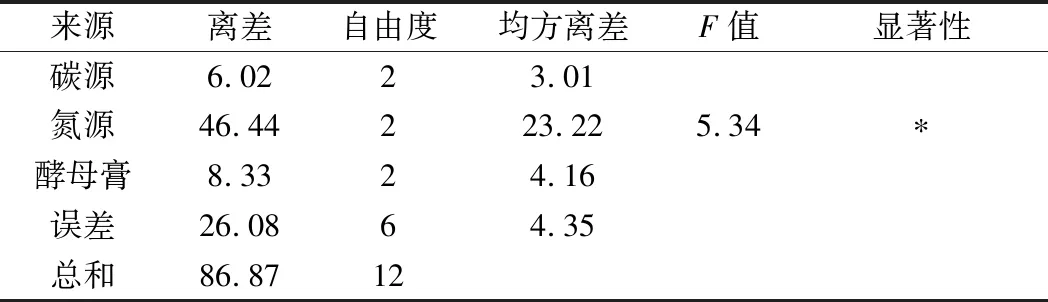
表5 正交实验方差分析表Table 5 Variance analysis of orthogonal experiment
注:*表示P<0.05。
根据此正交实验设计得出各因子的最佳水平为A2→B3→C1,即乳糖、腐胺、酵母膏的质量浓度分别为50、6、8 g/L得到的AOs的活力最高。在此条件下进行诱导产酶,得到酶活力为15.01 U/mL。
2.3 屎肠球菌Ef2诱导产酶培养条件优化结果
2.3.1 诱导产酶培养条件的单因素实验结果
当初始pH值为7.0时酶活力最高,最有利于AOs的产生。培养温度可能影响着菌株的生长代谢情况,当培养温度为30 ℃时,由于菌株的生长代谢旺盛,酶活力达到最高,因此选择诱导培养温度为30 ℃。当接种量为1%时,酶活力最高。随着培养时间的增加酶活力在36 h处达到最高,可能是由于以乳糖为碳源,以腐胺为主要氮源的诱导培养基并不适宜屎肠球菌Ef2的生长,在诱导产酶前期,菌株微生物为了适应培养基环境,分泌出AOs来维持生长;当培养时间超过36 h时,由于在微生物生长过程中,培养液处于动态变化之中,再加上菌株不能完全利用腐胺进行生长,随着营养物质不断消耗,各种代谢产物随着细胞的生长不断分泌出来,积累在培养基中,老化的细胞自溶,从而影响了AOs的产生,导致酶活力下降。
2.3.2 诱导产酶培养条件的正交实验结果
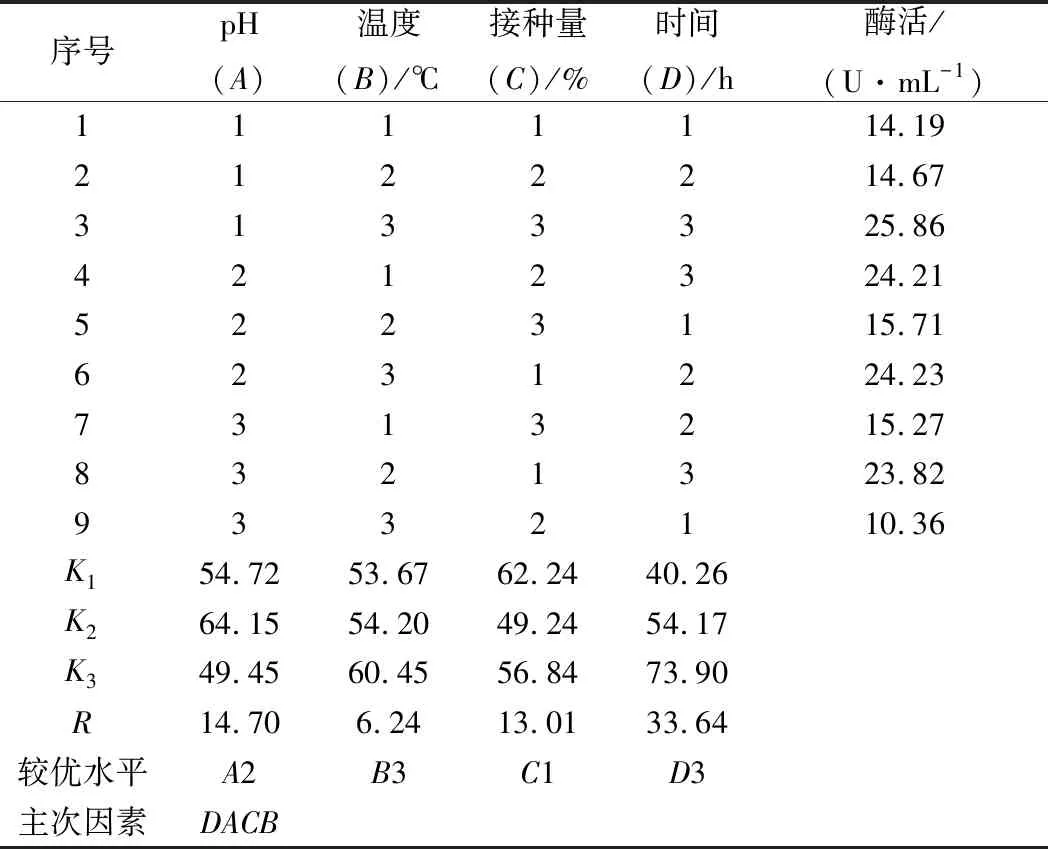
表6 诱导产酶培养条件正交实验结果Table 6 Orthogonal test results of culture conditions forthe enzyme induction
由表6可知,pH值、培养温度、接种量、培养时间的极差值分别为14.70、6.24、13.01、33.64。培养时间的极差值最大,其次分别为pH值、接种量、培养温度。因此在以乳糖为主要碳源、腐胺为主要氮源的诱导产酶培养基中,培养时间和pH值是培养条件中影响屎肠球菌Ef2产AOs的主要因素,培养温度的影响最小,说明培养时间对诱导屎肠球菌Ef2产AOs有着重要的影响。4个因子的主次顺序为D→A→C→B。根据此正交实验设计得出各因子的最佳水平为A2→B3→C1→D3,即pH、培养温度、接种量、培养时间分别为7.0、32 ℃、0.5%、36 h得到的AOs的活力最高,该结果与周小虎等[18]对黑曲霉产AOs培养条件优化的结果一致。在此条件下验证实验结果为26.12 U/mL。
经过上述实验对屎肠球菌Ef2产酶培养基和培养条件的优化,进行诱导产酶,酶活力提高了139.63%。
3 结论
采用溶血实验、药敏实验、常见的耐药基因和毒力基因的PCR扩增对屎肠球菌Ef2进行安全性检测,结果发现溶血实验呈阴性、无毒力基因检出,对庆大霉素、链霉素不敏感,而对万古霉素等其他大部分抗生素抗菌药物敏感,因此初步判定该菌株是安全的,具有潜在的应用前景,可用作后续实验的研究对象。通过单因素结合正交实验对屎肠球菌Ef2产AOs的诱导培养基和培养条件进行优化,最后确定诱导培养基的最佳成分为:乳糖50 g/L、腐胺6 g/L、酵母膏8 g/L、MgSO43g/L、MnSO40.03 g/L、乙酸钠1.5 g/L,最佳培养条件为:初始pH 7.0、接种量0.5%、培养时间36 h、培养温度32 ℃。AOs酶活力从诱导前的10.9 U/mL提升至26.12 U/mL,酶活力提高了139.63%。本研究结果表明,屎肠球菌Ef2是安全的,不具有产毒基因,这对接种该菌株于发酵肉制品中来降低其中BA提升发酵肉制品的食用安全性具有重要意义,并且通过对培养及诱导条件的优化可显著提升该菌株产AOs的活力,为深入研究AOs提供了理论基础。
